Force de van der Waals
Définition
La force de van der Waals est une force à courte portée existant à la fois dans les phases gazeuse et liquide en raison de la fluctuation des nuages d'électrons entourant le noyau. Elle peut être déterminée par la théorie de London-van der Waals (théorie microscopique) ou Lifshitz-van der Waals théorie (théorie macroscopique).
Les forces de Van der Waals, également connues sous le nom de liaisons de van der Waals ou d'interaction de van der Waals, sont des interactions intermoléculaires faibles observées dans les phases condensées comme le solide et le liquide. Elles sont responsables des propriétés globales des substances, comme les points d'ébullition et de fusion. Les liaisons de Van der Waals sont des liaisons secondaires dans les molécules où les liaisons ioniques et covalentes forment les liaisons primaires.
Les forces de van der Waals :
Les forces de van der Waals sont des forces électriques relativement faibles qui attirent les molécules neutres les unes vers les autres dans les gaz, dans les gaz liquéfiés et solidifiés, et dans presque tous les liquides et solides organiques.
Explications
Les forces de Van der Waals sont un groupe d'interactions entre atomes ou au sein de molécules individuelles qui interviennent sur la base de l'interaction de nuages d'électrons entourant deux systèmes polaires. Ces séries d'attractions et de répulsions se forment en conséquence de la fluctuation de polarisation entre les particules voisines. Bien qu'encore plus faibles que la liaison H, l'attraction hydrophobe et l'interaction ionique, les forces de Van der Waals jouent un rôle vital dans la stabilisation des complexes immuns. Ces forces forment des liaisons à courte distance, qui peuvent disparaître si les systèmes chargés réduisent leur proximité.
L'interaction de Van der Waals joue un rôle central dans la chimie organique, la biochimie et les sciences des matériaux. il est lié aux dipôles transitoires, produisant peu de manifestation dans la densité électronique.
Les forces de van der Waals sont des forces électrostatiques causées par un moment dipolaire fluctuant temporairement résultant d'un bref déplacement d'électrons orbitaux d'un côté d'un atome ou d'une molécule, ce qui crée un déplacement similaire dans les atomes ou molécules adjacents. Les forces de Van der Waals sont des interactions non spécifiques qui peuvent se former entre n'importe quel type de molécules, quelle que soit leur structure chimique. Les liaisons van der Waals individuelles sont de courte durée, mais cette forme de liaison peut atteindre une plus grande permanence si de nombreuses liaisons de ce type sont formées à la fois sur la substance adsorbante et sur la surface, car à un moment donné, suffisamment de liaisons van der Waals peuvent suffire pour empêcher la désorption. Ceci est parfois important pour la liaison de matières organiques de haut poids moléculaire telles que les protéines aux surfaces.
L'histoire de cette force remonte à 1923 lorsque le physicien néerlandais Johannes Diderik van der Waals (1837–1923) postula son existence.
Phénomène d'attraction ionique
Les forces de Van der Waals interviennent en raison des fluctuations de la densité de charge des particules. En conséquence, un atome ou une molécule est polarisé avec des charges positives à une extrémité et des charges négatives à l'autre extrémité. La polarisation donne lieu à des forces électrostatiques entre les deux atomes ou molécules. Ces forces faibles sont responsables du maintien des atomes ou des molécules ensemble. Les forces de Van der Waals disparaissent à mesure que les distances entre les atomes ou les molécules augmentent.
Le rayon de Van der Waals est le rayon d'une sphère imaginaire entourant un atome. Il représente la distance d'approche la plus proche pour un autre atome. En d'autres termes, le rayon de van der Waals est la moitié de la distance de séparation entre le centre des deux noyaux qui s'approchent. C'est un paramètre qui détermine si les atomes ou les molécules se tiendront ensemble dans un solide ou un liquide.
Propriétés des forces de van der Waals
Voici quelques caractéristiques des forces de van der Waals :
- additives : plusieurs forces interactives intermoléculaires s'additionnent pour former une force quantifiable.
- Non directionnelles : elles peuvent attirer des atomes ou des molécules de toutes les directions.
- Plus faibles que les liaisons chimiques ioniques et covalentes.
- N'agissent que sur une courte distance. L'interaction est significative lorsque les molécules sont positionnées plus près.
- Indépendantes de la température, sauf interactions dipôle-dipôle.
Types de forces de van der Waals
Il existe deux types de forces de van der Waals :
- Forces de dispersion de London : les forces de dispersion de London sont des forces intermoléculaires qui interviennent entre deux atomes ou deux molécules non polaires en raison du mouvement des électrons. Un atome se compose d'un noyau et d'électrons qui se déplacent sur des orbites. À tout moment, les électrons peuvent se regrouper autour d'une partie de l'atome. En conséquence, l'atome devient chargé négativement à une extrémité et chargé positivement à l'autre extrémité, ce qui donne un dipôle instantané. Ce dipôle faible et temporaire influence alors les atomes voisins par attraction et répulsion électrostatique, induisant ainsi des dipôles. Les dipôles induits sont faiblement attirés les uns vers les autres. La force des forces de dispersion augmente à mesure que le nombre d'électrons dans les atomes ou les molécules non polaires augmente.
Ces forces portent le nom de Fritz London, qui a proposé leur existence pour la première fois en 1930. Ex. : hélium (He), chlore (Cl2) et tétrachlorure de carbone (CCl4).
- Interactions dipôle-dipôle : les interactions dipôle-dipôle ou forces dipôle-dipôle résultent de la polarisation électrique induite par les particules en raison de la présence d'autres particules. Elles sont similaires aux forces de dispersion de London, mais elle surviennent dans des molécules qui ont un dipôle permanent. Ici, l'extrémité négative d'une molécule polaire attire l'extrémité positive d'une autre molécule polaire. Cette attraction entre ces deux molécules est connue sous le nom de force dipôle-dipôle.
La liaison hydrogène est un type particulier d'interaction dipôle-dipôle. Ex. : eau (H2O) et chlorure d'hydrogène (HCl).
Deux facteurs affectent les forces de van der Waals :
- Nombre d'électrons détenus par l'atome ou la molécule : la force des forces de van der Waals dépend principalement du nombre d'électrons dans l'atome ou la molécule. Ainsi, les atomes et les molécules plus gros auront des forces plus importantes.
- Forme de la molécule : pour les molécules isoélectroniques, c'est-à-dire les isomères ayant le même nombre d'électrons, le facteur qui détermine l'intensité de la force de van der Waals est la forme de la molécule et la surface de contact. Si l'isomère est ramifié, les molécules sont étroitement tassées. Dans ce cas, les forces de van der Waals seront faibles.
Forces de Van der Waals dans la vraie vie
Geckos : les forces de Van der Waals sont essentielles dans gecko. Gecko utilise les forces de van der Waals pour coller sur les surfaces et escalader les murs. Ils ont des soies sur les coussinets de leurs pieds, ce qui leur permet de grimper sur des surfaces extrêmement lisses comme le verre. Cette force provient des fluctuations des distributions de charge entre molécules voisines. Les fluctuations de charge sont synchronisées, créant ainsi une force d'attraction.
graphite : les forces de Van der Waals lient les différentes couches de graphite en utilisant des forces de dispersion. Le graphite est disposé en plusieurs couches de feuilles minces. Entre chaque couche, il existe des forces intermoléculaires de van der Waals qui sont faibles par rapport aux liaisons covalentes CC régulières. Pour chaque atome de carbone, il existe un électron délocalisé puisque le carbone ne forme que trois liaisons. Comme tous les électrons délocalisés se déplacent dans la feuille, de très grands dipôles temporaires induiront des dipôles opposés dans les feuilles au-dessus et en dessous. Finalement, le dipôle induit sera présent dans tout le cristal.
Synonymes, antonymes
Voir tous les synonymes pour "force de van der Waals".2 synonymes (sens proche) de "force de van der Waals" :
- interaction de van der Waals
- liaison de van der Waals
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à FORCE DE VAN DER WAALS sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression FORCE DE VAN DER WAALS est dans la page 3 des mots en F du lexique du dictionnaire.
Mots en F à proximité
foramen foraminifère forçage force d'un acide force d'une base force de van der Waalsforce électrostatique force génératrice de la marée force motrice forcipule foresterie
En rapport avec "force de van der Waals"
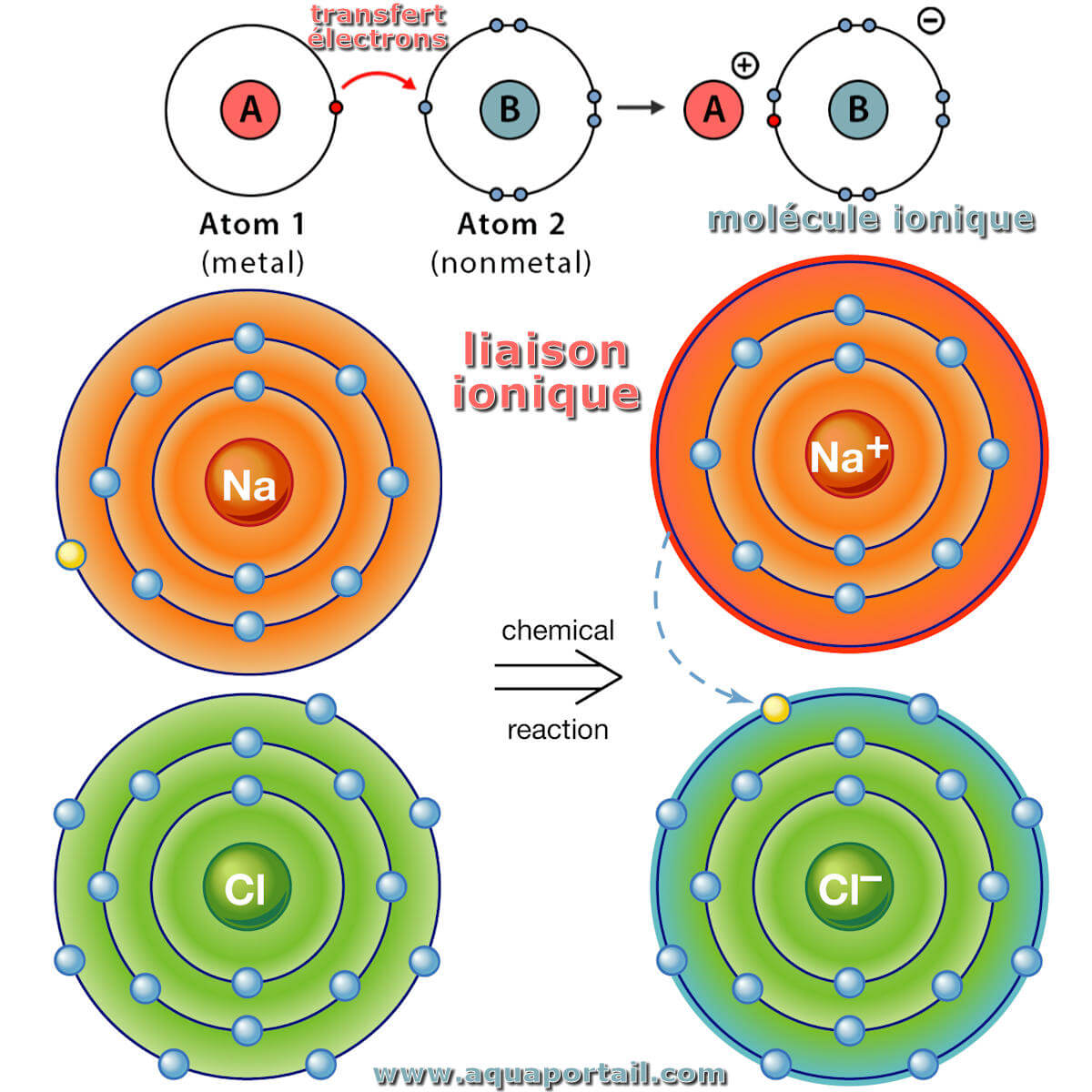
Une liaison ionique est l'attraction électrostatique qui unit des ions de charges opposées dans les composés ioniques.

Une protéine en hélice qualifie la forme structurelle d'un protéine, pour la distinguer des formes en feuillet bêta.
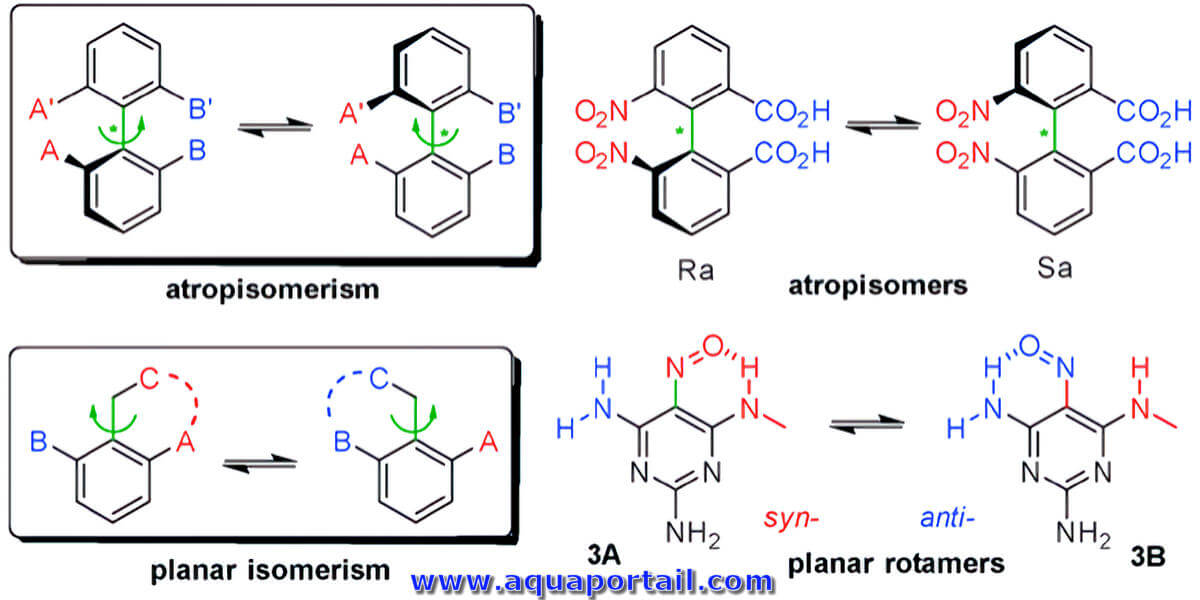
Un rotamère est un conformère avec une structure rotationnelle. La conformation de l'isomère (stéréoisomère) résulte d'une rotation restreinte autour d'une...
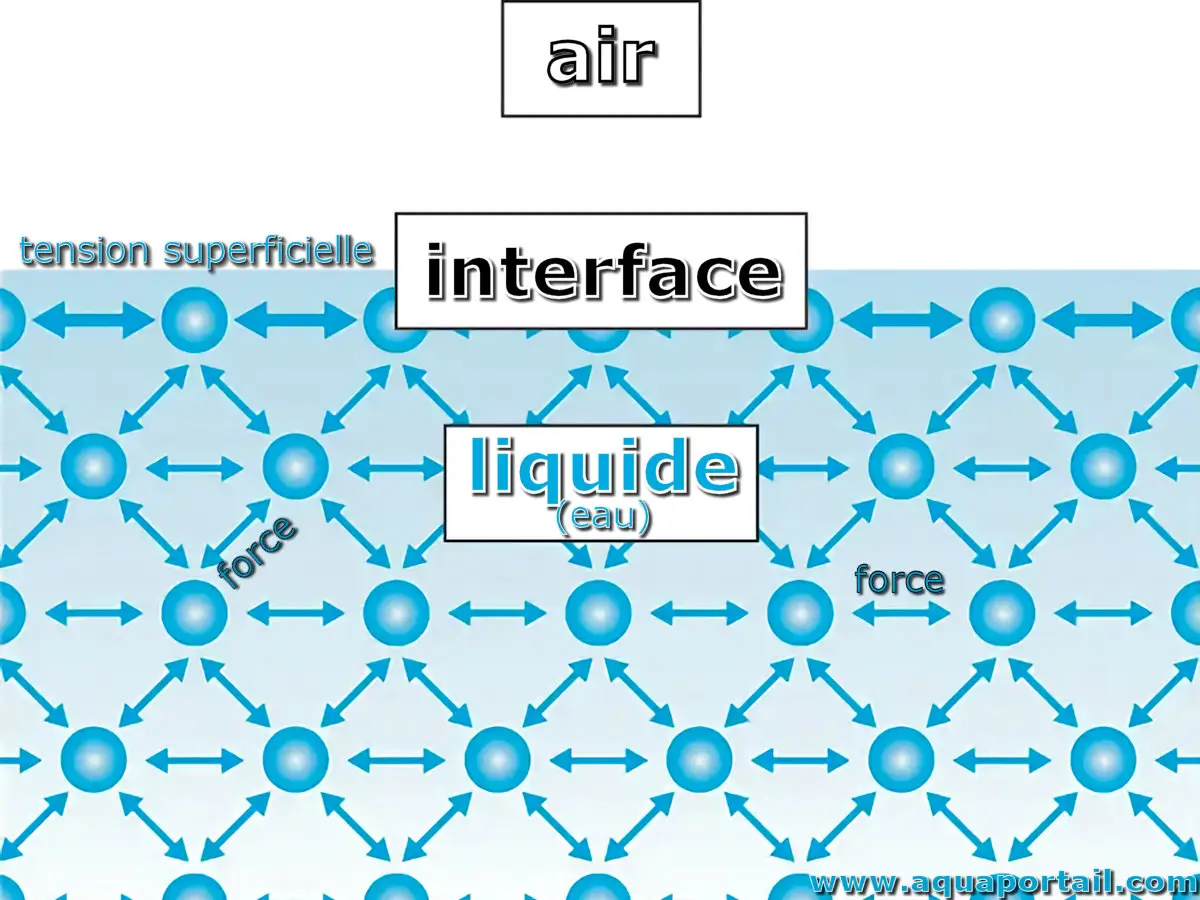
La tension superficielle est le phénomène de la surface d'un liquide qui se comporte comme une membrane élastique tendue.
