Force d'une base
Définition
La force d'une base se définit par l'opposé de l'acidité d'un acide, et est le contraire de la force d'un acide. Plus une base est forte, moins l'acide l'est, et inversement dans une proportionnalité des ions H+. La force de la basicité est sa faculté, avec facilité, à capter un ion positif de l'eau (un proton).
Liste des forces des bases :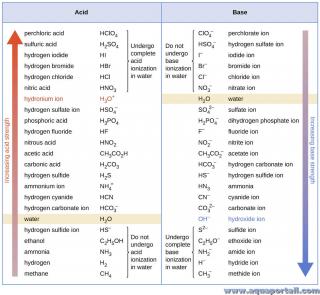
Il est possible de mesurer les forces relatives des bases en mesurant leur constante d'ionisation de base (Kb) dans des solutions aqueuses. Dans des solutions de même concentration, les bases plus fortes s'ionisent davantage et produisent ainsi des concentrations d'ions hydroxyde plus élevées que les bases plus faibles. Une base plus forte a une constante d'ionisation plus grande qu'une base plus faible.
Explications
La force de base d'une espèce est sa capacité à accepter H+ d'une autre espèce (théorie de Brønsted-Lowry). Plus la capacité d'une espèce à accepter un H+ d'une autre espèce est grande, plus sa force de base est grande. Les chimistes organiques comparent habituellement la force des bases en utilisant la force de leurs acides conjugués, mesurée en pKa.
La force d'une base dépend de la structure moléculaire de la base et du couple acide-base dans lequel la base est conjuguée avec l'acide.
La force d'une base augmente avec sa possibilité de dissociation dans l'eau. Par exemple, la base la plus forte dans l'eau est OH- car la dissociation est totale. Elle est le contraire d'une base faible, la force étant mesuré par le pKa, où Ka, la constante d'acidité, est la constante thermodynamique qui caractérise cet équilibre acide-base. Plus la base est forte, moins a tend vers 1, donc plus le Ka est faible, et le pKa augmente.
Tous les acides et bases ne s'ionisent pas ou ne se dissocient pas dans la même mesure. Cela conduit à affirmer que les acides et les bases ne sont pas tous de force égale pour produire des ions H+ et OH- en solution. Les termes "fort" et "faible" donnent une indication de la force d'un acide ou d'une base. Les termes fort et faible décrivent la capacité des solutions acides et basiques à conduire l'électricité. Si l'acide ou la base conduit fortement l'électricité, c'est un acide ou une base fort. Si l'acide ou la base conduit faiblement l'électricité, c'est un acide ou une base faible.
Pour déterminer la basicité d'une molécule, il faut regarder l'atome en question; cependant, nous voulons maintenant nous concentrer sur la quantité de densité électronique concentrée sur cet atome. Moins la molécule est stable (ce qui intervient lorsque beaucoup de densité électronique est concentrée sur un atome), plus elle voudra donner une partie de sa densité électronique en acceptant un proton; par conséquent, la base la plus forte sera celle avec les électrons les plus énergétiques (ou celle avec la densité électronique la plus concentrée, car cela provoque plus de répulsion électron-électron qui est soulagée après la protonation).
L'eau est la base qui réagit avec l'acide HA, A- est la base conjuguée de l'acide HA et l'ion hydronium est l'acide conjugué de l'eau. Un acide fort donne 100 % (ou presque) de H3O+ et A- lorsque l'acide s'ionise dans l'eau.
Nous pouvons classer les forces des bases en fonction de leur tendance à former des ions hydroxyde en solution aqueuse. La réaction d'une base de Brønsted-Lowry avec l'eau est donnée par : B(unq) + H2O(je) ⇌HB+(unq) + OH-(unq).
L'eau est l'acide qui réagit avec la base, HB+ est l'acide conjugué de la base B et l'ion hydroxyde est la base conjuguée de l'eau. Une base forte donne 100 % (ou presque) de OH- et HB+ lorsqu'elle réagit avec l'eau.
Synonymes, antonymes
1 synonyme (sens proche) de "force d'une base" :
2 antonymes (sens contraire) :
- acide fort
- base faible
Les mots ou les expressions apparentés à FORCE D'UNE BASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression FORCE D'UNE BASE est dans la page 3 des mots en F du lexique du dictionnaire.
Mots en F à proximité
forage foramen foraminifère forçage force d'un acide force d'une baseforce de van der Waals force électrostatique force génératrice de la marée force motrice forcipule
En rapport avec "force d'une base"

La force d'un acide est la possibilité, pour un acide, de perdre un proton facilement.

La force de van der Waals est une force à courte portée existant à la fois dans les phases gazeuse et liquide en raison de la fluctuation des nuages...
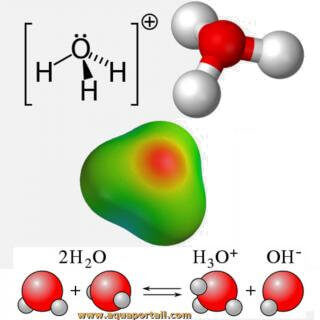
H3O+, ou écrit scientifiquement H3O+, est l'ion hydronium, une forme solvatée que prend spontanément l'ion hydrogène, avec un proton H+ dans l'eau H2O.

Une base est une substance, un composé chimique, qui peut accepter des ions hydrogène (protons) ou plus généralement, donner une paire d'électrons de valence.
