Basicité
Définition
La basicité d'une molécule est une mesure de sa capacité à accepter un proton (H+) pour former un produit stable. En chimie, la basicité est la qualité d'être une base et pas un acide. Elle quantifie le nombre d'atomes d'hydrogène remplaçables par une base dans un acide particulier. Une base est une substance qui peut accepter les ions hydrogène dans l'eau et peut neutraliser un acide.
Augmentation de la basicité :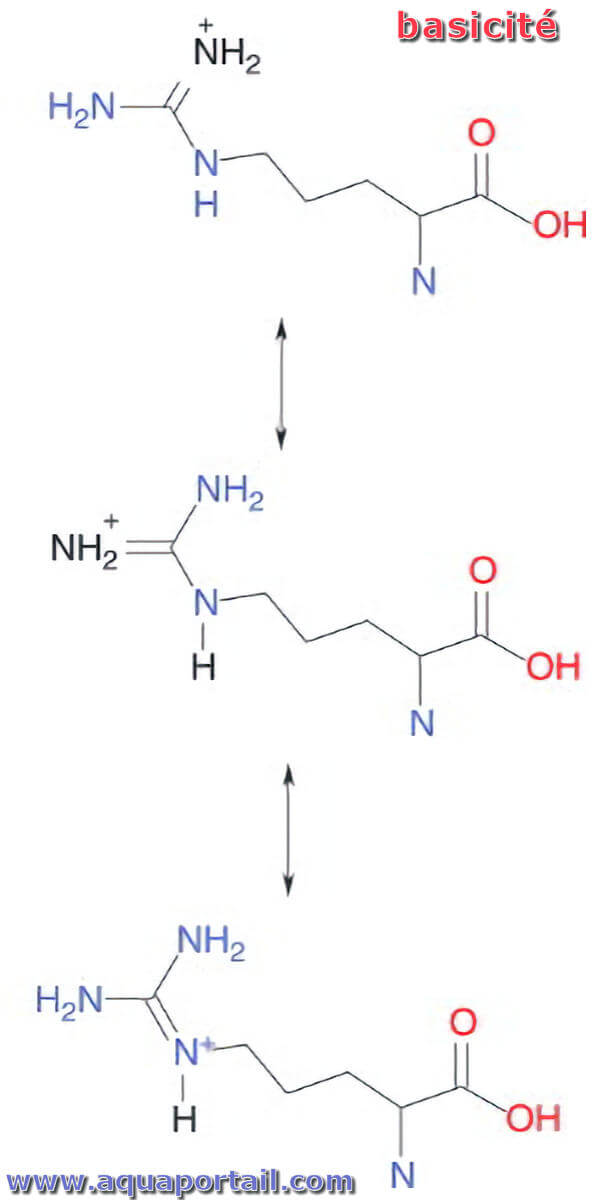
Formes de résonance de l'arginine, un acide aminé. La charge positive est répartie entre les trois atomes N, ce qui stabilise la chaîne latérale protonée et augmente la basicité de la molécule.
Explications
Si le produit est un cation, alors tout ce qui stabilise la charge positive augmentera la force de la base, et donc la basicité. Les substituants alkyle libèrent des électrons et stabilisent le cation en dispersant la charge positive dans la molécule. Ainsi, les méthylamines sont plus basiques que l'ammoniac et la triméthylamine (TMA) est la plus basique des méthylamines. Les acides aminés basiques ont une chaîne latérale basique - (CH2)4NH2 pour la lysine, (CH2)3NHC=NH(NH2) pour l'arginine et CH2C3H3N2 pour l'histidine. Parmi ceux-ci, l'arginine (ARG) est la plus basique car la charge positive est également stabilisée par résonance.
Mesure
La basicité est une propriété qui renseigne sur l'aptitude d'une molécule ou d'un ion à jouer le rôle d'accepteur de proton dans une réaction acido-basique selon la formule : B + H2O ↔ BH+ + HO-, où B est une base, et BH+ son acide conjugué.
La basicité est déterminée à partir de la constante d'équilibre du couple BH+/B qui correspond à: Kb = (BH+)(HO-) / (B). Ou bien, on utilise une fonction dérivée, le pkb (pkb = -log Kb), et plus le pkb d'un couple est petit, plus la base est forte.
Acidité des bases et basicité des acides
L'acidité d'une base est le nombre d'ions hydroxyle (OH) que la molécule basique peut donner dans la solution aqueuse. La basicité d'un acide équivaut au nombre d'ions hydrogènes (H+) présents dans un acide, lorsqu'il s'ionise dans le milieu aqueux.
Par exemple, l'acide sulfurique (H2SO4) peut libérer 2 ions hydronium : il a une basicité de 2; l'acide phosphorique (H3PO4) a 3 ions H+ disponibles : il a une basicité de 3. Ceci montre que la basicité des acides est égale au nombre d'atome d'hydrogène présent dans l'acide.
La basicité d'un acide peut être calculée, soit en connaissant simplement l'acide, soit en écrivant son équation de dissociation.
L'ion hydronium lui-même, H3O+, produit 1 seul ion hydrogène dans l'eau; il a donc une basicité de 1.
Dans les acides organiques tels que l'acide acétique (CH3COOH), l'acide benzoïque (C6H5COOH), etc., tous les atomes d'hydrogène ne subissent pas de dissociation. Ainsi : CH3COOH + H2O ↔ CH3COO- + H3O+; la basicité de l'acide acétique vaut 1.
Basicité et nucléophilie
Deux notions sont fondamentales en chimie organique : la nucléophilie, qui est un paramètre cinétique qui agit sur la vitesse de la réaction, et le deuxième est la basicité, qui est gérée par un équilibre thermodynamique. Ces deux paramètres influencent le déroulement des réactions en chimie organique.
La nucléophilie est déterminée dans des conditions cinétiquement contrôlées tandis que la basicité est déterminée dans des conditions contrôlées thermodynamiquement (à partir des études d'équilibres).
On rend compte de la basicité de deux réactifs à l'aide des valeurs de pka des couples acido-basiques. Dans ces conditions, la basicité est envisagée comme une propriété thermodynamique, alors que la nucléophilie, relative de deux réactifs, est déterminée à partir de leurs constantes de vitesse vis-à-vis d'un même substrat dans les mêmes conditions.
Beaucoup de réactifs, utilisés dans les réactions organiques, possèdent les deux propriétés à la fois et peuvent, par conséquent, se comporter comme nucléophiles et comme bases en même temps. Mais, souvent, l'une de ces deux propriétés se trouve dominante par rapport à l'autre, selon la nature des réactifs mis en jeu et de certains paramètres (température, solvant, structure...).
Finalement, la nucléophilie et la basicité reflètent la même propriété, à savoir la capacité de partager la ou les paires d'électrons isolés avec un accepteur d'électrons, et ainsi, à combiner avec un substrat électrophile.
Effet inductif
L'effet inductif influe directement sur la basicité d'une espèce; plus elle possède des substituants électrodonneurs,, plus sa basicité est élevée, contrairement aux substituants électroattracteurs qui diminuent son caractère basique.
À titre d'exemple, une amine est d'autant plus basique si, d'une part, elle porte des groupements électrodonneurs et, d'autre part, son doublet est disponible afin de capter un proton pour donner l'ion ammonium.
La basicité augmente avec la classe de l'amine à cause d'effet inductif donneur des groupes alkyles. On observe une inversion de cette tendance dans le cas de l'amine tertiaire à cause de la solvatation qui sera traitée ultérieurement.
Effet mésomère
L'effet mésomère est un effet électronique important dans la réaction des molécules comportant des électrons π et doublets non liants n conjugués. Il correspond à la délocalisation de ces électrons qui a pour conséquence la stabilisation du système.
Effet d'un solvant sur la basicité
Le solvant est un liquide qui possède la propriété de dissoudre les substances afin de rendre la milieu homogène et favoriser le contact entre les espèces mises en jeux. En phase gazeuse, l'ordre de la basicité est déterminé par les effets électroniques, généralement les amines aliphatiques sont plus basiques que l'ammoniac en raison du caractère donneur du substituant R : R3N > R2NH > RNH2 > NH3.
Cependant, dans la phase aqueuse, on observe une inversion dans l'ordre prévisible. Par exemple, la triéthylamine est moins basique que la diéthylamine.
Cette variation dans l'ordre de la basicité des amines en milieu aqueux résulte d'un effet de solvatation. L'ammoniac est une base beaucoup plus forte en milieu aqueux qu'en phase gazeuse. Cette effet est dû à la solvatation de l'ion ammonium, qui est chargé positivement et stabilisé par les molécules d'eau. Ce phénomène de solvatation diminue lorsque le nombre de groupes alkyle fixés sur l'azote augmente. Ceci se traduit par une diminution de nombre de liaison hydrogène pouvant solvater l'ion ammonium. L'effet d'hydratation et l'effet inductif agissent donc de manière antagoniste sur la basicité des alkylamines.
Le phénomène de solvatation permet d'expliquer l'inversion constatée de la basicité par rapport à l'ordre prévu.
Basicité équivalente
La basicité équivalente est le nombre de parties, en terme de masse, du carbonate de calcium sous la forme de CaCO3 correspondant à une capacité de neutralisation de l'acide équivalente à 100 parties du produit considéré. En d'autres termes, elle montre la capacité de neutralisation (exprimée en kg de CaCO3) de 100 kg de produit.
Synonymes, antonymes
Voir tous les synonymes pour "basicité".0 synonyme (sens proche) pour "basicité".
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à BASICITÉ sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot BASICITE est dans la page 1 des mots en B du lexique du dictionnaire.
Mots en B à proximité
base de données SIG base nucléique baséoste basibionte basibranchial basicitébasicline baside basidiocarpe basidiole basidiolichen
En rapport avec "basicité"

Une acidité, une alcalinité, est une force d'un acide ou d'une base : les propriétés acides (ou basiques = alcalines) d'une solution sont dues aux ions H⁺...
L'acidité de l'eau est une quantité, exprimée en milliéquivalents par litre d'eau, de base forte qui doit être utilisée pour neutraliser les acides forts...

La conspécificité d'une espèce indique que malgré des divergences dans les populations de l'espèce (lieux géographiques variés, biotopes divers, conditions...
La cytotoxicité est la qualité de certaines cellules à être toxiques envers d'autres qui sont altérées.
