Protonation
Définition
La protonation est l'addition d'un proton, une charge positive, à une espèce chimique : atome, molécule ou ion. Par exemple, la protonation du groupe 2'-amino peut être utilisée pour sonder les effets de l'introduction d'une charge positive dans une molécule d'ARN structurée.
La protonation existe dans de nombreuses réactions catalytiques. La protonation et la déprotonation interviennent dans la plupart des réactions acide-base. Lorsqu'une espèce est protonée, déprotonée ou reprotonée, la masse et la charge électrique changent. De plus, une altération des propriétés chimiques est provoquée.
Une protonation :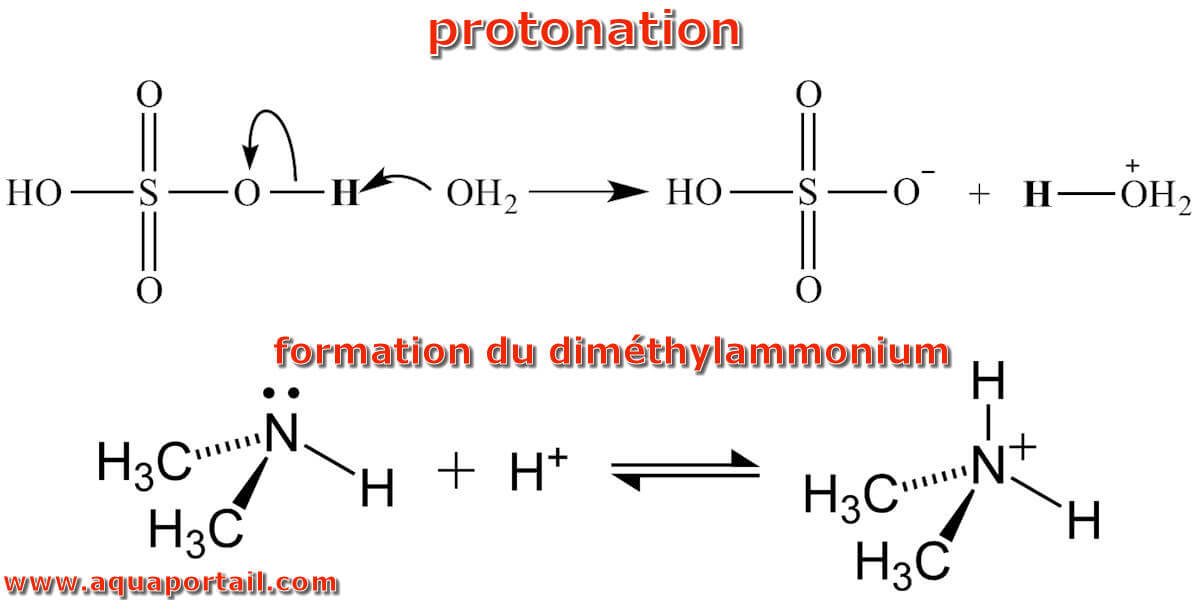
Schéma de la réaction de protonation et schéma de la formation du diméthylammonium par protonation. La protonation peut modifier les propriétés optiques, les qualités hydrophobes ou la réactivité d'une substance. La protonation est une réaction chimique réversible (déprotonation), voire faisable à souhait (reprotonation).
Explications
La protonation est différente de l'hydrogénation car pendant la protonation, un changement de charge de l'espèce protonée intervient, tandis que la charge n'est pas affectée pendant l'hydrogénation.
La protonation des sites titrables dans les protéines entre clairement dans la catégorie de la liaison spécifique, c'est-à-dire que chaque liaison successive d'un proton peut être exprimée comme une réaction chimique dans laquelle l'activité chimique de l'espèce protéique et le potentiel chimique du proton sont liés par la loi d'action de masse.
La protonation (déprotonation) des catalyseurs moléculaires est un processus compliqué dans lequel un acide (une base) s'associe au catalyseur, délivre (élimine) le proton, puis se dissocie. La livraison précise de protons et le taux de protonation/déprotonation sont régulés de manière non triviale par la combinaison de trois facteurs : effets stériques, liaison hydrogène et interactions électrostatiques entre le catalyseur et le donneur/accepteur de protons exogène. En particulier, dans les environnements non aqueux, les calculs indiquent que l'encombrement stérique et les processus de solvatation/désolvatation sont les principales contributions nuisibles aux vitesses catalytiques.
En solution aqueuse
Dans la théorie acide-base de Brønsted-Lowry, la protonation a lieu lorsque des bases plus fortes que l'eau sont introduites dans une solution (aqueuse). La base est protonée et agit alors comme un accepteur de protons. L'eau agit comme un donneur de protons : elle est déprotonée en un ion hydroxyde.
La déprotonation peut également intervenir lorsqu'un acide est introduit dans un environnement aqueux. L'acide agit alors comme un donneur de protons. L'eau absorbe le proton (accepteur de protons), pour former un ion hydroxonium.
Une protonation encore plus élémentaire est la réaction acido-basique classique entre un acide fort (acide chlorhydrique) et une base forte (hydroxyde de sodium). Les deux composés sont respectivement ionisés et dissociés par descente. Les protons et les ions hydroxyde sont présents. L'ion hydroxyde est reproduit de manière irréversible dans l'eau.
Nucléobases, nucléosides et oligonucléotides
La protonation des molécules contenant des chromophores modifie fortement leur spectre électronique lorsque le site de protonation appartient au chromophore lui-même. Au contraire, seules des modifications mineures sont observées lorsque le site de protonation n'est pas localisé sur le chromophore, par exemple dans le cas du tryptophane. Dans l'adénine protonée, le tautomère le plus stable 1H-9H-adénine correspond à la protonation de l'atome d'azote en position 1.
L'apparition du spectre électronique enregistré par l'observation de la photo-fragmentation des ions piégés à relativement haute température (> 300 °K) présente une montée lente et une large sous-structure caractéristique d'une durée de vie très courte. En effet, les calculs suggèrent une relaxation ultrarapide sans barrière des états nπ* et ππ via une intersection conique avec l'état fondamental S0.
Amines
La protonation des amines provoque un blindage des carbones adjacents à l'azote, sauf pour les systèmes ramifiés, où un certain déblindage est souvent observé. L'effet de la protonation peut être d'environ -2 ppm sur un carbone, -3 ppm sur un carbone et jusqu'à -1 ppm sur un α-carbone. Par exemple, les décalages 13C de l'éthylamine sont de 36,9 ppm (CH2) et de 19,0 ppm (CH3) et ceux-ci sont décalés de -0,2 et -5,0 ppm, respectivement, lors de la protonation. Encore une fois, les effets de déformation du cycle dans les amines cycliques sont reflétés par de grands effets de décalage 13C.
La protonation des cétones aliphatiques avec des superacides (par exemple, SbF5/FSO3H) à -60 °C conduit à la formation de α-hydroxy carbocations.
La protonation d'un mélange d'énamines isomères et par l'acide trifluoroacétique donne le sel d'iminium, qui est déprotoné de manière régiospécifique avec de la t-butylamine, donnant l'isomère énamine avec une double liaison terminale.
Synonymes, antonymes
Voir tous les synonymes pour "protonation".1 synonyme (sens proche) de "protonation" :
- reprotonation
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à PROTONATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PROTONATION est dans la page 9 des mots en P du lexique du dictionnaire.
Mots en P à proximité
protohormone protolarve protolithe protomère proton protonationprotonème protonéphridie protonophore protonyme protophloème
En rapport avec "protonation"

Une acétylation est un transfert d'un groupe acétyle CH₃-CHO sur une molécule réceptrice.

L'acétylation des histones signifie la suppression de la charge positive de la molécule d'histone, ce qui affaiblit l'interaction entre les groupes phosphate...
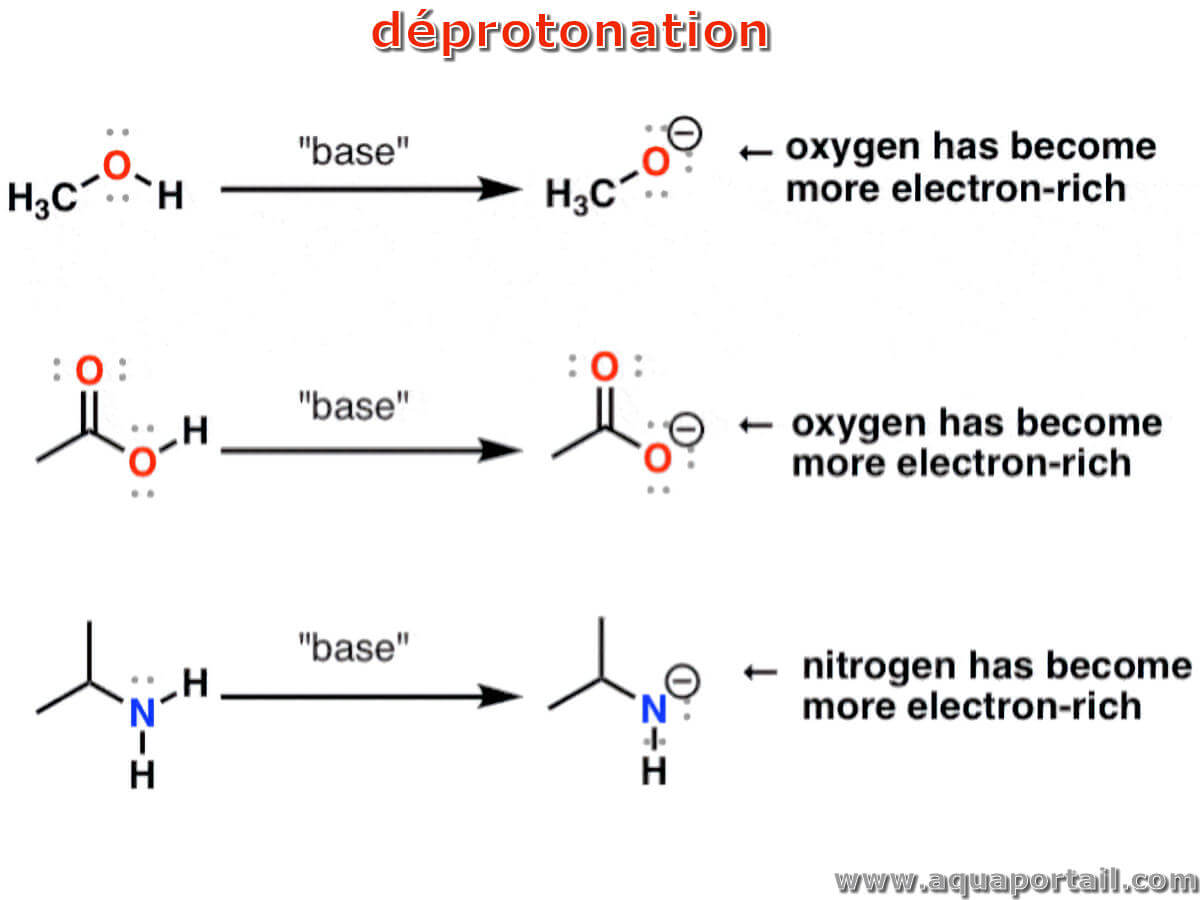
La déprotonation est la lysation d'un cation hydrogène (hydron H⁺) à partir d'une espèce chimique (molécule ou ion).
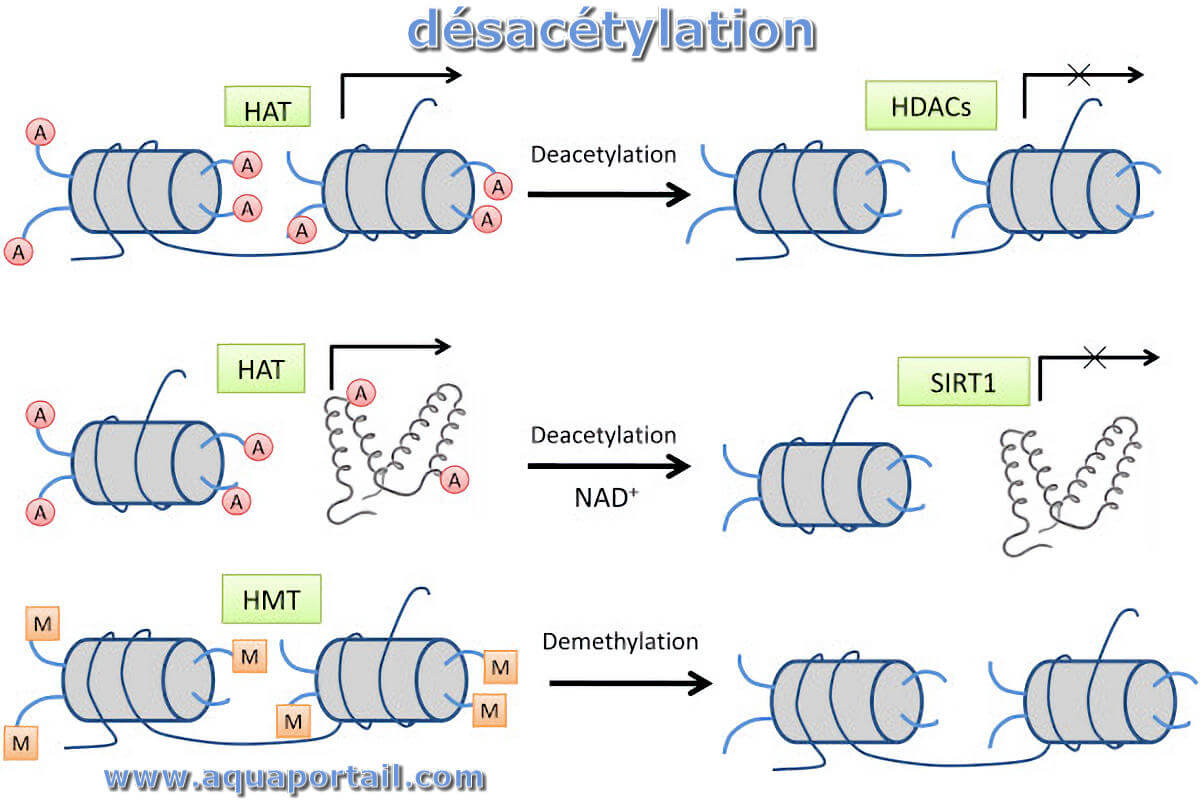
La désacétylation est le processus d'élimination des groupes acétyle de la chitine et de substitution des groupes amino réactifs (liaison simple NH₂).
