Hydrogénation
Définition
L'hydrogénation est une réaction chimique de l'hydrogène avec une autre substance, en particulier avec un composé organique insaturé, et généralement sous l'influence de la température, de la pression et de catalyseurs. Elle essentielle pour la synthèse de nouveaux produits chimiques.
L'hydrogénation est un processus qui transfère les atomes d'hydrogène aux composés insaturés à partir d'hydrogène gazeux ou d'autres sources d'hydrogène (par exemple, l'hydrazine, l'acide formique, l'alcool dihydronaphtalène isopropylique).
L'hydrogénation d'un alcène :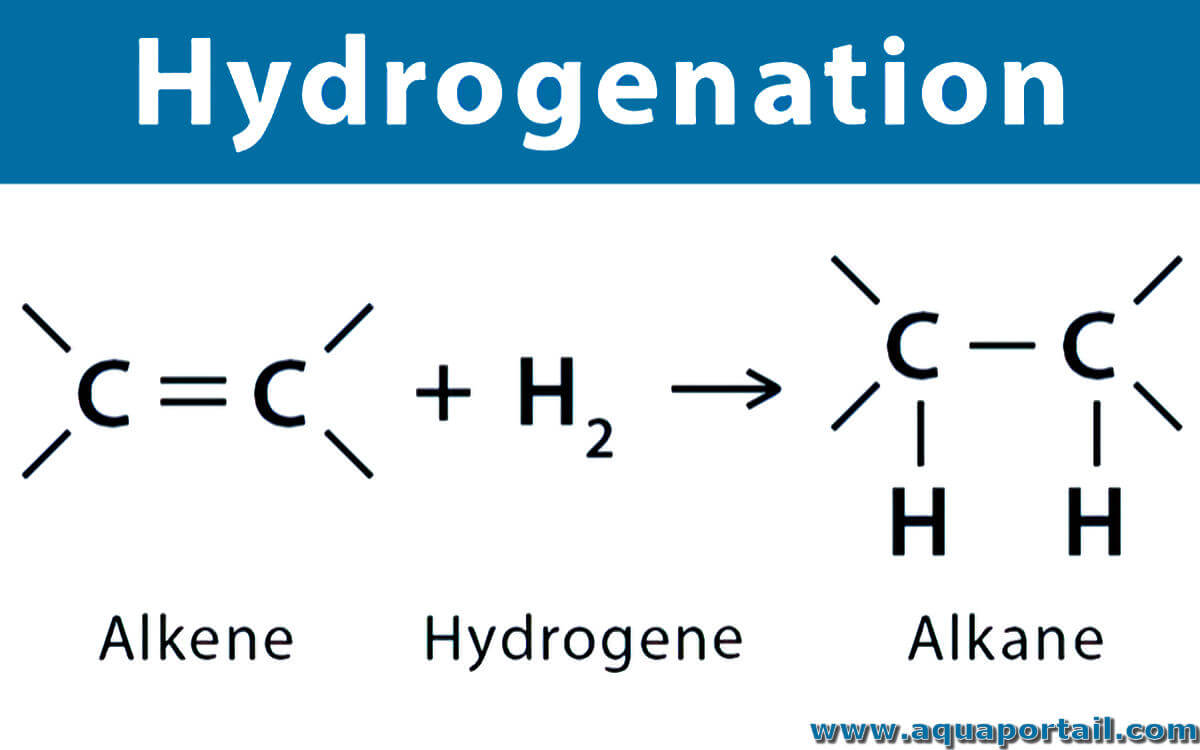
L'hydrogénation d'un alcène produit un alcane. L'hydrogénation est une réaction chimique entre l'hydrogène moléculaire et un autre élément en présence d'un catalyseur synthétisé à température et pression normales. Ce processus constitue typiquement l'addition de paires d'atomes d'hydrogène à une molécule. L'hydrogénation non-catalytique ne peut avoir lieu qu'à très haute température.
Explications
L'hydrogénation intervient entre une molécule d'hydrogène et un composé insaturé, comme l'alcène et l'alcyne, en présence d'un catalyseur métallique. En ajoutant des atomes d'hydrogène à une double ou triple liaison, l'hydrogénation modifie la structure de la molécule. Bien qu'une certaine quantité d'énergie soit nécessaire pour démarrer le processus, la réaction globale est exothermique. L'énergie des réactifs est plus par rapport à l'énergie du produit. Les liens formés sont plus stables que les liens rompus.
La réaction d'hydrogénation est une réaction d'addition dans laquelle de l'hydrogène est ajouté à un alcène. Voici la formule générale de la réaction d'hydrogénation : -CH=CH- + H2 → -CH2-CH2-. La chaleur d'hydrogénation d'un composé insaturé est l'enthalpie de réaction entre une molécule d'hydrogène et le composé. C'est une mesure de la stabilité des doubles et triples liaisons carbone-carbone. De petites valeurs absolues dénotent une liaison stable.
La déshydrogénation est l'opération contraire à l'hydrogénation par laquelle on élimine l'hydrogène d'une substance.
Voici quelques conditions d'hydrogénation :
- l'un des réactifs doit être un composé insaturé comme un alcène ou un alcyne, et l'autre est une molécule d'hydrogène;
- la réaction est effectuée en présence d'un catalyseur métallique comme le nickel (Ni), le palladium (Pd), le platine (Pt) ou le rhodium (Rh);
- la température de la réaction est maintenue à 150 °C.
Voici quelques exemples d'hydrogénation :
- Alcène : l'éthène (C2H4) réagit avec l'hydrogène à 150 °C pour produire de l'éthane (C2H4) = C2H4 + H2 → C2H6;
- Cycloalcène : le cyclohexène (C6H10) se transforme en cyclohexane (C6H12) en réagissant avec l'hydrogène en présence d'un catalyseur au palladium (Pd) = C6H10 + H2 → C6H12.
Étude des réactions
L'hydrogénation est un procédé qui combine la chaleur et le traitement à l'hydrogène à haute pression des déchets, pour obtenir des produits gazeux et liquides. Ces produits obtenus peuvent être utilisés comme carburant et comme matière première chimique pour d'autres procédés. L'hydrogénation peut être considérée comme un compromis entre la pyrolyse (effet de la chaleur) et la gazéification (effet de l'hydrogène à haute pression).
L'hydrogénation comprend la pyrolyse et une étape supplémentaire, qui est la combinaison de la chaleur, de la pression et du traitement à l'hydrogène. Par rapport à la pyrolyse, l'hydrogénation produit des gaz et des huiles plus purs.
Diverses réactions d'hydrogénation ont été largement étudiées en utilisant un liquide ionique neutre comme solvant. L'importance d'utiliser un liquide ionique est que des catalyseurs de métaux de transition homogènes peuvent être utilisés et que les produits de la réaction peuvent être facilement séparés du liquide ionique et du catalyseur.
Diverses réactions d'hydrogénation, y compris l'hydrogénation du cyclohexane et l'hydrogénation complète des cycles benzéniques, ont été largement étudiées.
L'hydrogénation est l'une des stratégies pour convertir chimiquement le CO2 en produits chimiques précieux et en sources d'énergie renouvelables telles que les oléfines inférieures, les hydrocarbures, les acides formiques, le méthanol et les alcools à l'aide d'hydrogène et de catalyseurs.
Hydrogénation catalytique
L'hydrogénation catalytique des graisses et des huiles est largement utilisée dans diverses industries pour la production de biocarburants, de détergents, d'antimousses et de lubrifiants. Pour l'hydrogénation, qui nécessite généralement une température et une pression élevées, le CO2 supercritique est un solvant favorable qui peut faciliter l'hydrogénation dans des conditions plus douces et réduire les sous-produits indésirables en raison de ses propriétés uniques.
Étant donné le problème de santé et de sécurité des produits hydrogénés dans l'industrie alimentaire, l'hydrogénation des graisses et des huiles à l'aide de CO2 supercritique a attiré une attention considérable. Dans ce chapitre, nous avons présenté les approches de pointe dans l'hydrogénation des graisses et des huiles en CO2 supercritique.
Bioraffinerie
L'hydrogénation est la réaction la plus fondamentale en chimie. Il s'agit d'une réaction dans laquelle des atomes d'hydrogène sont ajoutés à un composé insaturé pour réduire les doubles et triples liaisons en liaisons carbone-carbone simples (saturées). Encore une fois, en utilisant un exemple simple : CH2=CH2 + H2 → CH3CH3.
L'hydrogène moléculaire (H2, gazeux) et d'autres composés (hydrogénation par transfert) peuvent être utilisés comme source d'hydrogène dans la réaction. Cependant, l'ajout d'hydrogène ne se fait pas sans catalyseur; par conséquent, la réaction est catalysée par des catalyseurs homogènes et hétérogènes. Généralement, les systèmes hétérogènes dans lesquels des catalyseurs métalliques solides d'hydrogénation et de l'hydrogène moléculaire sont utilisés pour la conversion de la biomasse.
Réactions d'hydrogénation dans l'eau
Les réactions d'hydrogénation se sont révélées être un processus clé dans la synthèse de divers composés organiques. Généralement, l'hydrogénation implique l'ajout d'hydrogène à la structure des composés organiques pour une réduction ultérieure. L'hydrogène entrant pourrait être pratique dans la saturation des liaisons insaturées (doubles ou triples), la synthèse d'alcools à partir de liaisons C=O, la réduction sélective du groupe fonctionnel arène-alcool en aromatiques, la synthèse de composés carbonylés, entre autres.
La base de la recherche continue en hydrogénation tourne autour; activité catalytique et récupération, sélectivité des produits, sélection des solvants et source d'hydrogène durable. Fait intéressant, l'eau en tant que solvant bénin a une influence substantielle sur ce qui précède puisqu'elle peut remplir la double fonction de donneur d'hydrogène et de solvant en fonction de son utilisation.
D'une part, il peut fournir le proton nécessaire via une séparation électrocatalytique, un piégeur de trous photocatalytique, une réaction de décalage eau-gaz et une séparation directe de la liaison H-OH sur un catalyseur approprié.
D'autre part, il améliore la récupération des catalyseurs et la séparation des produits, améliore la conversion due à la polarité, favorise la sélectivité en cas d'hydrogénation partielle et augmente la vitesse de réaction en abaissant la barrière d'énergie pour la formation de M-H.
Avec des progrès remarquables dans la pile à combustible à hydrogène, nous prévoyons l'application rentable de l'hydrogène gazeux directement dans les systèmes énergétiques que la synthèse organique, ouvrant ainsi la voie à l'application en plein essor de l'eau comme source d'hydrogène dans les réactions d'hydrogénation.
Synonymes, antonymes
Voir tous les synonymes pour "hydrogénation".2 synonymes (sens proche) de "hydrogénation" :
- biohydrogénation
- réhydrogénation
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à HYDROGÉNATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot HYDROGENATION est dans la page 3 des mots en H du lexique du dictionnaire.
Mots en H à proximité
hydrodynamisme hydroformylation hydrogamie hydrogel hydrogénase hydrogénationhydrogène hydrogène sulfuré hydrogénocarbonate hydrogénolyse hydrogénophosphate
En rapport avec "hydrogénation"
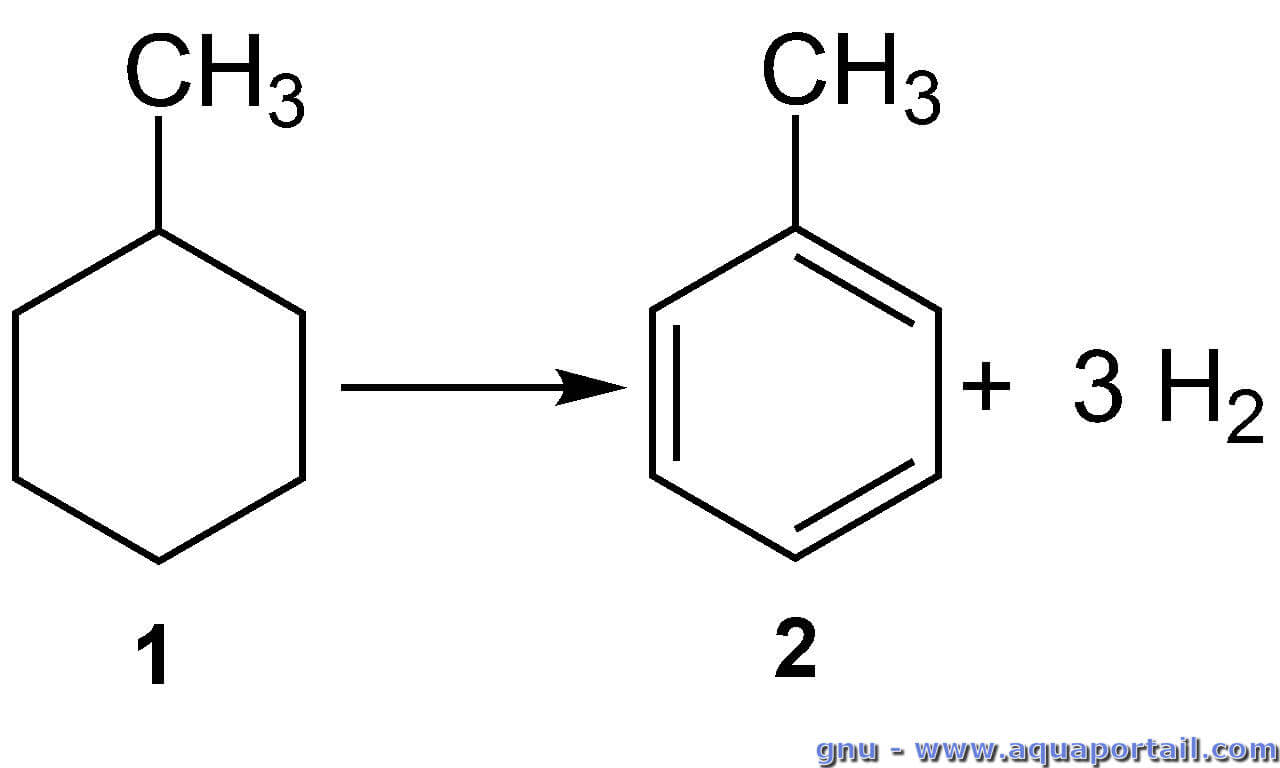
Une déshydrogénation consiste en une perte d'atomes d'hydrogène par un substrat, c'est donc le résultat d'une déshydrogénase, la réaction inverse...

L'halogénation est le remplacement d'un ou plusieurs atomes d'hydrogène dans un composé organique par un halogène (fluor, chlore, brome ou iode).
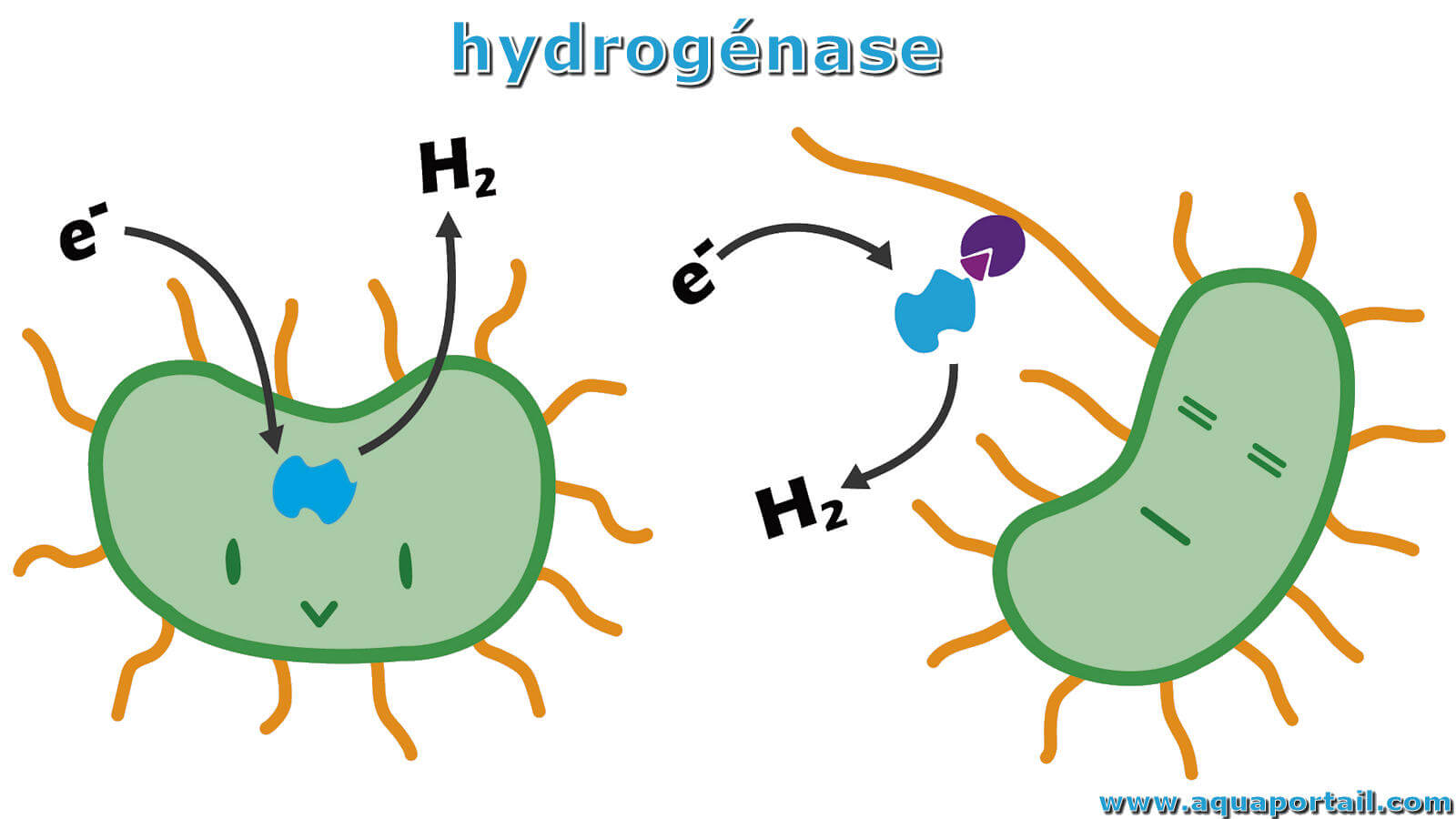
Une hydrogénase est une enzyme qui catalyse la réduction de deux protons en dihydrogène moléculaire, l'oxydation réversible de l'hydrogène moléculaire.

L'atome d'hydrogène, de symbole chimique H, est constitué par un noyau avec une unité de charge positive (proton) et d'un électron.
