Halogénation
Définition
L'halogénation est le remplacement d'un ou plusieurs atomes d'hydrogène dans un composé organique par un halogène (fluor, chlore, brome ou iode). Contrairement aux transformations complexes de la combustion, l'halogénation d'un alcane semble être une simple réaction de substitution dans laquelle une liaison C-H est rompue et une nouvelle liaison C-X est formée.
Deux réactions d'halogénation :
L'halogénation est une réaction chimique qui implique la réaction d'un composé avec un halogène et entraîne l'ajout de l'halogène au composé.
Explications
La chloration du méthane est un exemple simple de la réaction d'halogénation : CH4 + Cl2 + énergie → CH3Cl + HCl.
Étant donné que seules deux liaisons covalentes sont rompues (C-H et Cl-Cl) et que deux liaisons covalentes sont formées (C-Cl et H-Cl), cette réaction semble être un cas idéal pour l'investigation mécaniste et la spéculation. Cependant, une complication est que tous les atomes d'hydrogène d'un alcane peuvent subir une substitution, entraînant un mélange de produits, comme le montre l'équation déséquilibrée suivante. Les quantités relatives des différents produits dépendent de la proportion des deux réactifs utilisés.
Dans le cas du méthane, un grand excès d'hydrocarbure favorise la formation de chlorure de méthyle comme produit principal; tandis qu'un excès de chlore favorise la formation de chloroforme et de tétrachlorure de carbone : CH4 + Cl2 + énergie → CH3Cl + CH2Cl2 + CHCl3 + CCl4 + HCl.
Processus
L'halogénation est une réaction chimique dans laquelle un halogène est ajouté à un hydrocarbure en remplaçant l'un de ses hydrogènes. Le produit ainsi formé est appelé composé halogéné. Les halogénés existent à la fois dans les hydrocarbures saturés et insaturés et les hydrocarbures aromatiques.
Les halogènes les plus courants dans cette réaction sont le fluor, le chlore, le brome et l'iode. L'ordre de réactivité de ces halogènes est le fluor (F) > le chlore (Cl) > le brome (Br) > l'iode (I). F est le plus agressif et produit le composé halogéné le plus stable. Ainsi, l'électronégativité de l'atome d'halogène est une force motrice pour ces réactions.
Les réactions d'halogénation sont essentielles dans la production de plusieurs produits, tels que les produits pharmaceutiques, les réfrigérants, les polymères, les additifs pour carburants, les retardateurs de flamme, etc.
Chimie hétérocyclique
L'halogénation d'hétérocycles à haute température donne des produits dans lesquels le schéma de substitution suggère que des radicaux libres (plutôt qu'un halogène ionique) sont impliqués dans leur production.
Bien que les hétéroaromatiques neutres subissent souvent une alkylation par des espèces radicalaires avec un rendement médiocre, si des hétérocycles protonés sont utilisés, de bons rendements sont fréquemment obtenus. Dans des conditions appropriées, les pyridines, les quinoléines et les isoquinoléines peuvent être alkylées en positions 2, 2 et 1, respectivement. L'acylation des pyridines protonées, des quinoléines, des pyrazines et des quinoxalines via des radicaux libres se déroule avec un rendement acceptable. Ainsi, le traitement de la pyridine avec des radicaux libres générés à partir du formamide donne l'isonicotinamide et le 2-isomère.
À l'opposé, l'arylation homolytique des hétérocycles donne souvent de faibles rendements et n'est pas sélective. Les radicaux phényle attaquent la pyridine pour donner un mélange de 2-, 3- et 4-phénylpyridines.
Avec les alcènes
Les halogènes Br2 et Cl2 s'ajoutent à la double liaison d'un alcène produisant des dihalogénures vicinaux - un composé portant les halogènes sur des carbones adjacents (vicinaux). Ceux-ci sont également appelés 1,2-dihalogénures.
La réaction avec le brome est un test standard pour la présence d'une liaison π. Le brome est un liquide rouge foncé qui, en réagissant avec une double liaison, devient incolore.
Des halogénations mixtes peuvent également être réalisées. Par exemple, un mélange de Br2 et de Cl2 a été utilisé pour effectuer la bromochloration. La réaction est possible car la liaison halogène est relativement faible et polarisable. Lorsque la liaison π riche en électrons s'approche de l'halogène, l'un des atomes a une charge positive partielle et il devient maintenant l'électrophile que l'alcène attaque.
On peut s'attendre à ce que ce soit un mécanisme similaire à l'addition d'halogénure d'hydrogène où la protonation du double produit un carbocation selon la règle de Markovnikov. Ce mécanisme n'explique cependant pas l'anti-addition exclusive de l'halogène. Par exemple, l'addition de brome au cyclohexène, produit du trans -1,2-dibromocyclohexane, et du cis -1,2-dibromocyclopentane n'est pas observé.
Le mécanisme qui explique cette stéréochimie implique un intermédiaire d'ion bromonium cyclique. Les électrons p de la liaison π attaquent le Br2 pour faire une nouvelle liaison σ avec lui et les autres feuilles de brome avec la paire d'électrons. Ceci, cependant, ne forme pas de carbocation car le nuage d'électrons du brome lié est très proche de l'autre carbone sp2 et forme une nouvelle liaison avec lui. En conséquence, au lieu du carbocation commun dans les réactions d'addition, un intermédiaire d'ion bromonium cyclique est formé.
Une chose importante à mentionner ici est que parce qu'il n'y a pas de carbocation formé, l'halogénation et les autres réactions avec l'ion halonium n'impliquent pas de réarrangements. Cet intermédiaire cyclique est un cycle à trois chaînons qui sont instables en raison de la forte contrainte et sont sensibles aux attaques nucléophiles comme nous l'avons également vu dans la réaction d'oxymercuration. De plus, le brome est chargé positivement ce qui en fait un excellent groupe partant dans une réaction de substitution nucléophile.
Le chlore réagit de la même manière avec les alcènes formant l'ion chloronium, qui est en général appelé ion halonium.
Synonymes, antonymes
Voir tous les synonymes pour "halogénation".0 synonyme (sens proche) pour "halogénation".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à HALOGÉNATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot HALOGENATION est dans la page 1 des mots en H du lexique du dictionnaire.
Mots en H à proximité
halobionte halobios halochromie haloclastie halocline halogénationhalogène halogénure halogénure d'aryle halomorphe halonitrophile
En rapport avec "halogénation"
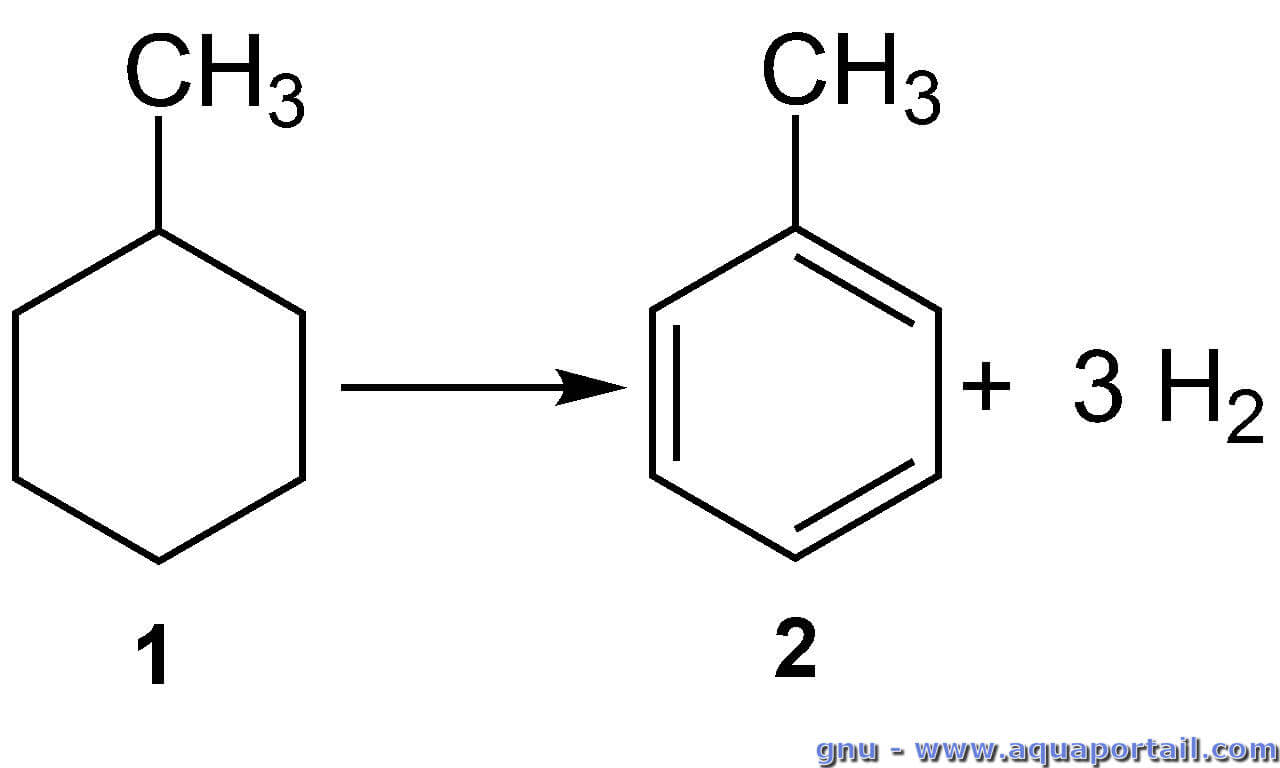
Une déshydrogénation consiste en une perte d'atomes d'hydrogène par un substrat, c'est donc le résultat d'une déshydrogénase, la réaction inverse...
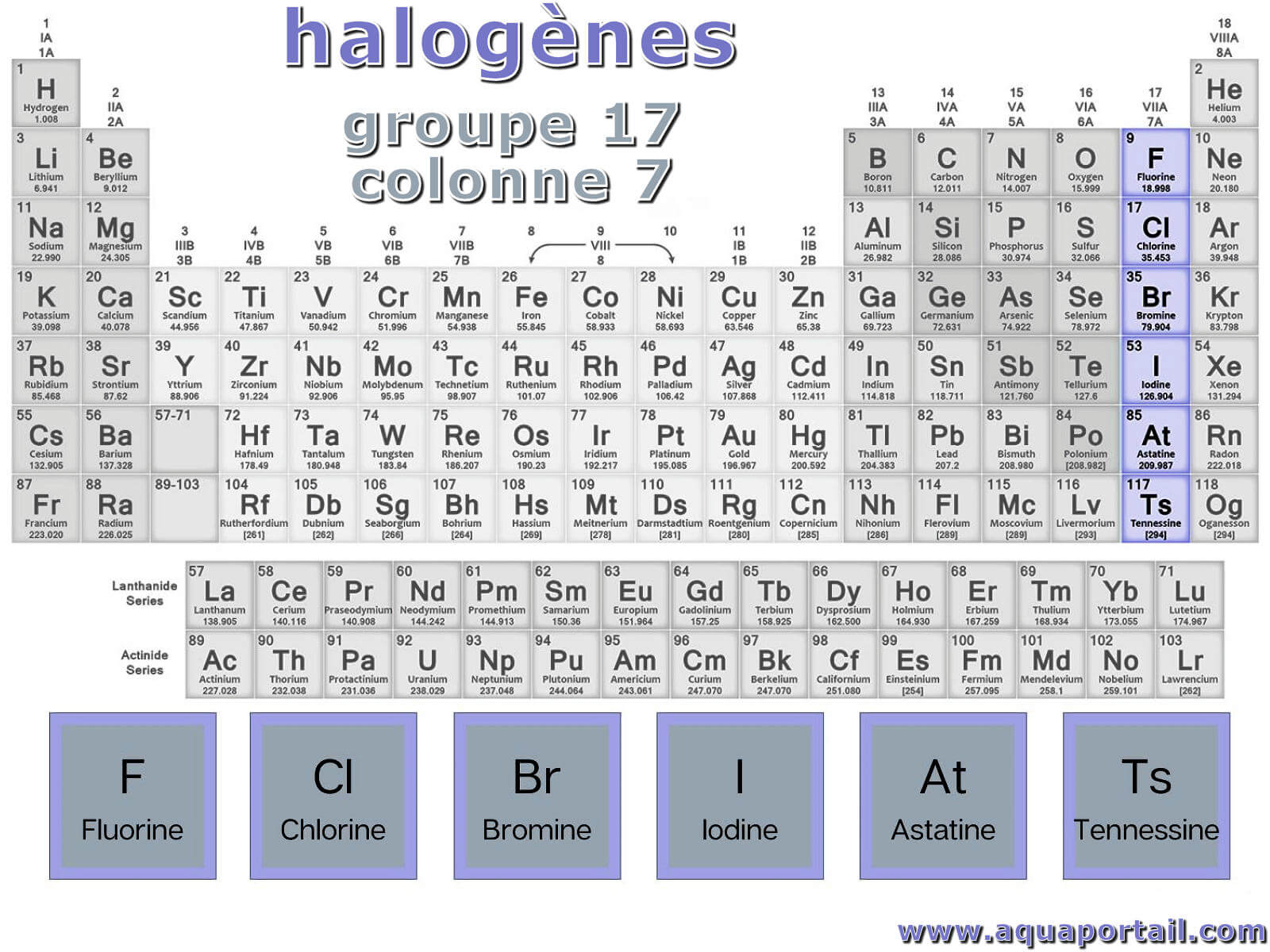
Un halogène est un des six éléments chimiques suivants : fluor F, chlore Cl, brome Br, iode I, astate At et tennesse Ts.
Un halogénure est un composé binaire dans lequel une partie est un atome d'halogène et l'autre est un élément, un cation ou un groupe fonctionnel...
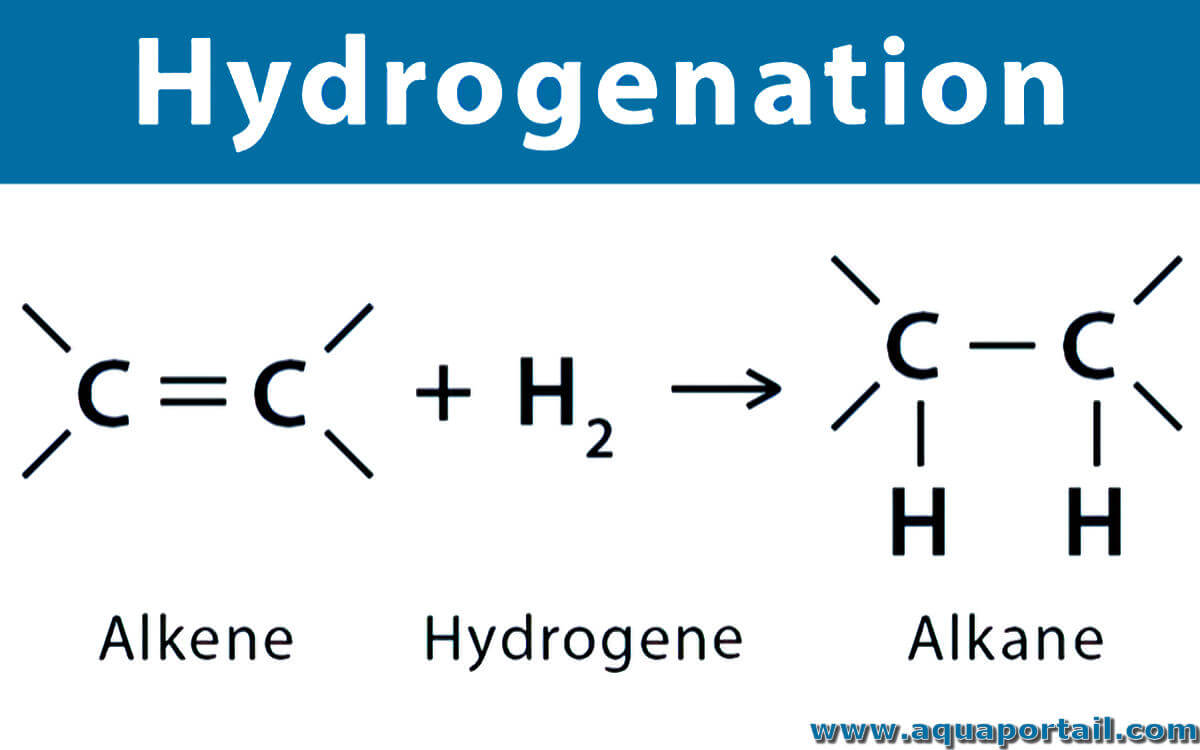
L'hydrogénation est une réaction chimique de l'hydrogène avec une autre substance, en particulier avec un composé organique insaturé, et généralement sous...
