Halogène
Définition
Un halogène est un des six éléments chimiques suivants : fluor F, chlore Cl, brome Br, iode I, astate At et tennesse Ts. Les halogènes sont les éléments de la 7ème colonne de la classification périodique des éléments. Ils forment le groupe 17 de la table de Mendeleïev. Parmi les éléments stables, le chlore, le fluor, le brome et l'iode, sont souvent utilisés comme bactéricides en raison de leur forte toxicité.
Une table périodique avec les halogènes :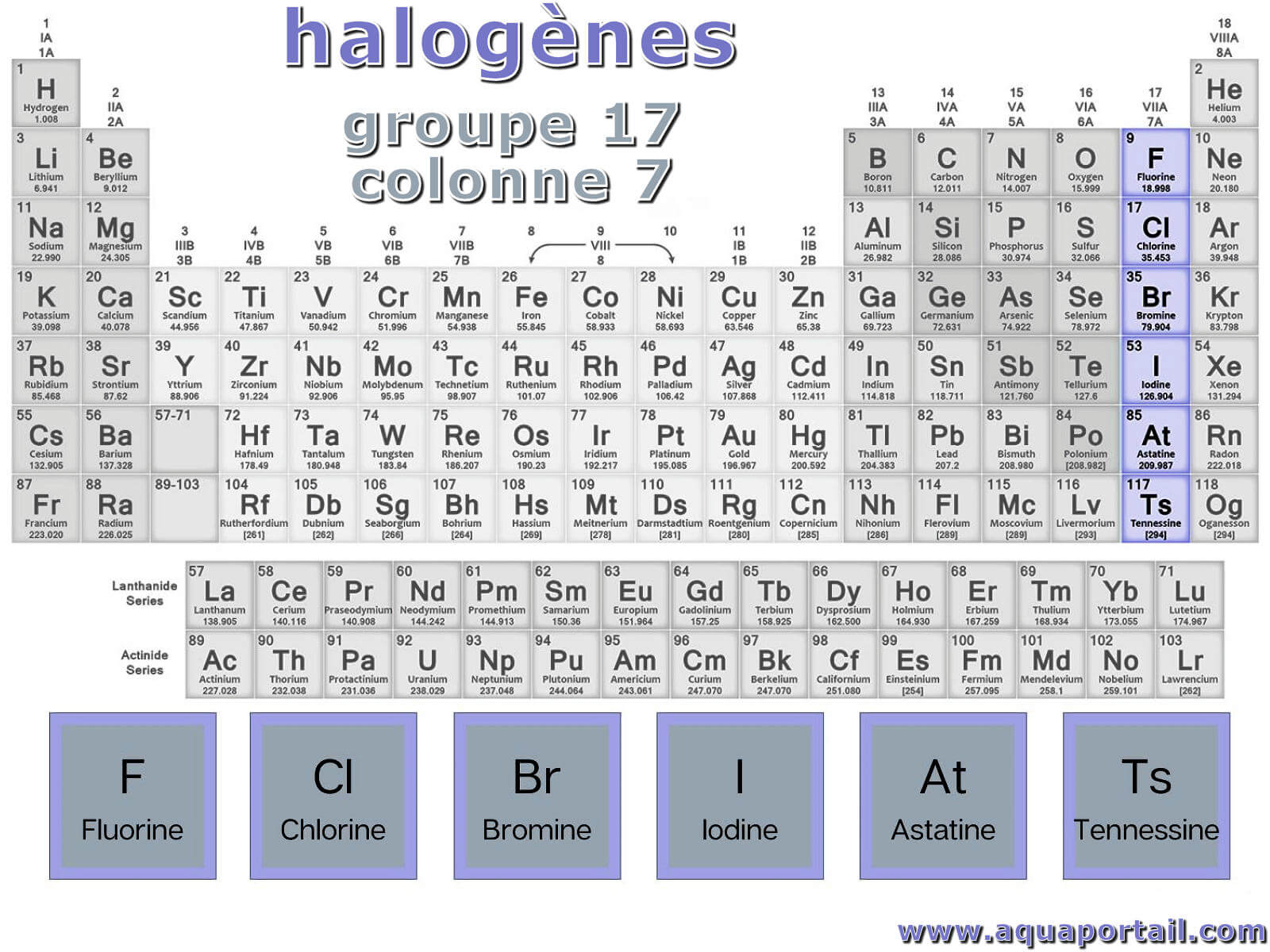
Les éléments halogènes sont le fluor, le chlore, le brome, l'iode, l'astatine et la tennessine. Ces éléments appartiennent au groupe 17 du tableau périodique.
Explications
À l'état naturel, les halogènes se présentent sous forme de molécules diatomiques chimiquement actives [X2]. Pour compléter leur dernière couche électronique (s2p5), ils nécessitent un électron supplémentaire, ce qui les amène à former un ion mononégatif, X-. Cet ion est appelé un halogénure et les sels qui en sont constitués sont désignés sous le nom d'halogénures. Leur électronégativité est égale ou supérieure à 2,5 sur l'échelle de Pauling, avec le fluor en tête pour l'électronégativité la plus élevée. Celle-ci diminue progressivement en descendant dans le groupe. Ces éléments sont de puissants oxydants, bien que cette propriété s'atténue également en descendant dans le groupe. Le fluor, en particulier, est capable de porter la plupart des éléments à leur état d'oxydation maximal.
De nombreux composés organiques synthétiques et quelques-uns d'origine naturelle contiennent des halogènes. Ces derniers sont alors qualifiés de composés halogénés. Par exemple, l'hormone thyroïdienne intègre des atomes d'iode dans sa structure. Les chlorures jouent également un rôle vital dans le cerveau en agissant dans le mécanisme du neurotransmetteur inhibiteur GABA (acide gamma-aminobutyrique).
Certains composés ayant des propriétés similaires à celles des halogènes sont appelés pseudohalogènes. Si un pseudohalogénure peut exister, son équivalent pseudohalogène, quant à lui, ne le peut pas. Quelques exemples de pseudohalogénures incluent les ions cyanure (CN-), thiocyanate (SCN-) et fulminate (CNO-).
Dans les civilisations anciennes, comme celles des Phéniciens et des Grecs, le sel commun était utilisé pour conserver les aliments, notamment grâce à sa capacité à saler le poisson.
Caractéristiques
Les halogènes montrent des variations d'énergie de liaison selon qu'ils se trouvent en haut ou en bas du tableau périodique. Le fluorure possède notamment un écart minimal dans ce domaine. Ces éléments affichent une forte énergie de liaison avec d'autres atomes mais des interactions plus faibles au sein de leur molécule diatomique F2. Cela signifie que la réactivité des halogènes diminue lorsque leur position dans le tableau périodique s'abaisse, en raison de l'augmentation de la taille atomique.
Extrêmement réactifs par nature, les halogènes peuvent devenir nocifs pour les organismes vivants s'ils sont présents en grande quantité. Leur forte réactivité découle de leur haute électronégativité, liée à l'efficacité de leur charge nucléaire. Avec sept électrons de valence sur leur couche externe, ils obéissent à la règle de l'octet lorsqu'ils interagissent avec d'autres éléments. Le fluorure est l'élément le plus réactif de cette famille. Il peut même attaquer des matériaux inertes tels que le verre et former des composés avec des gaz nobles supposés inertes. Ce gaz corrosif est également très toxique.
Composés
Les halogènes forment des molécules diatomiques homonucléaires (non testées avec l'astate). En raison de leurs forces intermoléculaires relativement faibles, le chlore et le fluorure font partie du groupe des "gaz élémentaires".
Parmi les composés formés par les halogènes, on peut citer les halogénures d'hydrogène, les halogénures de métaux, les interhalogènes.
Histoire
Étymologiquement, le mot "halogène" vient du grec hals, "sel" et de gènes, "origine" (qui est à l'origine du sel). Le terme halogène, ou sel-formateur, fait référence à la propriété de chacun des halogènes de former avec le sodium un sel similaire au sel ordinaire (chlorure de sodium). Tous les membres du groupe ont une valence de -1 et se combinent avec les métaux pour former des halogénures (également appelés halogénures), ainsi que des métaux et des non-métaux pour former des ions complexes. Les quatre premiers éléments du groupe réagissent facilement avec les hydrocarbures en obtenant les halogénures d'alkyle.
Les éléments halogènes sont ceux qui occupent le groupe 17 de la classification périodique. Les formes moléculaires de l'halogène (diatomique) F, Cl, Br, I et At sont des éléments volatils, dont la couleur s'intensifie avec l'augmentation du nombre atomique. Le fluor est un gaz jaune pâle, légèrement plus lourd que l'air, corrosif et dégage une odeur âcre et irritante. Le chlore est un gaz jaune verdâtre avec une odeur âcre et irritante. Le brome à la température ambiante est un liquide rouge foncé, trois fois plus dense que l'eau, qui se volatilise facilement en produisant une vapeur rougeâtre toxique. L'iode est un solide cristallin à la température ambiante, noir et brillant, qui sublime une vapeur violette très dense et toxique d'une odeur piquante de chlore. L'astate est un élément très instable qui n'existe que sous des formes radioactives à vie courte et qui apparaît dans le processus de désintégration du 235U. Le tableau présente certaines des propriétés physiques et atomiques des éléments de ce groupe.
Tous les atomes ont une configuration qui diffère de celle du gaz noble dans un électron, de sorte que les éléments tendent à former des espèces négatives, X-, ou à former de simples liaisons covalentes. La chimie de ces éléments et de leurs composés change avec leur taille.
Comme prévu, les points de fusion et d'ébullition augmentent lors de la descente dans le groupe, contrairement à ce qui se passe à droite. Les énergies d'ionisation des halogènes présentent des valeurs très élevées qui diminuent lorsque le nombre atomique augmente. Les affinités électroniques sont élevées en raison de la tendance à gagner un électron et à obtenir ainsi la configuration de gaz rare.
Synonymes, antonymes
Voir tous les synonymes pour "halogène".0 synonyme (sens proche) pour "halogène".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à HALOGÈNE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot HALOGENE est dans la page 1 des mots en H du lexique du dictionnaire.
Mots en H à proximité
halobios halochromie haloclastie halocline halogénation halogènehalogénure halogénure d'aryle halomorphe halonitrophile halophile
En rapport avec "halogène"

L'échelle de Pauling est une méthode largement utilisée pour ordonner les éléments chimiques selon leur électronégativité.

L'électronégativité est une mesure de la capacité d'un atome à attirer des électrons vers lui dans une liaison covalente.

L'halogénation est le remplacement d'un ou plusieurs atomes d'hydrogène dans un composé organique par un halogène (fluor, chlore, brome ou iode).
Un halogénure est un composé binaire dans lequel une partie est un atome d'halogène et l'autre est un élément, un cation ou un groupe fonctionnel...
