Protéinase
Définition
Une protéinase est une enzyme de type protéase endopeptidase qui hydrolyse les liaisons peptidiques dans les protéines. Les protéases (enzymes protéolytiques de sérine) sont des enzymes qui décomposent les protéines.
L'activité de la protéinase K :
Hautement caractérisée pour des performances plus constantes, la protéinase K est une protéinase à sérine apparentée à la subtilisine qui hydrolysera une variété de liaisons peptidiques.
Explications
Les protéinases lysent surtout les grosses protéines comme l'albumine ou les globulines. Les protéases régulent l'abondance, l'activité, la fonction des protéines et, par conséquent, presque tous les processus biologiques.
Ces enzymes sont fabriquées par des animaux, des plantes, des champignons et des bactéries. Les enzymes protéolytiques décomposent les protéines dans le corps ou sur la peau. Cela pourrait aider à la digestion ou à la dégradation des protéines impliquées dans le gonflement et la douleur.
Elles peuvent être classées en fonction des groupes chimiques qui coupent les liaisons peptidiques internes.
Protéinase K
La protéinase K est une sérine protéase apparentée à la subtilisine qui hydrolyse une variété de liaisons peptidiques et est fréquemment utilisée pour nettoyer les réactions enzymatiques ou les lysats cellulaires.
Les caractéristiques essentielles de la protéinase K sont :
- hautement caractérisée pour des performances plus constantes;
- activité et stabilité optimales jusqu'à 24 mois;
- active dans une large gamme de températures et de tampons avec une activité optimale entre 20 et 60 °C et un pH entre 7,5 et 12,0;
- aucune activité contaminante d'endonucléase, d'exonucléase, de DNAse ou de RNase détectable.
La protéinase K est une enzyme protéolytique à large spectre, non spécifique, largement utilisée en biologie moléculaire pour inactiver les contaminants protéiques dans les échantillons préparés. Cette endopeptidase reste active sur une large gamme de pH, et des températures relativement élevées.
C'est une protéine très résistante, elle continuera à fonctionner en présence de sels chaotropiques, de détergents et à des températures élevées offrant une méthode efficace et fiable pour les applications les plus exigeantes.
La protéinase K, également connue sous le nom de protéase K, est sécrétée par Tritirachium album si cette moisissure est cultivée en présence de kératine, d'où la désignation "K", comme seule source d'azote.
Métalloprotéinase
Les métalloprotéinases sont des cibles importantes dans la progression du cancer du sein car elles jouent un rôle dans la dégradation de la matrice extracellulaire facilitant l'invasion tumorale et la métastase. Une cible majeure pour les indications non infectieuses des tétracyclines est l'inhibition des métalloprotéinases.
Les métalloprotéases utilisent fréquemment des disulfures ou des ions calcium pour aider à stabiliser la structure de l'enzyme. Les sites métalliques structuraux ont quatre ligands protéiques et aucune molécule d'eau liée au métal. Les ligands Cys, suivis de His, sont les ligands préférés dans de tels sites dans les métalloenzymes de zinc.
Les métalloprotéinases sont sécrétées sous forme de zymogènes inactifs avec une pièce maîtresse structurelle; l'activation de ces zymogènes nécessite un double clivage protéolytique du pro-domaine en N-terminal de la métalloprotéinase.
Le clivage initial des métalloprotéinases, par exemple par la plasmine ou d'autres protéases à sérine, libère un petit peptide et dévoile une nouvelle séquence pour que le second clivage intervienne. Un deuxième petit peptide est ensuite retiré et l'enzyme est entièrement activée avec le site catalytique libre d'interagir avec les cibles.
Protéinase matricielle (MMP)
Les métalloprotéinases matricielles (MMP) sont une famille de collagénases qui ont été impliquées à la fois dans le processus de développement pulmonaire normal et dans les processus destructeurs liés à la réponse inflammatoire.
Les métalloprotéinases matricielles (MMP) sont une famille de protéinases extracellulaires définies par la présence de deux motifs conservés. Un motif est un prodomaine contenant de la cystéine, qui fonctionne, en partie, pour restreindre l'activité catalytique. L'autre motif conservé est un domaine catalytique riche en histine responsable de l'activité endopeptidase.
Protéinase à sérine
Les protéinases à sérine (sérine protéinases ou sérine protéase) sont la plus grande classe de protéinases de mammifères. Elles sont appelés ainsi parce qu'elles ont un résidu de sérine catalytiquement essentiel sur leurs sites actifs. Les protéinases à sérine sont actives de manière optimale à pH neutre et jouent un rôle majeur dans la protéolyse extracellulaire.
Cette classe de protéinases comprend les enzymes digestives (trypsine et chymotrypsine), les protéinases leucocytaires et de nombreuses protéines impliquées dans la coagulation, la fibrinolyse et l'activation du complément.
Sur la base de leur spécificité pour les composants ECM, les MMP sécrétées sont en outre divisées en collagénases, gélatinases, stromélysines, matrilysines et autres groupes.
Des exemples de protéinases à sérine comprennent les leucocytes sérine protéinases neutrophile élastase (NE), la cathepsine G (CG) et la protéinase-3 (PR3), les activateurs du plasminogène (PA) et les granzymes de lymphocytes cytotoxiques (CTL).
Elles comprennent encore les chymases et les tryptases des mastocytes, la famille des kinines des protéinases à sérine et les protéinases à sérine impliquées dans la coagulation et les cascades du complément.
Synonymes, antonymes
Voir tous les synonymes pour "protéinase".4 synonymes (sens proche) de "protéinase" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PROTÉINASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PROTEINASE est dans la page 9 des mots en P du lexique du dictionnaire.
Mots en P à proximité
protéasome protection de l'environnement protection des berges protée protéiforme protéinaseprotéine protéine animale protéine antivirale protéine complète protéine conjuguée
En rapport avec "protéinase"

L'expression protéique est l'étude du complément protéique exprimé du génome et vise à obtenir une vision globale et intégrée des changements dans l'expression...

La gélatinase est une enzyme responsable de l'hydrolyse de la gélatine, du collagène et de certains peptides.
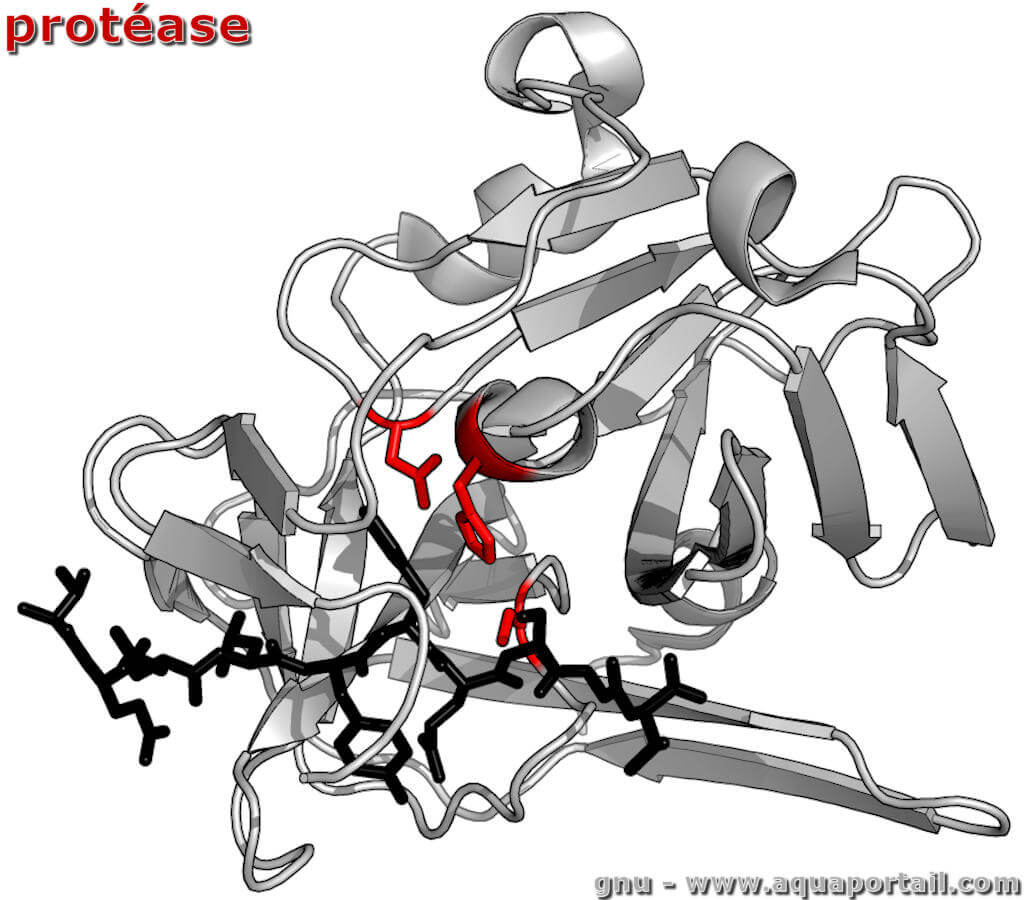
Une protéase est une peptidase, une enzyme protéolytique qui coupe une liaison peptidique au sein d'une séquence protéique, mais pas aux extrémités.

La sérine protéase compose une famille d'enzymes protéolytiques (protéases) présentant une homologie de 40 % dans leurs séquences d'acides aminés.
