Ribonucléase
Définition
Une ribonucléase, également appelée RNase, est une enzyme hydrolase qui catalyse la rupture des liaisons phosphodiester des ARN. Ces nucléases, comme protéines globulaires, catalysent la dégradation de l'ARN en éléments plus petits. Elles sont divisées en endoribonucléases (clivage à l'intérieur de l'ARN) et en exoribonucléases (clivage aux extrémités des ARN). La ribonucléase appartient au groupe des catalyseurs.
La ribonucléase :
Les éléments de structure secondaire de la ribonucléase A de type sauvage. Les deux lobes sont clairement visibles; le premier lobe est constitué de l'hélice 2, du brin 1 et de l'épingle à hélice β majeure, tandis que le deuxième lobe est constitué de l'hélice 3 et des épingles 65–72 et C-terminales. L'hélice N-terminale est en équilibre entre les deux lobes. Les moitiés avant et arrière de la protéine sont également visibles. La moitié intracellulaire arrière est constituée du premier brin β et des trois hélices α, tandis que la moitié avant est constituée des trois épingles à hélices β (65–72, majeure et C-terminale).
En bas, diagramme GRASP de la RNase A de type sauvage, montrant les deux lobes de la protéine séparés par la "bande" chargée positivement dans laquelle le substrat ARN est lié.
Explications
Les ribonucléases sont présentes chez tous les êtres vivants et sont essentielles au métabolisme dans une cellule. Dans le métabolisme cellulaire humain, environ 50 ribonucléases sont connues. Neuf ribonucléases humaines sont maintenant connues pour jouer un rôle dans les maladies héréditaires rares.
Le biochimiste américain Christian Boehmer Anfinsen (1916–1995) a reçu le prix Nobel de chimie en 1972 pour ses travaux sur les ribonucléases.
Fonctions
Tous les êtres vivants possèdent des ribonucléases dans leurs cellules. Cela souligne le fait que le clivage de l'ARN est un processus ancien et très important. Les ribonucléases ont plusieurs fonctions :
- éliminer l'ARN mis au rebut
- détruire des virus à ARN dans une cellule
- jouer un rôle dans d'autres processus d'immunisation tels que l'interférence ARN
Les ribonucléases jouent un rôle important dans la maturation des molécules d'ARN de tous types, en particulier l'ARNm et les ARN non codants. Le système de dégradation de l'ARN est également la première étape de la protection contre les virus contenant de l'ARN, ainsi que contre les systèmes immunitaires cellulaires plus subtils, par exemple l'interférence ARN.
Certaines endoribonucléases reconnaissent et coupent certaines séquences de nucléotides d'ARN simple brin, des propriétés similaires ont des restrictionases - des nucléases qui coupent l'ADN double brin.
Les ribonucléases jouent un rôle clé dans de nombreux processus biologiques, par exemple dans l'angiogenèse, et provoquent également l'impossibilité de l'autopollinisation chez certaines plantes à fleurs.
Inhibiteur de ribonucléase
L'inhibiteur de ribonucléase (IR) est une grande (~450 résidus, ~49 kDa) protéine acide (pH ~4,7) riche en leucine, qui forme des complexes extrêmement étroits avec certaines ribonucléases. C'est une protéine cellulaire majeure, comprenant ~0,1 % de toutes les protéines cellulaires en poids. L'IR joue un rôle important dans la régulation de la durée de vie de l'ARN.
L'inhibiteur de ribonucléase est riche en cystéine (environ 6,5 % contrairement à la plupart des protéines : 1,7 %), ainsi qu'en leucine (21,5 %) en réduisant la quantité d'autres acides aminés hydrophobes, en particulier la valine, l'isoleucine, la méthionine, la tyrosine, la phénylalanine; sensible à l'oxydation.
Dégradation de l'ARNm par les ribonucléases
Une caractéristique structurelle de l'ARNm typique qui contribue à sa stabilité dans le cytoplasme est la coiffe méthyle 5′, dans laquelle la présence de la liaison phosphodiester 5′-5′ le rend résistant à la digestion par les exonucléases 5′-3′. De même, la queue poly-A à l'extrémité 3′ de la transcription protège souvent les messages de la dégradation.
La déadénylation (élimination de la queue) est souvent une condition préalable à la dégradation de l'ARNm (dégradation de l'ARN avec dégradation intracellulaire). En conséquence, les transcrits avec de longues queues poly-A peuvent être plus stables dans le cytoplasme que les transcrits avec de courtes queues poly-A.
Classification
Les ribonucléases sont divisées en endonucléases (endoribonucléases) et exonucléases (exoribonucléases). Plusieurs classes et sous-classes d'enzymes connues pour relever des classes d'enzymes du numéro CE 2.7 et du numéro CE 3.1 (enzymes hydrolytiques). L'Union internationale de biochimie et de biologie moléculaire a réservé les numéros CE 3.1.26 et 3.1.27 aux endonucléases et les numéros CE 3.1.13 et 3.1.14 aux exonucléases. Bien que peu de nucléases soient connues pour hydrolyser à la fois l'ARN et l'ADN, les nombres EC (3.1.15.- et 3.1.16.-). Cela concerne à la fois l'ARN simple et double brin, dans lequel aucune distinction n'est faite dans la classification de la RNase.
Les ribonucléases sont classées sous les hydrolases (numéro CE 3) selon le système de classification enzymatique du Comité de nomenclature de l'Union internationale de biochimie et de biologie moléculaire (NC-IUBMB). Les ribonucléases, avec les phosphodiestérases, les lipases et les phosphatases, appartiennent aux estérases (numéro EC 3.1), un sous-groupe des hydrolases. Ils décomposent les esters. Les estérases auxquelles appartiennent les ribonucléases et qui décomposent les acides nucléiques sont classées dans les groupes EC numéro 3.1.11 - numéro CE 3.1.31.
Types
Les principaux types d'endoribonucléase sont :
- RNase A (CF 3.1.27.5) : largement utilisée dans les laboratoires de biochimie. Par exemple, la ribonucléase A du pancréas bovin (PDB 2AAS) est l'une des enzymes les plus utilisées dans la pratique de laboratoire. Il est spécifique aux ARN monocaténaires, coupe la terminaison 3′ des nucléotides cytidyle et uridyle non appariés, laissant le produit 3′-phosphorylé sous forme de monophosphate 2',3′-cyclique.
- RNase H (EC 3.1.26.4) : clive l'ARN, qui se présente sous la forme d'un hétéroduplex d'ARN/ADN. Sous l'action de la ribonucléase H, de l'ADN simple brin se forme. La ribonucléase H est une endonucléase non spécifique et catalyse le clivage de l'ARN par mécanisme d'hydrolyse en présence d'un ion métallique divalent lié. À la suite de l'activité de la ribonucléase H, un produit phosphorylé de 5′ est formé.
- RNase I : coupe l'extrémité 3′ des ARN simple brin, le long de toutes les liaisons nucléotidiques nucléotidiques, laissant un groupe hydroxyle et un phosphate à l'extrémité 3′ à l'extrémité 5′, à travers un état de transition sous la forme d'un monophosphate 2',3′-cyclique.
- RNase III (QF 3.1.26.3) : est une ribonucléase qui coupe les ARN ribosomiques 16S et 23S du produit de transcription de l'ARN ribosomique de l'opéron polykystronique chez les procaryotes. La RNase III clive les ARN double brin, coupe les pré-microARN en sites spécifiques, formant des microARN plus courts, et participe ainsi à la régulation de la durée de vie de l'ARNm.
- RNase L : est une nucléase inductible à l'interféron qui, après induction, décompose tout l'ARN de la cellule.
- RNase P (QF 3.1.26.5) : est un ribozyme, une molécule d'ARN aux propriétés catalytiques, qui participe au métabolisme des ARN de transport.
- RNase PhyM : est spécifique à l'ARN simple brin, coupe l'extrémité 3′ des nucléotides adényle et uridyle non appariés.
- RNase T1 (EC 3.1.27.3) : est spécifique à l'ARN simple brin, coupe l'extrémité 3′ des nucléotides de guanyle non appariés.
- RNase T2 (CF 3.1.27.1) est spécifique à l'ARN simple brin, coupe l'extrémité 3′ sur toutes les bases azotées, mais principalement sur les bases adényles.
- RNase U2 (QF 3.1.27.4) est spécifique aux ARN monocaténaires, coupés à l'extrémité 3′ des bases adényles non appariées.
- RNase V1 (QF 3.1.27.8) est une séquence non spécifique aux ARN double brin, coupant tous les nucléotides appariés.
Les principaux types d'exoribonucléase sont :
- polynucléotide phosphorylase (CF 2.7.7.8) a à la fois une activité exonucléase et nucléotide-transférase.
- RNase PH (EC 2.7.7.56) a à la fois une activité exonucléase et nucléotide-transférase.
- RNase II divise l'ARN simple brin dans la direction de 3′-5′.
- RNase R est un homologue proche de la RNase II, cependant, contrairement à la RNase II, elle divise l'ARN avec des structures secondaires sans la participation de facteurs auxiliaires.
- RNase D (CF 3.1.13.5) divise le pré-ARNt dans la direction de 3′-5′.
- RNase T est l'enzyme principale pour la maturation des ARN stables dans le sens de 3′-5′.
- oligoribonucléase (EC 3.1.13.3) décompose les oligonucléotides courts en mononucléotides.
- exoribonucléase I (EC 3.1.11.1) clive les ARN simple brin dans la direction de 5′ à l'extrémité 3′, que l'on ne trouve que chez les eucaryotes.
- exoribonuclease II (EC 3.1.13.1) est un homologue proche de l'exoribonucléase I.
Synonymes, antonymes
Voir tous les synonymes pour "ribonucléase".3 synonymes (sens proche) de "ribonucléase" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à RIBONUCLÉASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot RIBONUCLEASE est dans la page 3 des mots en R du lexique du dictionnaire.
Mots en R à proximité
rhume rhytidome ria ribitol riboflavine ribonucléaseribonucléoside ribonucléotide ribose riboside ribosome
En rapport avec "ribonucléase"

Une désoxyribonucléase est une enzyme qui catalyse l'hydrolyse des chaînes moléculaires d'acide désoxyribonucléique (ADN) en chaînes moléculaires plus courtes...
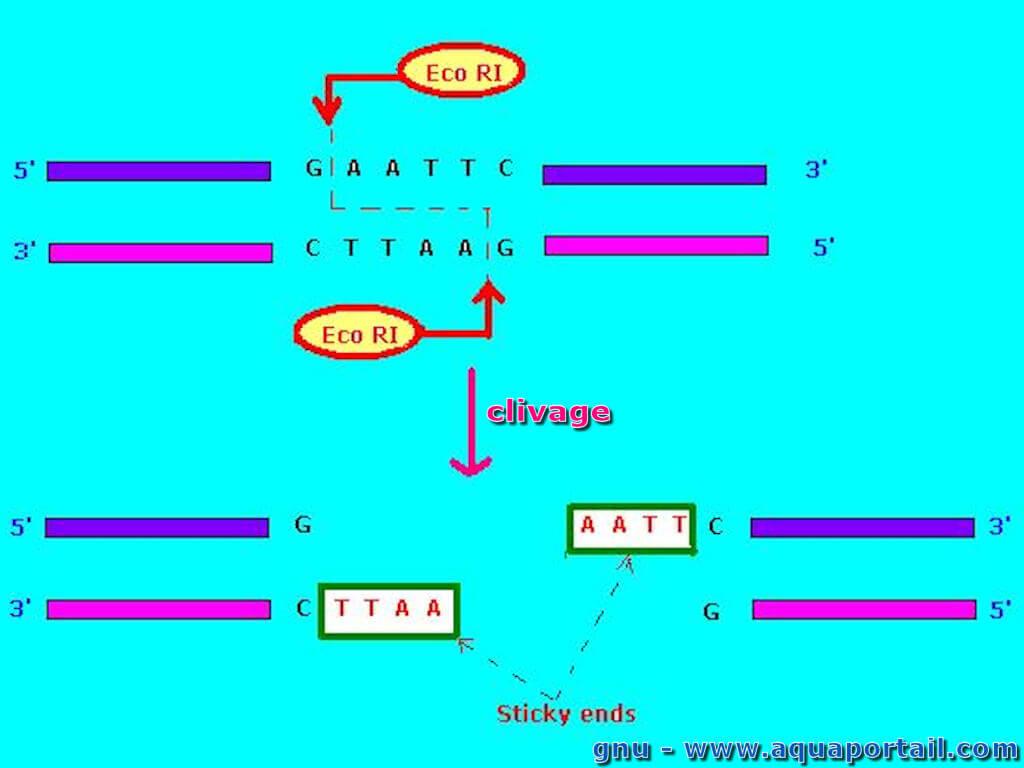
Une endonucléase est une nucléase qui se passe à l'intérieur, en dedans, par hydrolysation.
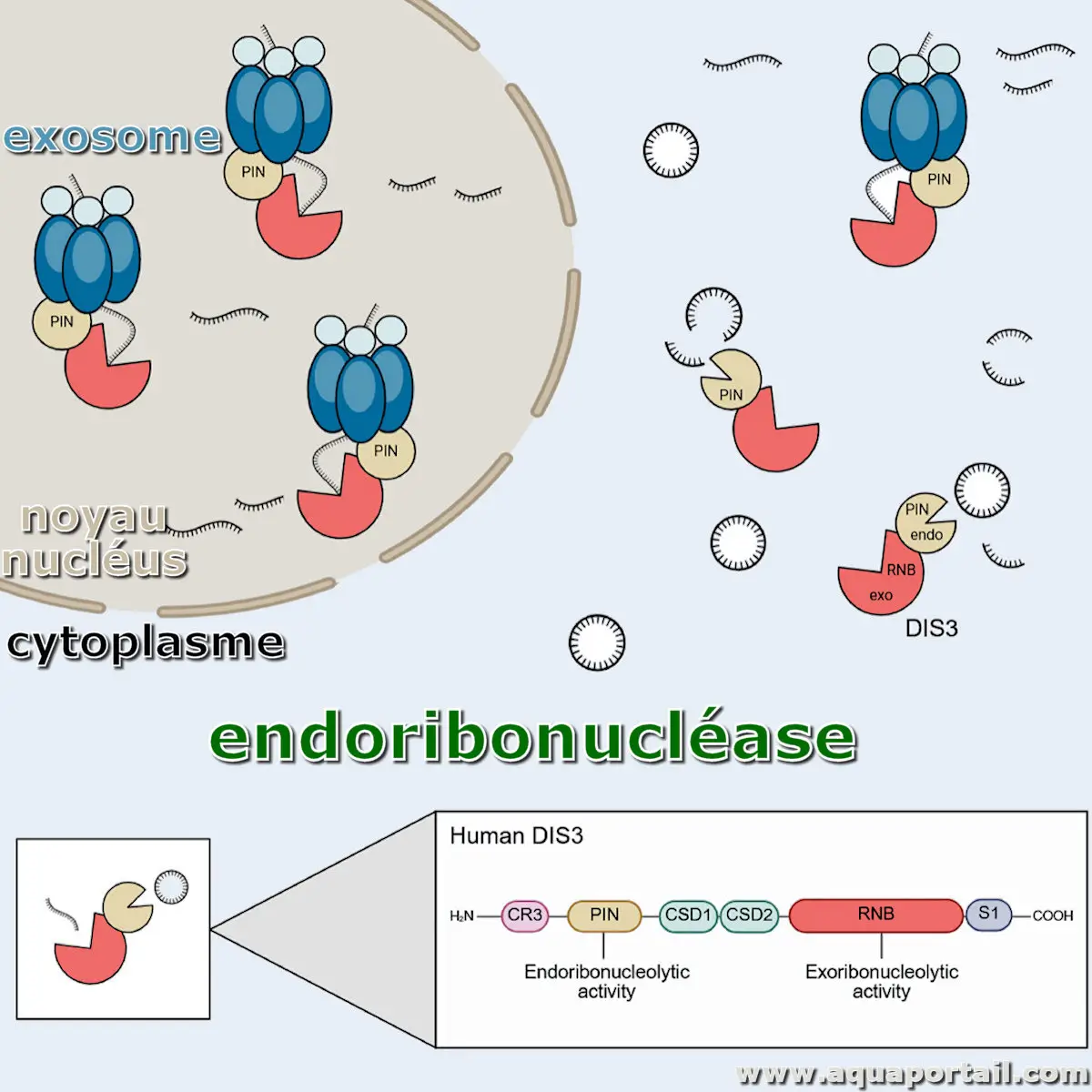
Une endoribonucléase est une enzyme appartenant au groupe plus large des ribonucléases, spécialisée dans le clivage de l'ARN.
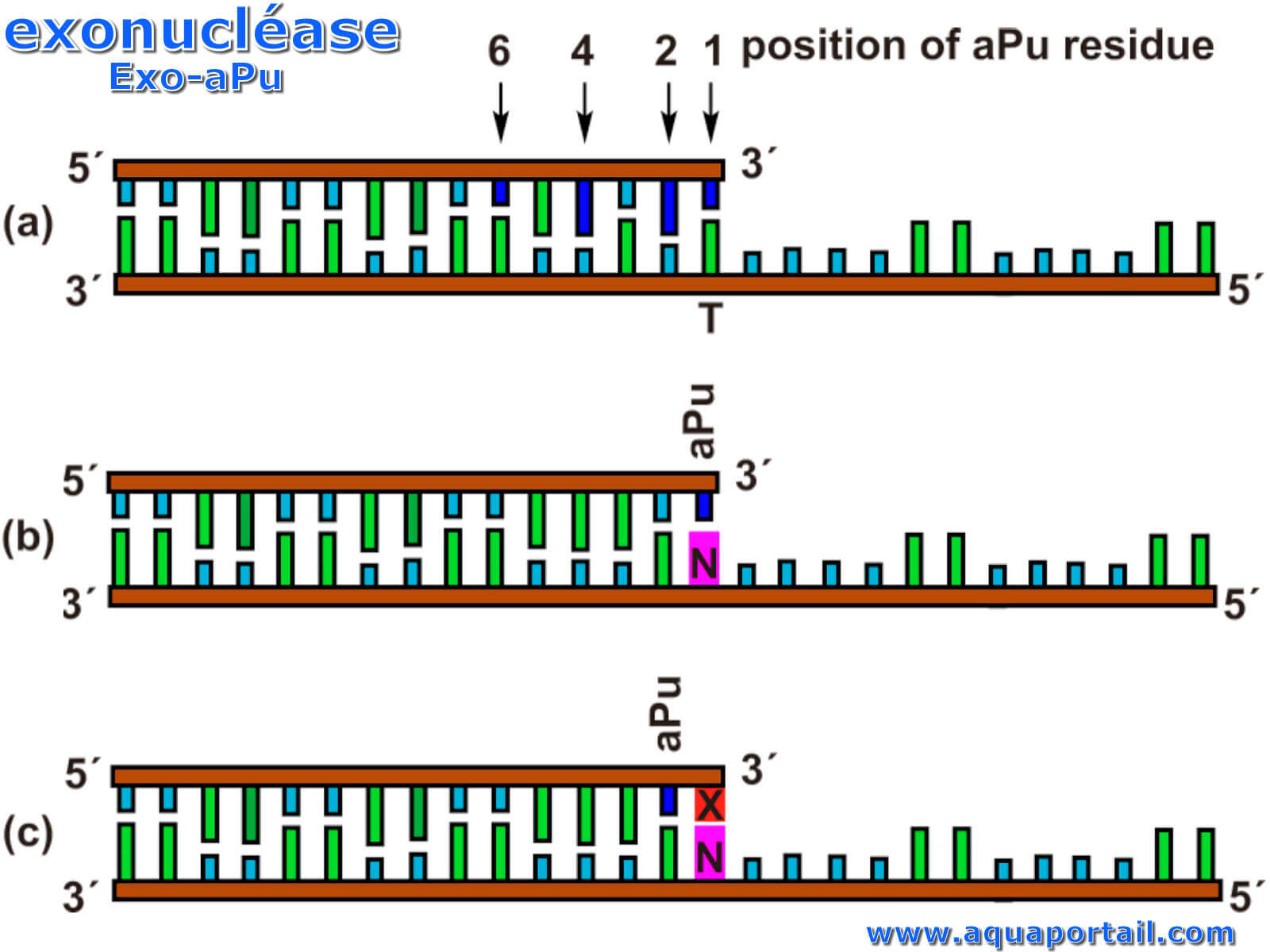
L'exonucléase distingue la partie qui est au-dehors de la nucléase. Les exonucléases sont des enzymes qui fonctionnent en coupant les nucléotides...
