Phosphorylase
Définition
Une phosphorylase est une enzyme qui catalyse l'estérification d'un ose par un phosphate (réaction de phosphorylation). Les phosphorylases sont un groupe spécial de glycosyltransférases qui catalysent la phosphorylation de la liaison glycosidique à l'extrémité non réductrice, libérant un résidu sucre monophosphate.
Réactions de la glycogène phosphorylase :
Mécanisme en cascade pour l'activation de la glycogène phosphorylase.
Explications
Les phosphorylases sont des enzymes qui catalysent l'addition d'un groupe phosphate d'un phosphate inorganique à un accepteur. Elles catalysent le transfert d'un résidu pentose ou hexose d'un di ou polysaccharide ou d'un nucléoside en un ion orthophosphate. Ce sont donc des glycosyltransférases spéciales. Cette classification comprend des enzymes allostériques qui catalysent la production de glucose 1-phosphate à partir de glucanes tels que le glycogène, l'amidon ou la maltodextrine.
Les phosphorylases ne doivent pas être confondues avec les phosphatases, qui éliminent les groupes phosphate. En termes généraux, les phosphorylases sont des enzymes qui catalysent l'addition d'un phosphate d'un phosphate inorganique à un accepteur, des phosphatases sont des hydrolases qui éliminent des groupes phosphonate d'un substrat à l'aide d'eau, et des kinases sont des transferases qui transfèrent des groupes phosphate d'un donneur., qui est généralement ATP, à un accepteur.
Une classification par numéro d'enzyme distingue le membre le plus important du groupe, la glycogène phosphorylase de la saccharose phosphorylase, la maltose phosphorylase d'une part, et la purine nucléoside phosphorylase, la pyrimidine nucléoside phosphorylase, l'uridine phosphorylase, l'uridine phosphorylase et la 5-méthyl-5′-thioadénosine phosphorylée.
Le nom phosphorylase est également un nom commun et informel pour l'enzyme glycogène phosphorylase, en l'honneur de Earl W. Sutherland qui a découvert la première phosphorylase à la fin des années 1930.
Les phosphorylases ne doivent pas être confondues avec les phosphatases ou les kinases. Voir aussi une hydrolase.
Formes de phosphorylases
La phosphorylase existe sous trois isoformes : le muscle (M), le foie (L) et le cerveau (B). Chaque isoforme est codée par des gènes appelés PYGM, PYGL ou PYGB, qui sont respectivement situés sur les chromosomes 11, 14 et 20. Des mutations du gène PYGM sont associées à la GSD V (maladie de McArdle), une maladie causée par un déficit en phosphorylase musculaire (voir plus loin). Des mutations dans le gène PYGL, au contraire, provoquent un déficit en GSD VI (maladie de Hers) ou en phosphorylase hépatique. Jusqu'à présent, le gène PYGB n'a été lié à aucune forme de GSD.
Carence en phosphorylase
Une carence en phosphorylase (ou l'une des enzymes qui conduit à son activation) obstrue la dégradation du glycogène dans le foie. L'absence d'hypoglycémie sévère à jeun peut s'expliquer par le fait que l'activité phosphorylase n'est généralement que partiellement déficiente et que la gluconéogenèse hépatique est intacte. Cependant, il existe des cas d'hypoglycémie à jeun sévère. Les études de laboratoire révèlent des élévations légères à modérées des valeurs des transaminases sériques, de la cétonémie et de l'hyperlipidémie. Les taux sanguins d'acide lactique et urique à jeun sont normaux. Les valeurs de lactate dans le sang peuvent tripler après les repas et après une charge en glucose, galactose et fructose. On rapporte que l'administration de glucagon provoque une réponse glycémique minimale chez les patients présentant un déficit en phosphorylase.
Glycogène phosphorylase
L'enzyme régulatrice la plus importante dans la voie de dégradation du glycogène est la glycogène phosphorylase (ou simplement la phosphorylase). Dans le foie et les muscles, qui contiennent les plus grandes réserves de glycogène de l'organisme, l'enzyme se trouve sous deux formes, inactive (b) et active (a).
La glycogène phosphorylase musculaire est différente de celle trouvée dans le foie; ce sont des isozymes distincts synthétisés sous le contrôle de gènes différents. Leurs propriétés ne sont pas exactement les mêmes, mais les mécanismes de régulation sont similaires; les deux sont sensibles à la modification covalente et aux effecteurs allostériques.
La phosphorylase b dans le muscle et le foie est stimulée par l'ajout d'une liaison ester phosphate au groupe hydroxyle d'un résidu sérine sur chacune de ses deux sous-unités. Cette phosphorylation est catalysée par la phosphorylase kinase, qui transfère le phosphate de l'ATP et forme la glycogène phosphorylase a.
L'inactivation de la phosphorylase intervient par hydrolyse de la liaison ester phosphate entre la sérine et le groupe phosphoryle, qui est catalysée par la protéine phosphatase 1 (PP1). La glycogène phosphorylase a est convertie en b.
L'activation de la glycogène phosphorylase est un exemple de modification covalente et elle est le résultat d'une cascade de réactions dans laquelle le produit de chaque réaction agit comme l'activateur de la suivante (série de réactions impliquées dans l'activation de la glycogène phosphorylase). Le processus est initié par les hormones, l'épinéphrine dans le muscle et le glucagon dans le foie. L'hormone se lie à des récepteurs spécifiques de la membrane cellulaire et active une enzyme appelée adénylate cyclase.
L'adénylate cyclase catalyse la conversion de l'ATP intracellulaire en adénosine monophosphate 3′,5′-cyclique (AMP cyclique). Cet AMP cyclique fonctionne comme un régulateur de nombreuses hormones; c'est le "second messager" dans le système de signaux chimiques initié par l'arrivée de l'hormone, considérée comme le "premier messager".
Le niveau accru de 3′,5′-AMP cyclique dans le cytosol active la protéine kinase A. La protéine kinase A phosphoryle la liaison simple OH d'un résidu sérine sur la phosphorylase kinase. Cette enzyme se retrouve également sous deux formes, a et b, à l'état déphosphorylé (b) elle est inactive. La phosphorylase kinase activée (a), à son tour, catalyse le transfert du phosphate de l'ATP à la glycogène phosphorylase b, le convertissant en a. Cela initie la dégradation du glycogène en glucose-1-phosphate.
Des cascades de réactions de ce type produisent de grandes amplifications d'une réponse. Quelques molécules d'hormone favorisent la production de quantités importantes de molécules intermédiaires, telles que l'AMP cyclique et les effets en aval souhaités dans les cellules.
En raison de son activité physiologique, l'AMP cyclique doit être rapidement dégradé. Une phosphodiestérase dans le cytosol catalyse l'hydrolyse de la liaison ester entre le groupe phosphate et hydroxyle du ribose C3′, convertissant l'AMP 3′,5′-cyclique en 5′-AMP, sans activité.
La phosphorylase a est inactivée par une phosphorylase phosphatase, également appelée phosphoprotéine phosphatase 1 (PP1). Cette enzyme sépare le groupe phosphoryle pour convertir la phosphorylase a en sa forme inactive, la phosphorylase b.
En plus de la modification covalente, la glycogène phosphorylase est soumise à une modulation allostérique.
Lors d'un exercice soudain et intense, la concentration intracellulaire d'ATP diminue rapidement et l'ADP et l'AMP augmentent. L'AMP agit comme un effecteur allostérique de la glycogène phosphorylase b, modifiant sa conformation et l'activant. L'ATP et le G-6-P sont des effecteurs négatifs de l'enzyme. Dans le muscle au repos, la concentration d'ATP est élevée; la plus grande partie de la glycogène phosphorylase est inactive. La phosphorylase a (phosphorylée) est active quels que soient les taux d'AMP, d'ATP ou de G-6-P.
La glycogène phosphorylase hépatique se comporte différemment de celle du muscle et n'est pas sensible aux variations de concentration en AMP. Cette isoforme est inhibée par des niveaux élevés de glucose. Le glucose dans les hépatocytes se lie à un site allostérique inhibiteur dans la phosphorylase a. Un changement de conformation de l'enzyme expose les résidus de phosphorylsérine liés à l'action de la PP1. Ainsi, il agit comme un capteur de taux de glucose.
La différence entre le muscle et le foie est liée au rôle de la glycogénolyse dans chacun de ces tissus. Dans le muscle, la dégradation du glycogène est activée pour répondre aux besoins énergétiques du muscle. Dans le foie, le glucose n'est pas la principale source d'énergie des tissus. La glycogénolyse hépatique libère du glucose dans la circulation sanguine lorsque la glycémie est basse, qui est ensuite transportée dans tous les tissus du corps.
La phosphorylase kinase b est également activée allostériquement par des niveaux élevés de Ca2+. L'une des sous-unités de l'enzyme est la calmoduline, une protéine qui lie le calcium et favorise l'activation. Ce mécanisme de régulation est physiologiquement pertinent dans le muscle, dans lequel la contraction est initiée par une augmentation brutale de la concentration de Ca2+ dans le cytosol. Ainsi, l'augmentation de Ca2+, qui est le signal qui déclenche la contraction, favorise la dégradation du glycogène pour fournir l'énergie nécessaire au soutien du travail musculaire.
Lorsque le muscle est au repos, une autre enzyme, PP1, clive les groupes phosphoryle et convertit la phosphorylase a en sa forme inactive, la phosphorylase b.
Catabolisme des oligosaccharides
La polysaccharide phosphorylase (α-1,4-glucane : orthophosphate glucosyltransférase) catalyse le clivage phosphorylytique du α-d-glucose-1-phosphate de l'extrémité non réductrice de la chaîne amylose. Il est à noter que le produit de la réaction est dans la configuration et donc aucune inversion nette ne survient pendant la phosphorolyse (phosphorylation). L'arséniate remplacera le phosphate (arsénolyse), mais dans ce cas, le produit est du glucose libre, probablement parce que le glucose-1-arséniate est instable. La réaction est réversible; en fait, l'intérêt initial de la phosphorylase était pour son rôle dans la biosynthèse du glycogène. Toutes les phosphorylases polysaccharidiques nécessitent une amorce oligosaccharidique, bien que la longueur de l'amorce varie avec la source d'enzyme. Toutes les phosphorylases polysaccharidiques contiennent du phosphate de pyridoxal comme groupe prothétique, mais les moyens par lesquels ce cofacteur fonctionne sont inconnus.
Des phosphorylases ont été signalées chez les animaux, les plantes et les bactéries, mais les enzymes d'origine animale et végétale sont les mieux caractérisées. La phosphorylase a été signalée chez des espèces de Clostridium, Streptococcus, Neisseria, Corynebacterium et Agrobacterium. Dans de nombreux cas, l'activité observée n'est apparue que lorsque l'organisme a été cultivé en présence d'amidon. Il n'y a pas d'études avec des enzymes bactériennes purifiées et on ne sait pas si l'action des enzymes bactériennes est similaire à celle des phosphorylases animales et végétales.
Synonymes, antonymes
Voir tous les synonymes pour "phosphorylase".1 synonyme (sens proche) de "phosphorylase" :
- glycogène phosphorylase
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PHOSPHORYLASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PHOSPHORYLASE est dans la page 3 des mots en P du lexique du dictionnaire.
Mots en P à proximité
phosphoprotéine phosphore phosphore minéral dissous phosphorescence phosphorisation phosphorylasephosphorylation phosphorylation oxydative phosphotransférase phosvitine photique
En rapport avec "phosphorylase"
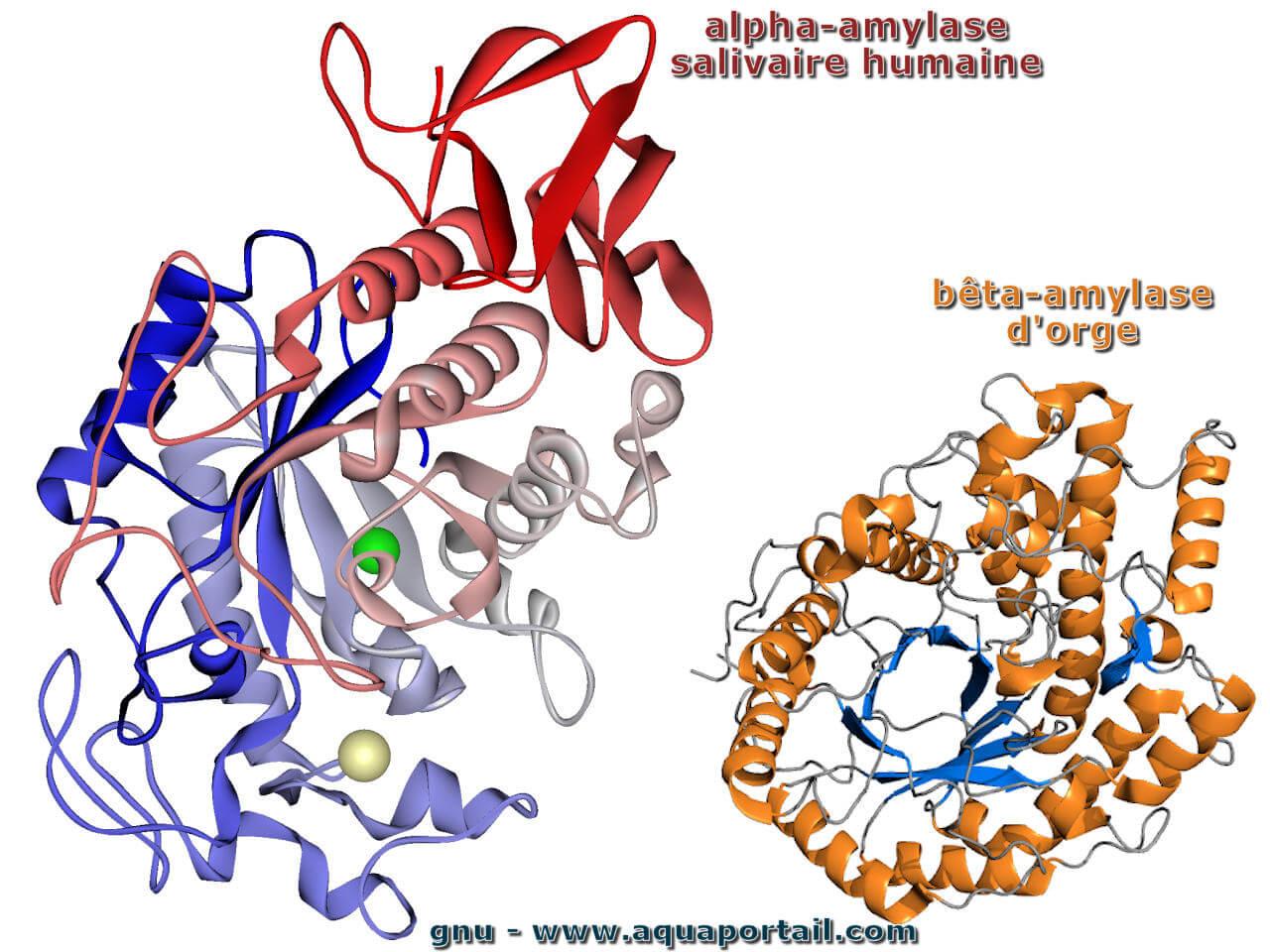
Une amylase est une enzyme digestive saccharidase, qui brise les polysaccharides, qui catalyse l'hydrolyse des alpha-glucosanes en maltose et dextrines.
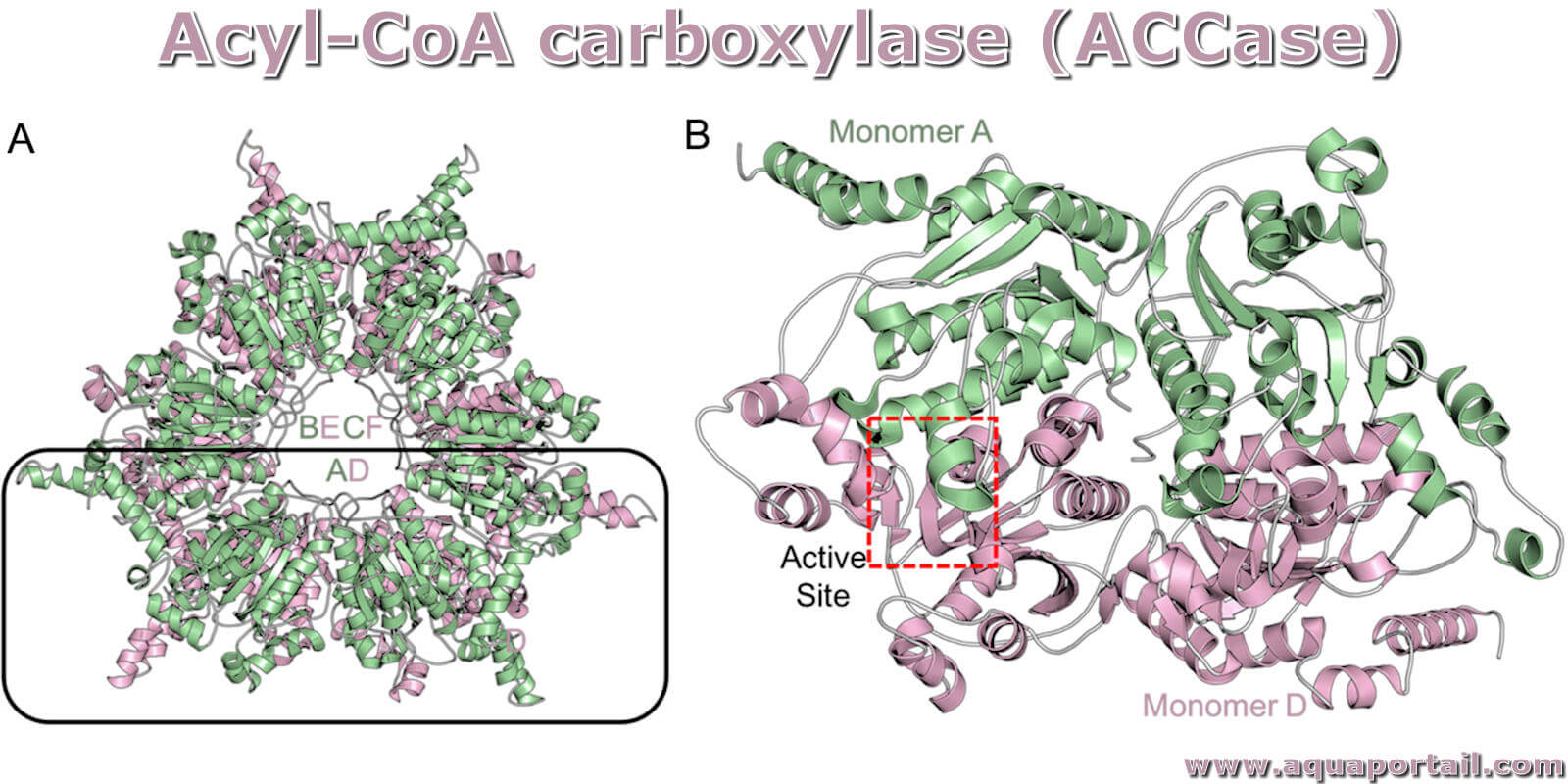
Une carboxylase est une enzyme qui catalyse la fixation du CO₂, un acide, sur un composé organique par carboxylation.
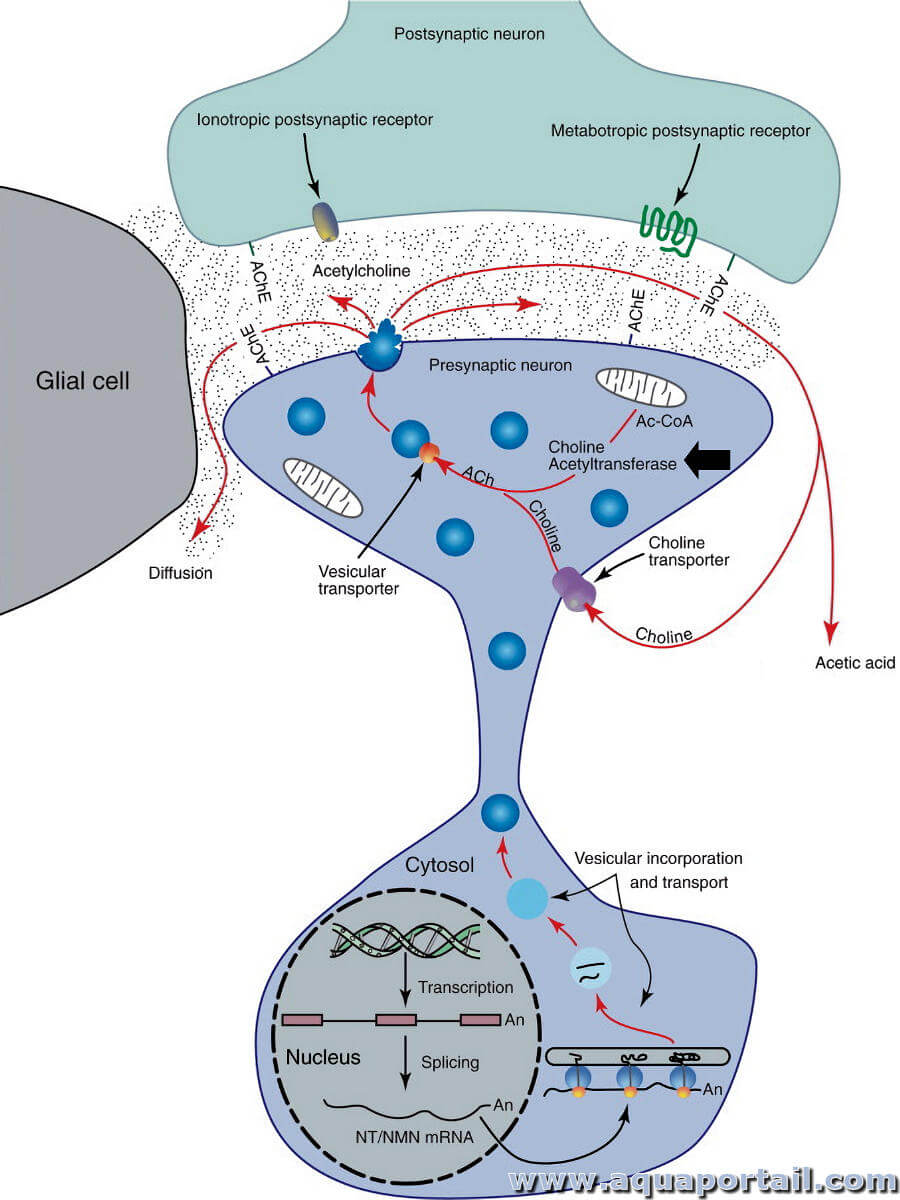
La choline acétyltransférase (ChAT), l'enzyme utilisée pour synthétiser l'acétylcholine, est exprimée par une petite population de neurones corticaux...

Une décarboxylase est une enzyme qui catalyse une réaction de décarboxylation, c'est-à-dire le détachement d'une molécule de CO₂ qui conduit à l'élimination...
