Estérase
Définition
Une estérase est une enzyme du groupe des hydrolases (EC 3.1) qui catalyse l'hydrolyse des liaisons ester (entre un alcool ou phénol et un acide). Il existe de nombreuses estérases différentes en fonction du substrat utilisé, de la structure des protéines et de la fonction biologique. Voir aussi la cholinestérase, l'acétylcholinestérase et la phosphodiestérase.
Un schéma des réactions de la lipase/estérase :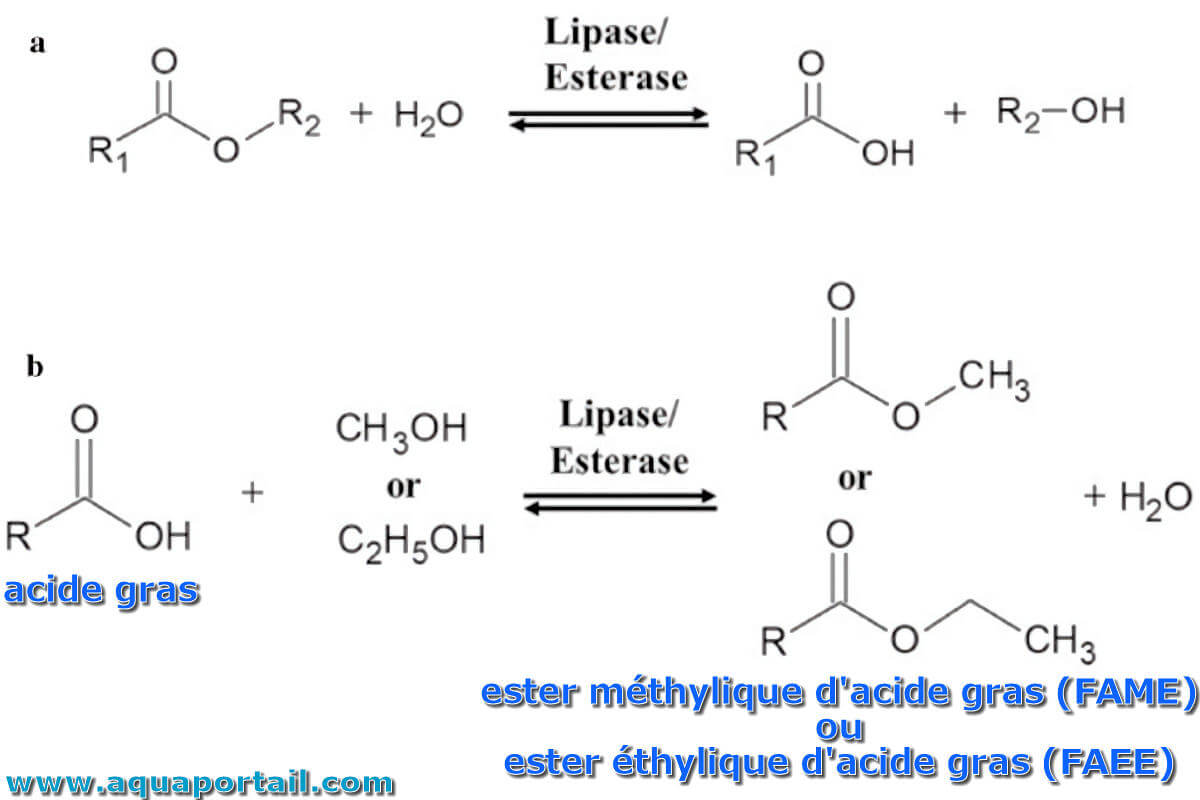
Schéma réactionnel de la lipase/estérase. (a) Dans une réaction générale, la lipase/estérase sont impliquées dans l'hydrolyse et la formation de l'estérase. (b) Les biocarburants tels que l'ester méthylique d'acide gras (FAME) ou l'ester éthylique d'acide gras (FAEE) peuvent être préparés en utilisant une lipase/estérase avec un acide gras et du méthanol ou de l'éthanol.
Explications
Une estérase est une hydrolase qui rompt les liaisons ester dans les alcools et les acides correspondants au moyen d'une réaction chimique dans laquelle une molécule d'eau est utilisée, c'est-à-dire au moyen de l'hydrolyse.
Les estérases sont des enzymes chez tous les êtres vivants qui sont capables d'hydrolyser des esters en un alcool et un acide (saponification). Il s'agit donc d'hydrolases. Les estérases qui divisent les graisses sont appelées lipases. Les estérases qui divisent les phosphates sont appelées phosphatases. Le clivage des acides nucléiques est réalisé par des nucléases.
Les estérases (au sens étroit des carboxyestérases) sont trouvées dans la biocatalyse comme application de biocatalyseur. Elles se trouvent entre autres dans le foie humain. L'estérase du foie de porc (PLE), par exemple, a une importance industrielle.
Les estérases catalysent l'hydrolyse des esters d'acide carboxylique, tandis que les hydroxynitrile lyases catalysent l'élimination du cyanure d'hydrogène des cyanhydrines. Les deux sites actifs contiennent une triade catalytique sérine-histidine-aspartate (Ser-His-Asp). La protéine de liaison à l'acide salicylique 2 (SABP2) catalyse l'hydrolyse du salicylate de méthyle. L'ester de substrat se lie à l'oxygène carbonylé dans le trou d'oxyanion. La première étape de la réaction est l'attaque nucléophile par la sérine O sur le carbone carbonyle. Le mécanisme implique un intermédiaire d'enzyme acyle.
Estérases et amidases
Les réactions d'estérase et d'amidase sont catalysées par les mêmes enzymes, malgré l'attribution de numéros de classe d'enzymes différents pour les deux activités différentes. Les estérases sont regroupées en fonction de leur interaction avec les organophosphates toxicologiquement importants en A-, B- et C-estérases. Les organophosphates sont des substrats et sont donc détoxifiés par les A-estérases alors que les organophosphates sont de puissants inhibiteurs des B-estérases, qui sont à la base de leur toxicité (insecticide sélectif et surdosage involontaire chez les mammifères). Les C-estérases n'interagissent pas avec les organophosphates.
L'estérase, l'amidase et la perhydrolase partagent un mécanisme commun, dans lequel un Ser (sérine), qui est activé par une dyade His-Asp (histidine et aspartate), sert de nucléophile. Ser-His-Asp est une triade catalytique. Par la suite, l'estérase et l'amidase sont hydrolysées par une molécule d'eau activée, alors que dans les perhydrolases, une H2O2 activée est impliquée. L'haloalcane déshalogénase et l'époxyde hydrolase partagent un mécanisme différent, dans lequel un Asp sert de nucléophile. Une molécule d'eau, qui est également activée par la dyade His-Asp, hydrolyse la liaison ester entre Asp et le produit. Contrairement à ces mécanismes de réaction, dans les hydroxynitrile lyases, aucun intermédiaire covalent enzyme-substrat n'est formé. Encore une fois, la triade catalytique est impliquée, mais le Ser activé agit comme base et soustrait un proton du groupe hydroxyle de la cyanhydrine. Par la suite, le cyanure est libéré.
A-estérase
Bien que les esters dérivés de composés aromatiques soient des substrats préférés des A-estérases (également appelées aryle estérases), les substrats les plus importants du point de vue toxicologique sont les organophosphates. La toxicité sélective envers les insectes est due au manque d'organophosphates détoxifiant les A-estérases chez les non-vertébrés, tandis que les mammifères sont largement protégés par leurs activités élevées en A-estérase.
B-estérase
Le membre dominant des B-estérases est l'acétylcholine estérase responsable de l'inactivation du neurotransmetteur acétylcholine. Les organophosphates sont des inhibiteurs mécaniques des B-estérases. Leurs effets toxiques sont produits par une accumulation d'acétylcholine et donc par une activité cholinergique exagérée. L'effet inhibiteur des organophosphates est dû au fait que l'ester enzymatique de phosphosérine formé entre les B-estérases et les organophosphates s'hydrolyse très lentement, voire pas du tout, et donc il n'y a pratiquement pas de régénération de l'enzyme.
L'inhibition d'une autre B-estérase, la neuropathie estérase cible localisée dans le système nerveux central, conduit à une neurotoxicité appelée polyneuropathie retardée induite par les organophosphorés. La neurotoxicité observée chez certains vétérans de la guerre du golfe est soupçonnée d'avoir été causée par une combinaison de la pyridostigmine, un inhibiteur de l'acétylcholine estérase (utilisé comme antidote contre les armes chimiques anticholinergiques), avec des insecticides organophosphorés.
La carboxyle estérase non spécifique exprimée principalement dans le foie est également une B-estérase. Il métabolise de nombreux esters et amides xénobiotiques, y compris plusieurs antiarythmiques et anesthésiques. La carboxylestérase non spécifique est polymorphe chez l'homme. Les personnes dépourvues de cette activité estérase sont sujettes à une toxicité de surdosage des médicaments qui sont préférentiellement hydrolysés par cette enzyme. Chez les individus déficients en caboxylestérase non spécifique, l'agent de blocage neuromusculaire, le suxaméthonium, conduit à une toxicité de surdosage (relaxation des muscles du diaphragme, arrêt de la respiration et décès) si la respiration artificielle habituelle n'est pas utilisée ou si la dose n'est pas ajustée.
C-estérase
Les C-estérases hydrolysent préférentiellement les esters acétyliques. Par conséquent, ils sont également appelés acétylestérases. Les substrats typiques sont l'acétate de 4-nitrophényle, le chloroacétate de propyle et le diacétate de fluorescéine.
Synonymes, antonymes
Voir tous les synonymes pour "estérase".0 synonyme (sens proche) pour "estérase".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ESTÉRASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ESTERASE est dans la page 4 des mots en E du lexique du dictionnaire.
Mots en E à proximité
essaimage essartage essence essence endémique ester estéraseestérification esthésie esthésiologie esthèteestimation par échantillonnage
En rapport avec "estérase"

L'acétylcholinestérase (AChE) est une enzyme impliquée dans la transmission de l'influx nerveux.
Une cholinestérase (ChE) sont des enzymes d'ester de choline. Elles sont indispensables dans le métabolisme des animaux pluricellulaires à décomposer...

Une phosphodiestérase (PDE) est une enzyme qui catalyse l'hydrolyse de l'AMPc et du GMPc. Les phosphodiestérases sont des enzymes hydrolysant les nucléotides...
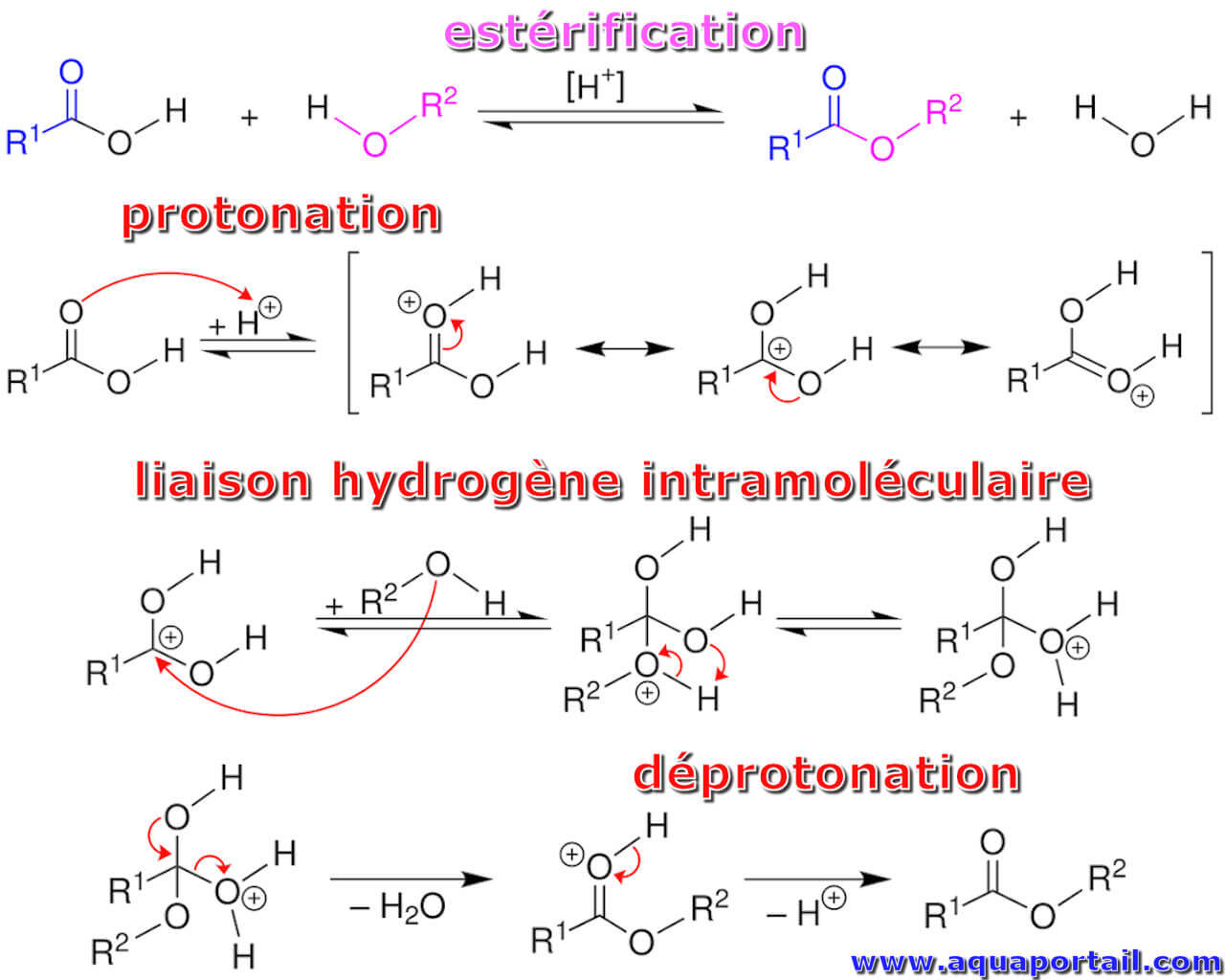
L'estérification est un processus par lequel un ester est synthétisé. Un ester est un composé formellement dérivé de la réaction chimique entre un acide...
