Acyle
Définition
Un acyle est un radical de formule générale –C(O)R, où R est un radical organyle (alkyle, aryle, etc.) dérivé d'un acide carboxylique. En chimie organique, un acyle désigne une fraction formée par un groupe carbonyle et une queue aliphatique. Le groupe acyle le plus connu est le groupe acétyle avec un groupe méthyle comme queue aliphatique.
Divers types d'acyles :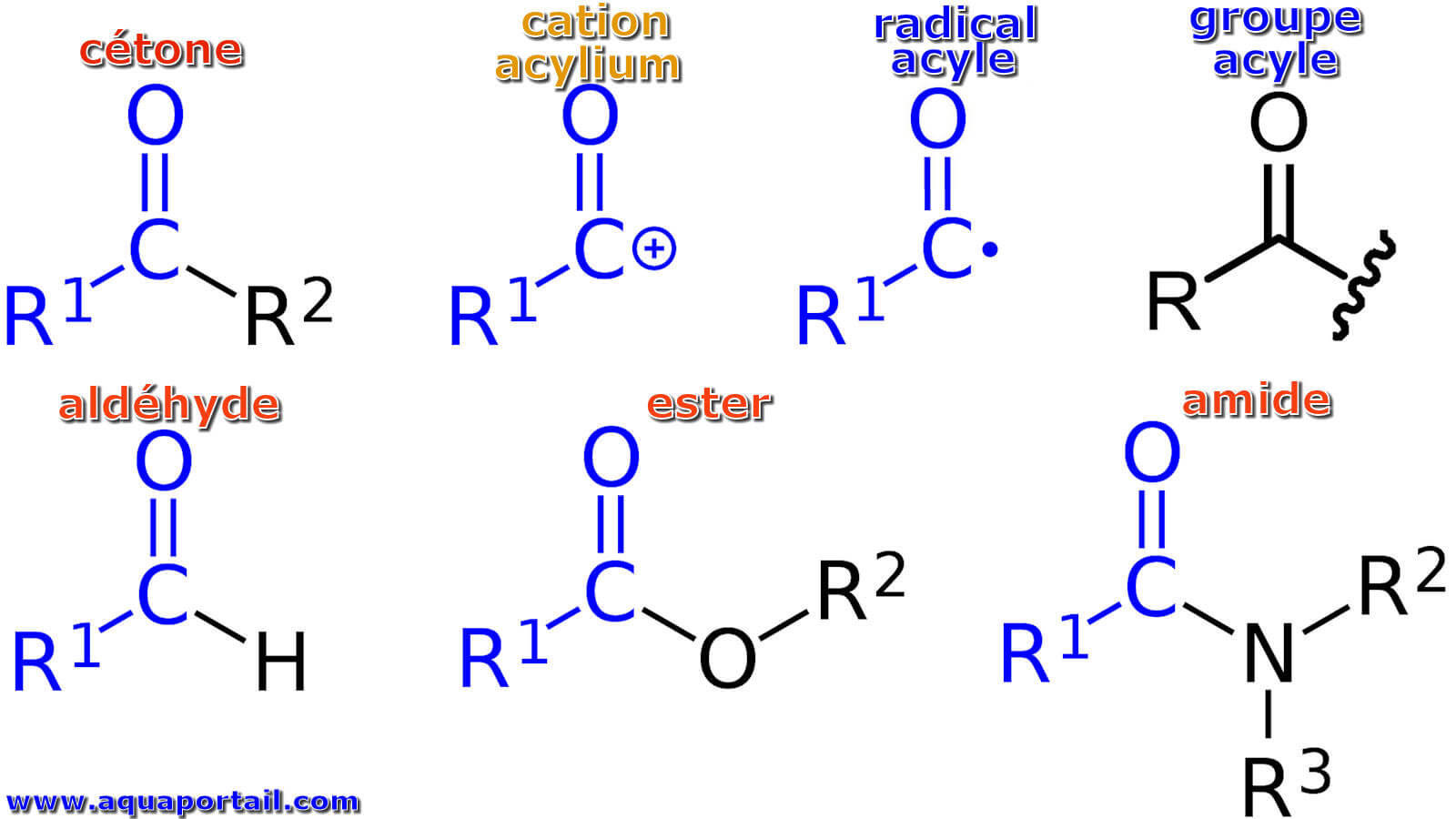
Divers composés d'acyle : cétone, cation acylium, radical acyle, groupe acyle, aldéhyde, ester et amide. Les groupements R1, R2, R3 sont des substituants organyle ou hydrogène.
Explications
Un groupe acyle est un groupe d'atomes constitué d'un groupe carbonyle lié à un groupe carboné. Un groupe acétyle est un groupe acyle dérivé de l'acide acétique.
Les groupes acyle transférés à la molécule accepteuse peuvent être divisés en acides aromatiques tels que les acides p-coumarique, caféique, férulique, sinapique, gallique ou p-hydroxybenzoïque, ou en acides aliphatiques tels que acide malonique, acide acétique, acide malique, acide succinique ou acide oxalique.
Un groupe acyle lié à un cycle benzénique peut être converti en un groupe alkyle par réduction avec un amalgame zinc-mercure dans HCl. Puisqu'un groupe acyle a un atome de carbone carbonyle directement attaché au cycle, il s'agit d'un substituant désactivant et méta-directeur. Cependant, un groupe alkyle est un groupe d'activation, ortho-directeur, para-directeur.
Carbanion, l'équivalent anion acyle
Réaction carbanion, équivalent anion acyle :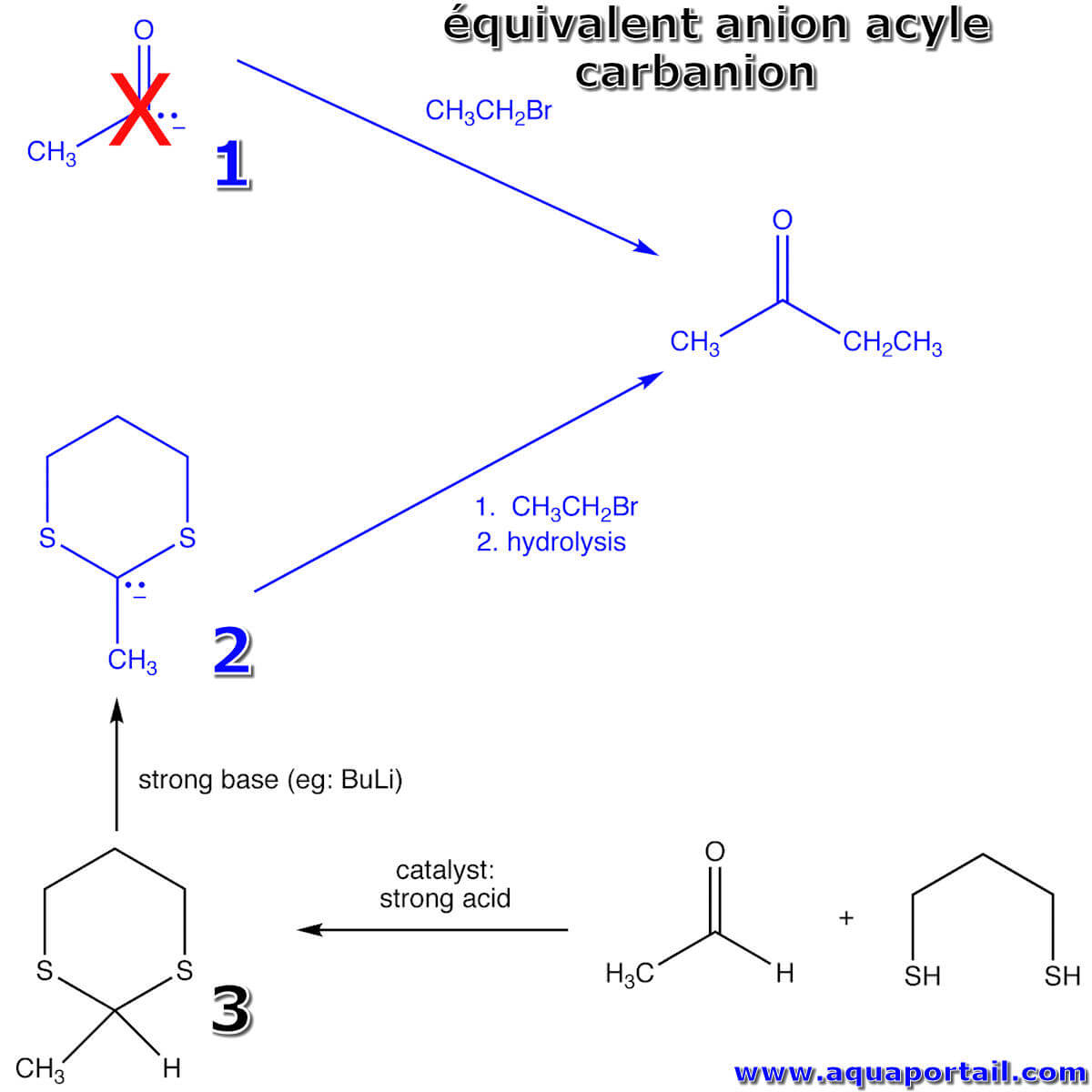
Un équivalent anion acyle est un carbanion qui fonctionne dans une réaction ou une séquence de réaction comme le ferait un anion acyle, qui n'est pas disponible à des fins de synthèse. Le carbanion 2, dérivé du 1,3-dithiane 3, est un équivalent de l'anion acyle 1, qui ne peut pas être généré de manière synthétiquement utile.
Halogénure d'acyle
Un halogénure d'acyle (également appelé halogénure d'acide) est un composé chimique dérivé d'un acide carboxylique en remplaçant un groupe hydroxyle par un halogène. La formule générale pour un tel halogénure d'acyle peut être écrite RCOX, où R peut être, par exemple, un groupe alkyle, CO est le groupe carbonyle et X représente l'halogénure, tel que le chlorure.
halogénure d'acyle :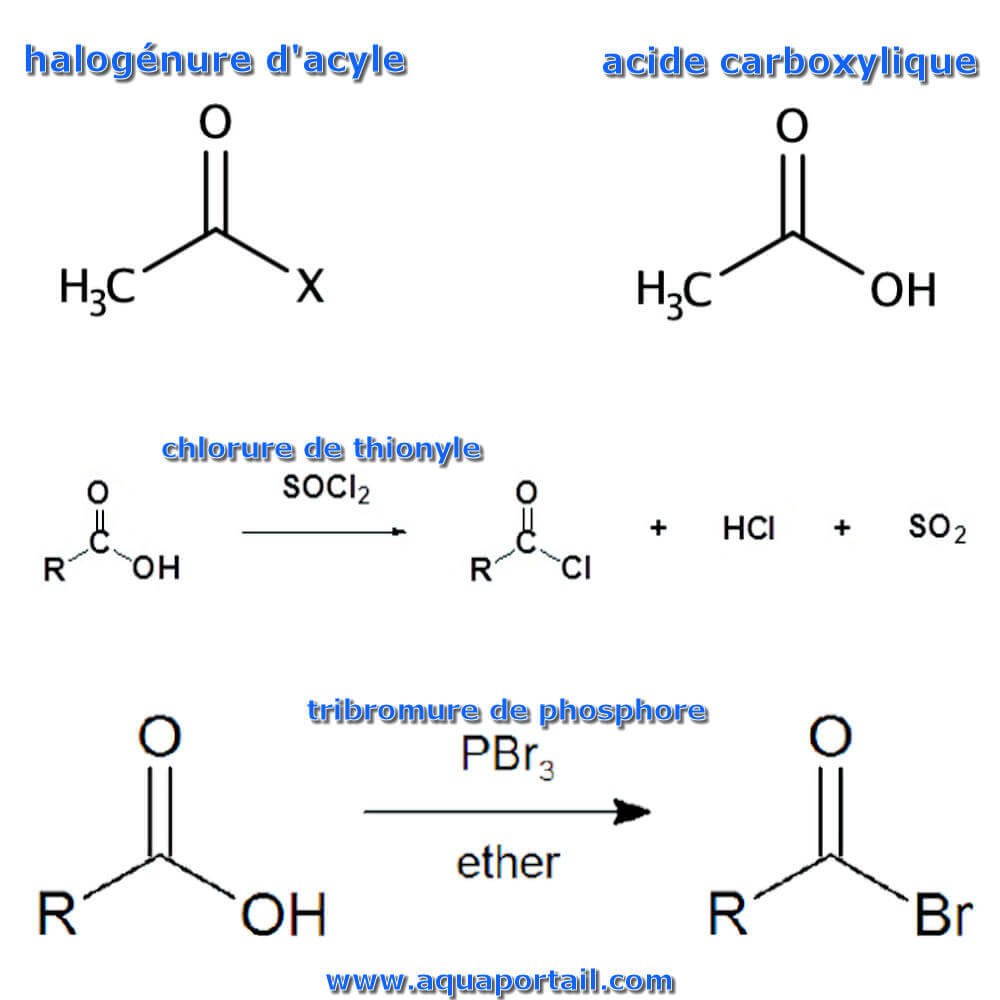
Si le groupe X dans un halogénure d'acyle est OH, il est appelé acide carboxylique.
Les acides carboxyliques réagissent avec le chlorure de thionyle (SOCl2) ou le chlorure d'oxalyle (C2O2Cl2) pour former des chlorures acides. Typiquement, les réactions interviennent en présence d'un capteur de protons comme la pyridine pour minimiser les réactions secondaires indésirables. Au cours de la réaction, le groupe hydroxyle de l'acide carboxylique est converti en un intermédiaire chlorosulfite, ce qui en fait un meilleur groupe partant. L'anion chlorure produit au cours de la réaction agit comme un nucléophile.
De manière analogue aux réactions des alcools primaires et secondaires avec le PBr3 pour produire le bromure d'alkyle correspondant, des bromures d'acide peuvent être formés à partir de la réaction du tribromure de phosphore avec des acides carboxyliques.
Les halogénures d'acide sont assez réactifs et donc très instables. Ils réagissent avec l'eau (même l'humidité) dans une réaction d'hydrolyse. Par exemple : l'hydrolyse du chlorure de butonyle. En raison de cette réaction, il est très important de travailler avec de la verrerie qui a été séchée, ainsi que des solvants exempts d'humidité. Les halogénures d'acyle volatils sont lacrymogènes car ils peuvent réagir avec l'eau à la surface de l'oeil en produisant des acides halohydriques et organiques irritants pour l'oeil. Des problèmes similaires peuvent survenir si l'on inhale des vapeurs d'halogénure d'acyle.
Chlorure d'acyle
Les chlorures d'acide réagissent avec les alcools pour former des esters. L'avantage d'utiliser des chlorures d'acyle au lieu d'acide carboxylique est que la réaction devient irréversible. Par exemple, la synthèse de benzoate d'éthyle à partir de chlorure de benzoyle et d'éthanol.
Un chlorure d'acyle (également appelé chlorure d'acide) est un composé organique constitué d'un atome de chlore lié à un cycle acyle. Typiquement, leur formulation est écrite R–C(O)Cl, où R est une chaîne latérale. Il existe un certain nombre de composés apparentés qui remplacent le groupe -OH dans l'acide par autre chose. De tels composés sont décrits comme des dérivés d'acide. Un exemple spécifique d'un chlorure d'acyle est le chlorure d'acétyle, CH3COCl. Le sous-ensemble le plus critique d'halogénures d'acyle sont les chlorures d'acyle.
Un chlorure d'acyle similaire au chlorure d'éthanoyle est un liquide fumant incolore. L'odeur forte du chlorure d'éthanol est un mélange d'odeur de vinaigre (acide éthanoïque) et d'odeur âcre de gaz de chlorure d'hydrogène. Les groupes fonctionnels sont des parties d'une molécule qui est considérée comme un groupe d'atomes liés reconnu. Lorsque la fraction chlorure d'acyle est prioritaire, les chlorures d'acyle sont nommés en prenant le nom de l'acide carboxylique parent et en substituant le chlorure d'-yle à l'acide -ique. Ainsi : chlorure d'acétyle = CH3COCl et chlorure de benzoyle = C6H5COCl.
Lorsque d'autres groupes fonctionnels sont prioritaires, les chlorures d'acyle sont considérés comme des préfixes chlorocarbonyle : (chlorocarbonyl) acide acétique ClOCCH2COOH.
L'aversion d'un chlorure d'acide à former des liaisons hydrogène avec d'autres composés est une propriété de. L'odeur et les gaz sont dus à l'interaction du chlorure d'éthanoyle dans l'air avec la vapeur d'eau. L'acide acétique, par exemple, bout à 118 °C, tandis que le chlorure d'acétyle bout à 51 °C. La spectroscopie infrarouge, comme la plupart des composés carbonylés, montre une bande proche de 1750 cm-1.
Une liaison hydrogène est une liaison chimique créée en attirant un atome d'hydrogène, dans une molécule, vers un atome électronégatif sur une autre molécule. Électronégatif, se réfère simplement à un atome qui aime attirer les électrons pour former une liaison chimique. Le chlorure d'éthanol ou le chlorure d'acétyle est le chlorure d'acyle le plus stable; Le chlorure de méthanol (chlorure de formyle) n'est pas stable à température ambiante, mais il peut être préparé à ou en dessous de -60 °C. Le chlorure d'acyle n'est pas soluble dans l'eau. Ensuite, il se décompose dans la boue.
On ne peut pas dire que les chlorures d'acyle se dissolvent dans l'eau, car ils réagissent avec elle (souvent violemment). La réaction forte signifie qu'une solution aqueuse simple d'un chlorure d'acyle ne peut pas être obtenue. Les chlorures d'acyle sont généralement préparés en laboratoire de la même manière que les chlorures d'alkyle, en remplaçant les substituants hydroxy correspondants par des chlorures. Les chlorures d'acyle sont très réactifs et l'atome de chlore est remplacé par d'autres éléments dans leurs réactions. Pour donner des alcools primaires, les chlorures d'acyle sont réduits avec de l'hydrure de lithium aluminium et de l'hydrure de diisobutylaluminium.
Phosphates d'acyle
Les phosphates d'acyle, parce qu'ils sont si réactifs vis-à-vis des substitutions d'acyle, sont généralement considérés comme des intermédiaires de réaction plutôt que comme des métabolites stables dans les voies biochimiques. Les phosphates d'acyle prennent généralement l'une des deux formes suivantes : un monophosphate d'acyle simple ou un monophosphate d'acyle-adénosine.
Phosphate d'acyle (monophosphate) et réactions :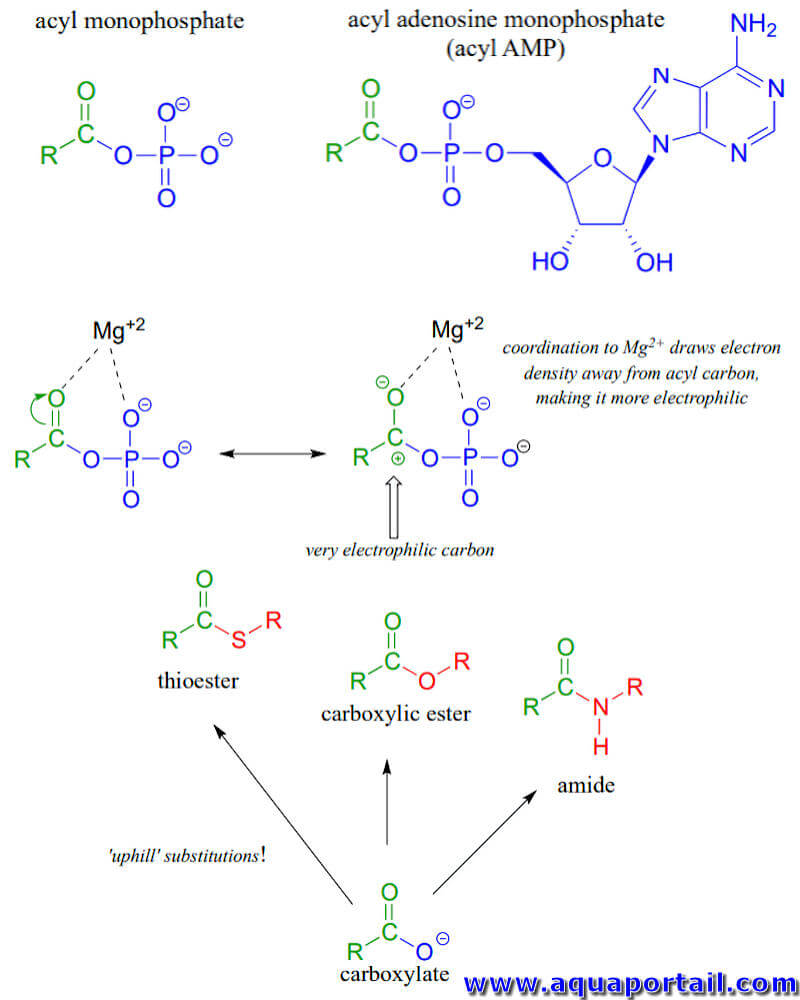
Les deux formes monophosphate d'acyle et acyle AMP ont très réactives aux réactions de substitution phosphate d'acyle et sont souvent appelées groupes acyle activés ou acides carboxyliques activés.
La tendance des phosphates à former des complexes stabilisants avec un ou plusieurs ions magnésium dans le site actif d'une enzyme contribue dans une large mesure à la réactivité des phosphates d'acyle.
Un ion magnésium agit comme un acide de Lewis, acceptant la densité électronique de l'extrémité oxygène de la liaison acyle carbonyle, ce qui augmente considérablement le degré de charge positive partielle - et donc l'électrophilie - du carbone carbonyle. L'ion magnésium équilibre également la charge négative sur le phosphate, ce qui en fait une base faible et un excellent groupe partant.
Le groupe fonctionnel carboxylate est le substrat le moins réactif pour les réactions de substitution d'acyle catalysées par une enzyme. En biologie, cependant, les carboxylates sont fréquemment transformés en thioesters, esters carboxyliques et amides, tous plus énergétiques, ce qui signifie que ces transformations sont thermodynamiquement "ascendantes".
Diacyle, alkylacyle et alcénylacyle
Un composé diacyle a deux groupes acyles.
La composition des phospholipides et les compositions des groupes acyle, alkyle et aryle des diacyle, alkylacyle et alcénylacyle phosphoglycérides de Meloidogyne javanica ont été étudiées. Le phospholipide était composé de 61,7 % de phosphoglycéride de choline, de 22,0 % de phosphoglycéride d'éthanolamine et de plus petites quantités de six autres lipides. L'acide gras phospholipidique était plus insaturé que l'acide gras lipidique neutre et contenait 61,3 % d'acide octadécénoïque (18 :1). L'acide gras en position 1 des diacyle-phospholipides était plus court et plus saturé que celui en position 2. Comparé au phosphoglycéride de choline, le phosphoglycéride d'éthanolantine contenait moins de 18 :1 et 20 :5 et plus d'acide 18 :0 et 20 :0.
Les composés alcénylacyle et alkylacyle comprenaient respectivement 34,6 % et 9,3 % du phosphoglycéride d'éthanolamine mais seulement 0,5 % et 0,6 % du phosphoglycéride de choline. Les phosphoglycérides d'alcénylacyle et d'alkylacyle éthanolamine contenaient un pourcentage plus faible d'acide polyinsaturé à 20 carbones en position 2 que leur analogue diacyle. Au moins 95 % des groupes aryles et alkyle étaient des composés 18 :0. Les racines de tomate ne contenaient pas d'alcénylacyle ou d'alkylacyle-phosphoglycérides; leur présence chez Meloidogyne javanica est une différence biochimique significative entre le nématode et son hôte.
Synonymes, antonymes
Voir tous les synonymes pour "acyle".0 synonyme (sens proche) pour "acyle".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ACYLE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ACYLE est dans la page 2 des mots en A du lexique du dictionnaire.
Mots en A à proximité
acutifolié acutilobé acyclique acyl-hydrolase acylation acyleacyluréead valoremadamantoblaste adaptabilité adaptateur
En rapport avec "acyle"

L'acétaldéhyde est un aldéhyde liquide volatil hydrosoluble incolore (C₂H₄O), obtenu par oxydation de l'éthanol et principalement utilisé en synthèse...
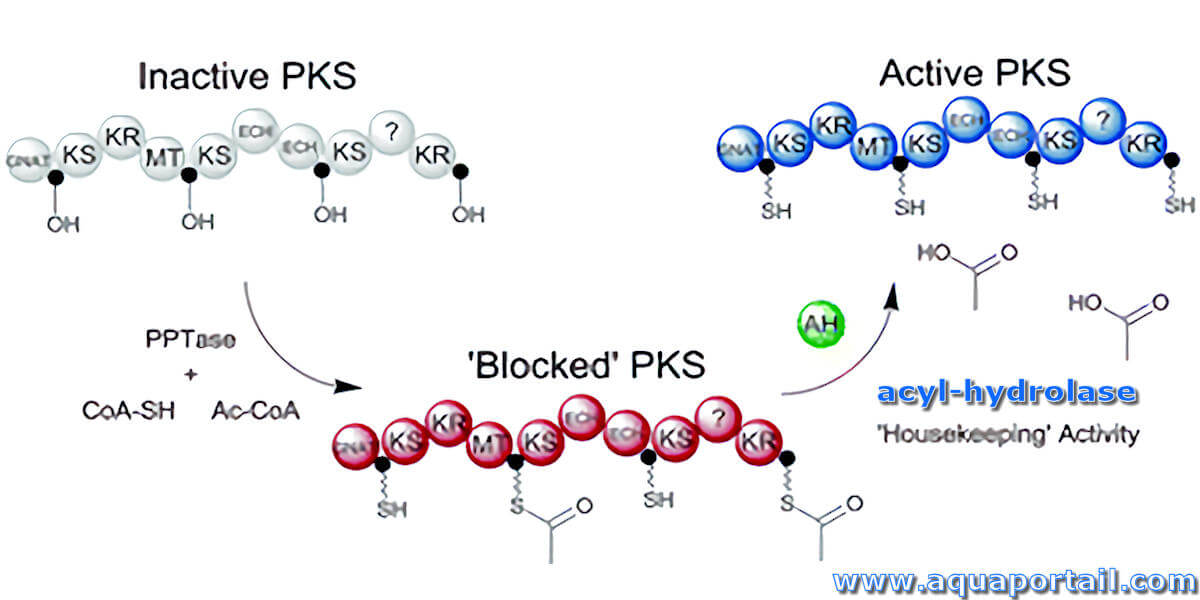
Une acyl-hydrolase est une enzyme de type hydrolase à radical (R-CO)- susceptible de dissoudre les molécules à liaison acyle en fixant de l'eau.

L'acylation est une réaction dans laquelle un groupe acyle est ajouté à une molécule. L'acylation est un moyen pratique de séparer les amines tertiaires d'un...

Un aldéhyde est un composé organique ayant un groupe fonctionnel terminal R–C(=O)H, formé par oxydation d'un alcool primaire (R-CH₂OH).
