Amidase
Définition
Une amidase est une enzyme qui catalyse l'hydrolyse de la liaison amide ou peptidique (-CO-NH-), une réaction chimique pour cliver les liaisons amides. Les amidases (ou amidohydrolases) forment une sous-famille d'hydrolases. Elles remplissent des fonctions importantes chez tous les êtres vivants.
L'hydrolyse d'une amidase et monomère de P. aeruginosa :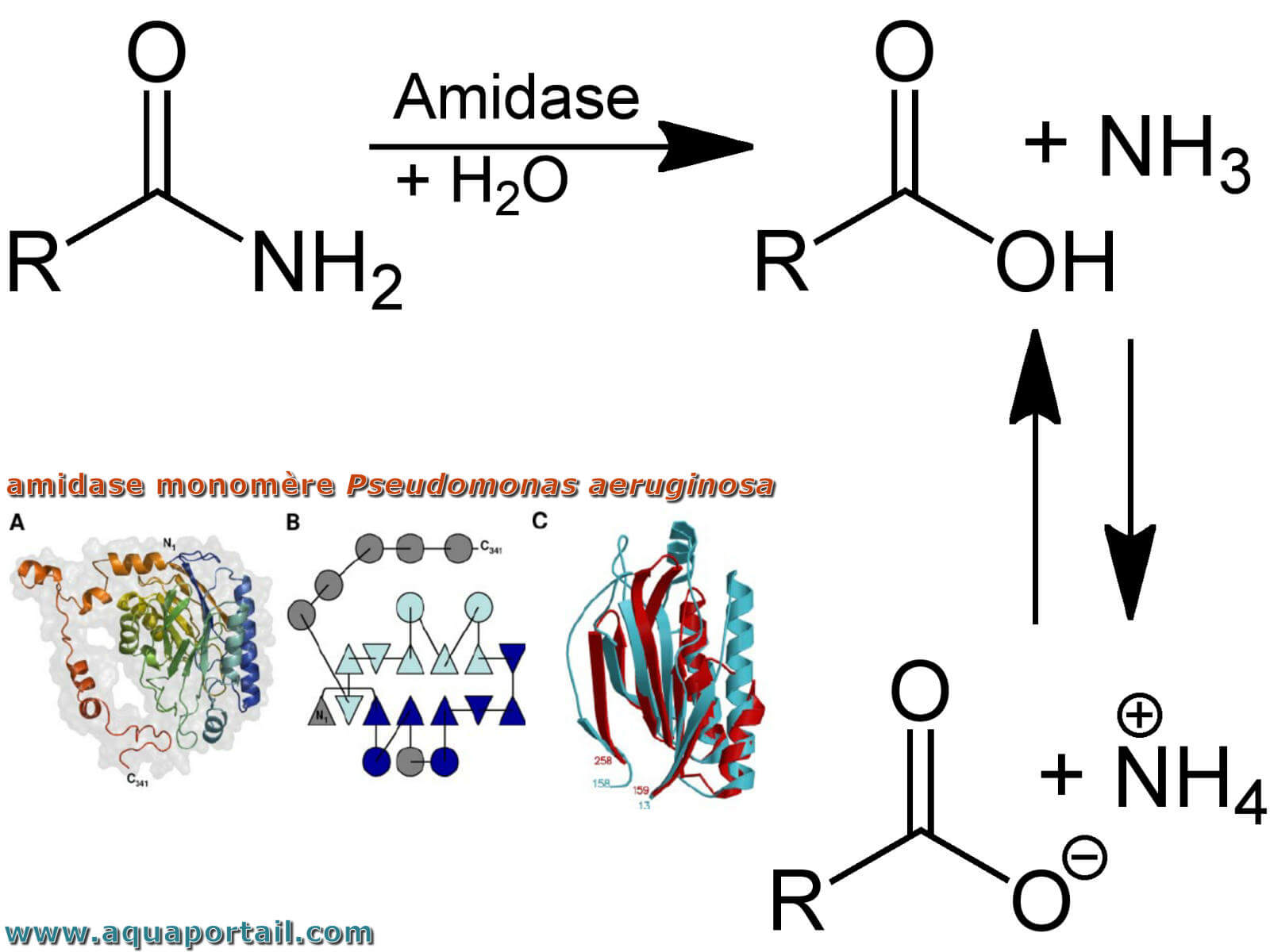
Outre l'hydrolyse d'un monomère d'amidase, la structure du monomère d'amidase donne une représentation schématique du monomère de Pseudomonas aeruginosa-amidase coloré du bleu (N-terminal) au rouge (C-terminal), avec l'enveloppe de la molécule en gris.
Explications
Les deux substrats de cette classe d'enzymes (les amidases) sont un amide monocarboxylique et de l'eau, tandis que leurs deux produits sont un monocarboxylate et de l'ammoniac. Les acylamides amidohydrolases agissent sur les liaisons carbone-azote autres que les liaisons peptidiques, et plus précisément celles qui agissent sur les amides linéaires.
Voies métaboliques
L'enzyme amidase participe à six voies métaboliques :
- le cycle de l'urée et le métabolisme des groupes amines;
- dans le métabolisme de la phénylalanine;
- dans le métabolisme du tryptophane;
- dans le métabolisme des cyanoaminoacides (aminoacides);
- dans la dégradation du benzoate par la voie de liaison la coenzyme acétyl-CoA;
- dans la dégradation du styrène.
Hydrolyse
Les amidases contiennent une séquence conservée d'environ 130 acides aminés (nombreux acides aminés), connue sous le nom de séquence AS. Ils sont largement distribués à la fois chez les procaryotes et les eucaryotes. Les enzymes AS catalysent l'hydrolyse d'une liaison amide (CO-NH2) bien que la famille ait largement divergé pour obtenir différentes spécificités de substrat et de fonction. Cependant, ces enzymes maintiennent un noyau structurel de type alpha/bêta/alpha; où les topologies des moitiés N et C terminales sont similaires.
Un amide d'acide monocarboxylique réagit avec l'eau sous l'influence d'une amidase pour former un acide monocarboxylique et de l'ammoniac ou le sel d'ammonium de l'acide monocarboxylique. Certains amides secondaires sont également hydrolysés par des amidases, mais cela montre la stabilité de la plupart des liaisons amides, qui ne peuvent pas être décomposées de cette manière. Dans le cas particulier d'une liaison peptidique, les enzymes de clivage sont appelées peptidases, qui n'appartiennent formellement plus aux amidases, mais représentent plutôt la catégorie d'enzymes 3.4. Les liaisons amides cycliques, par exemple dans les lactames, sont décomposées par les lactamases, qui appartiennent également aux amidases.
Les enzymes AS possèdent typiquement une région C-terminale hautement conservée, riche en sérine et glycine; mais manquant d'acide aspartique et d'histidine; raison pour laquelle ils diffèrent des hydrolases à sérine classiques. Ces enzymes ont une séquence unique et hautement conservée, dans laquelle se distingue la triade catalytique Ser-Ser-Lys utilisée pour l'hydrolyse des amides, bien que le mécanisme catalytique pour les intermédiaires de la réaction acyl-enzymatique puisse différer entre différentes enzymes.
Exemples
Plusieurs dizaines d'amidases ont été identifiées chez l'homme qui remplissent toutes les fonctions importantes, notamment les céramidases, les histone désacétylases et les sirtuines. D'autres enzymes individuelles importantes de ce groupe sont l'arylformamidase, la biotinidase, la glutaminase et la pantéthénase.
Quelques exemples d'enzymes qui contiennent la signature AS :
- Amidase peptide (Pam) : qui catalyse l'hydrolyse des liaisons amides C-terminales des peptides.
- Les hydrolases d'amides d'acides gras, qui hydrolysent les amides d'acides gras (par exemple, l'anandamide cannabinoïde et les oléamides induisant le sommeil), contrôlant ainsi les niveaux et la durée de la régulation de l'expression des gènes médiée par diverses classes de transmetteurs lipidiques.
- Malonamidase E2 : qui catalyse l'hydrolyse du malonamate en malonate et en ammoniac, et qui est impliquée dans le transport de l'azote fixe des bactérioïdes aux cellules végétales dans le métabolisme symbiotique de l'azote.
- Glu-ARNt (Gln) amidotransférase A subunit : une enzyme hétérotrimérique qui catalyse la formation de Gln-tRNA (Gln) par transamidation de Glu-tRNA (Gln) via l'amidolyse de la glutamine.
Synonymes, antonymes
Voir tous les synonymes pour "amidase".2 synonymes (sens proche) de "amidase" :
- acylamide amidohydrolase
- amidohydrolase
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à AMIDASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot AMIDASE est dans la page 5 des mots en A du lexique du dictionnaire.
Mots en A à proximité
amiboflagellé amiboïde amiboïsme amibozoaire amictique amidaseamide amidon amidon floridéen amidon intraplastidial amination
En rapport avec "amidase"
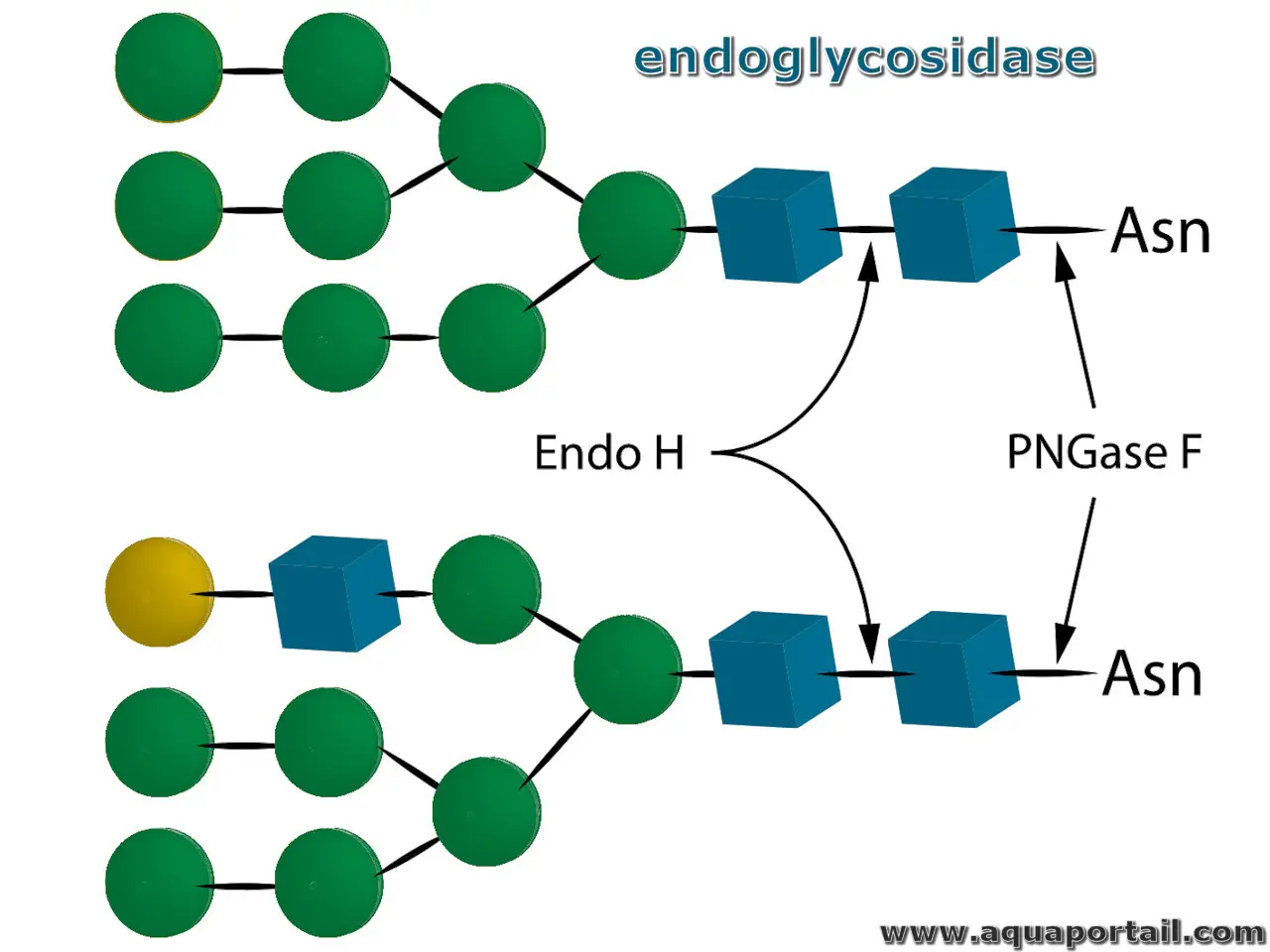
Une endoglycosidase est une enzyme qui catalyse l'hydrolyse d'une chaîne polyosidique en rompant les liaisons à l'intérieur de la chaîne.

Une galactosidase qualifie une enzyme, de type lactase, qui catalyse l'hydrolyse des galactosides.
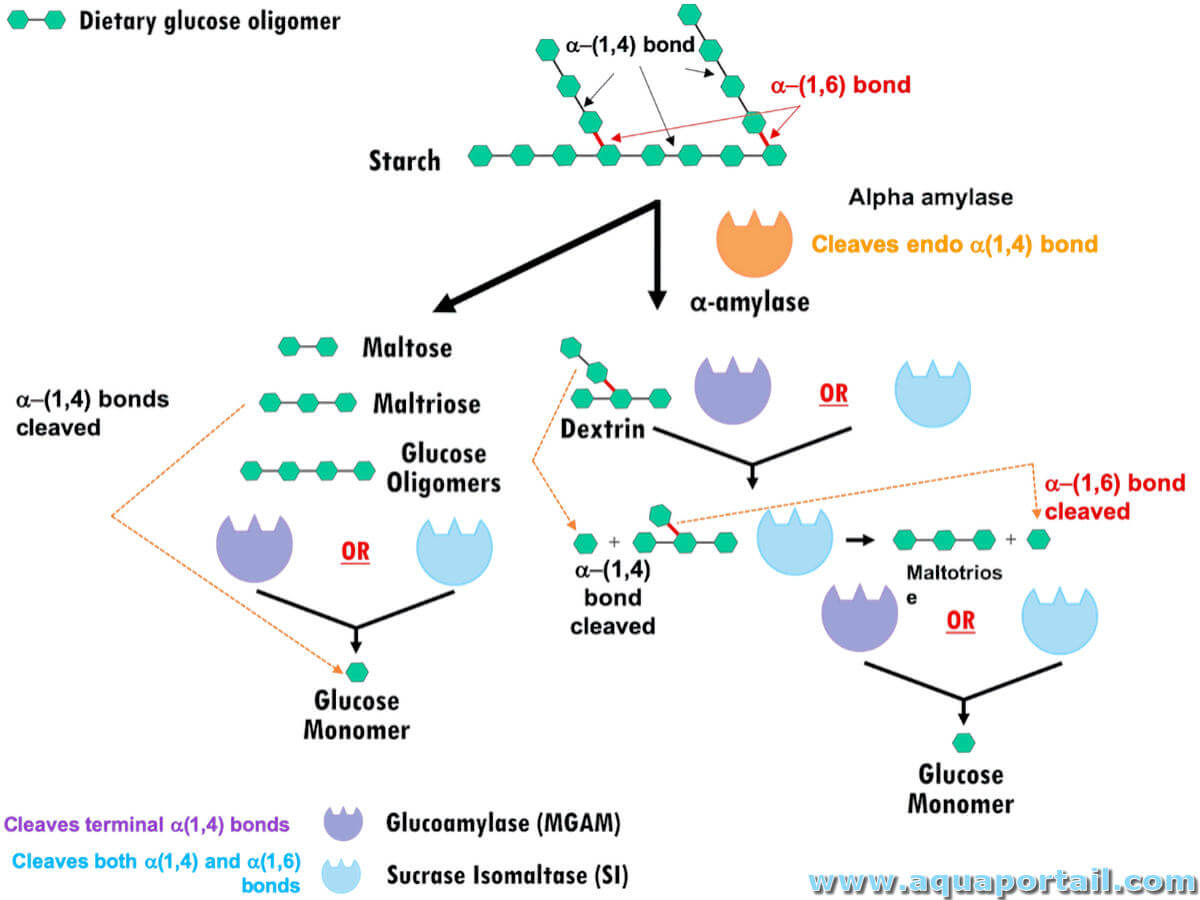
La glucosidase est une protéine spécifique des lysosomes dans une seule cellule vivante. Les β-glucosidases sont des membres importants de la grande classe...
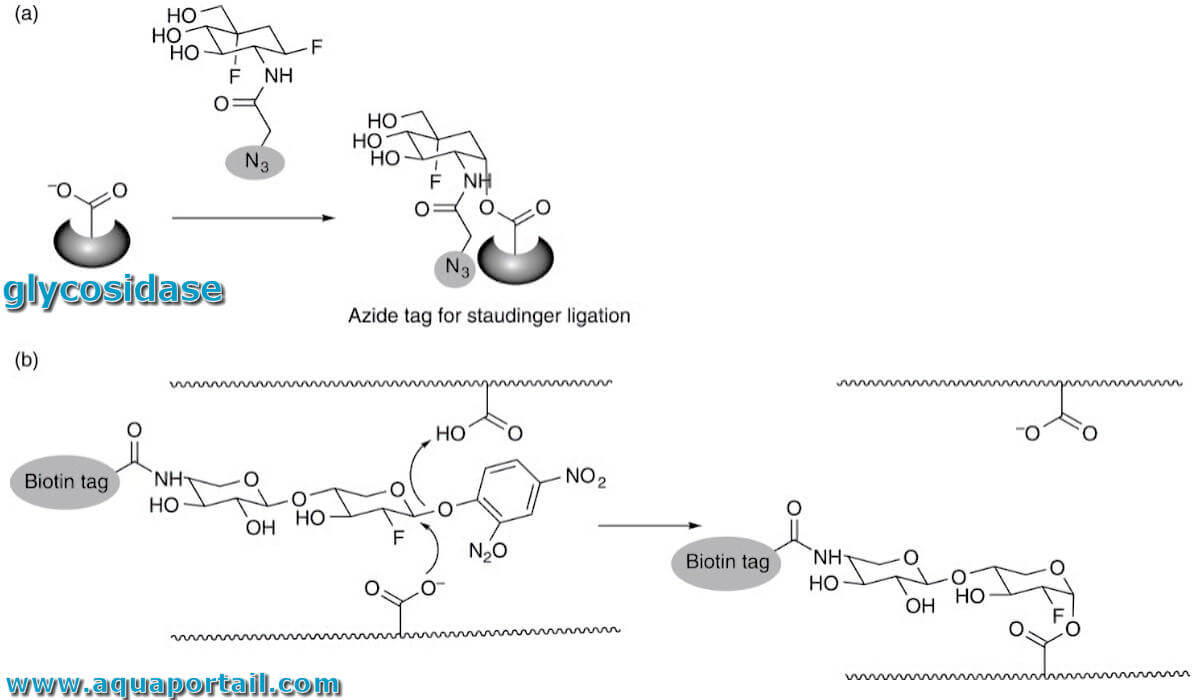
Une glycosidase est une enzyme dédiée à la dégradation des glucides complexes par clivage des liaisons glycosidiques.
