Trioxyde de soufre
Définition
Le trioxyde de soufre (SO3, anhydride sulfurique) est un solide cristallin incolore à blanc qui fond dès 16,9 °C. La vapeur de trioxyde de soufre est particulièrement hygroscopique et au contact de l'eau elle forme de l'acide sulfurique. Les solutions de trioxyde de soufre dans l'acide sulfurique sont également appelées oléum ou acide sulfurique fumant.
Le trioxyde de soufre est plus réactif que l'acide sulfurique ou ses dérivés. Il est souvent utilisé pour la sulfonation aromatique, en particulier lorsqu'il est modifié comme ses adduits avec du dioxane ou de la pyridine.
Structure de Lewis du trioxyde de soufre SO3 :
SO3 (trioxyde de soufre) a un atome de soufre et trois atomes d'oxygène. Dans la structure de Lewis de SO3, il y a trois doubles liaisons autour de l'atome de soufre, avec trois atomes d'oxygène qui lui sont attachés, et sur chaque atome d'oxygène, il y a deux paires isolées.
Explications
Le trioxyde de soufre est un composé inorganique de formule chimique SO3. Dans sa forme pure, c'est un solide incolore qui existe sous trois modifications ou allotropes :
- La forme γ a une structure moléculaire et un point de fusion de 16,8 °C et une haute pression de vapeur libre de 433 mmHg à 25 °C. Le point d'ébullition n'est que de 44,8 °C.
- La forme β a la structure d'un polymère à chaînes linéaires. La substance fond à 32,5 °C et à une pression de vapeur légèrement inférieure de 344 mmHg à 25 °C.
- La forme α a une structure en réseau. Il fond à 62 °C et a une faible pression de vapeur de 73 mmHg à 25 °C.
Le trioxyde de soufre est à la fois un acide de Lewis fort et un oxydant puissant. Il est également utilisé dans les bombes fumigènes. Une goutte de SO3 liquide suffit à envelopper complètement une pièce de fumée.
Préparation
Le trioxyde de soufre peut être préparé en petites quantités en laboratoire dans un procédé en deux étapes par la pyrolyse du bisulfate de sodium. Le pyrosulfate de sodium est un produit intermédiaire et se forme par déshydratation à 315 °C.
À l'échelle industrielle, la substance est préparée selon le procédé de contact. Le dioxyde de soufre est généralement obtenu par grillage de la pyrite (FeS2). Le SO2 purifié est ensuite oxydé davantage avec de l'oxygène atmosphérique à 400 à 600 °C en utilisant un catalyseur au pentoxyde de vanadium activé avec de l'oxyde de potassium supporté sur de la terre de diatomées ou de la silice. Le platine fonctionne également, mais est nettement plus cher et est plus sujet aux symptômes d'empoisonnement dus aux impuretés présentes dans le SO2 gazeux.
La plus grande partie du trioxyde de soufre ainsi obtenu est convertie en acide sulfurique. Cependant, cela ne se fait pas en ajoutant directement de l'eau, car cela créerait un aérosol dangereux de gouttelettes d'acide sulfurique. Au lieu de cela, l'oxyde dans l'acide sulfurique lui-même est dissous pour former de l'oléum qui à son tour est dilué avec de l'eau pour former plus d'acide sulfurique.
Toxicité
Le trioxyde de soufre SO3 est un solide cristallin incolore à blanc qui fume dans l'air. Aussi, il est souvent livré avec un inhibiteur pour empêcher la polymérisation. Il réagit violemment avec l'eau pour former de l'acide sulfurique avec dégagement de chaleur.
Il est dangereux de chauffer la forme alpha au-dessus de son point de fusion car la structure du réseau se décompose en structure moléculaire. Cependant, la phase gamma a une pression de vapeur de quelques atmosphères au-dessus de 62 °C et peut provoquer des explosions.
Il est corrosif pour les métaux et les tissus. Il provoque des brûlures aux yeux et à la peau. L'ingestion provoque de graves brûlures de la bouche, de l'oesophage et de l'estomac. La vapeur est très toxique par inhalation. Lorsqu'il est inhalé, de l'acide sulfurique se forme dans les poumons et cela peut avoir des conséquences graves (notamment un oedème pulmonaire).
Il est un risque d'incendie lorsqu'il est en contact avec des matériaux organiques tels que le bois, le coton, les panneaux de fibres, etc.
Les solutions de trioxyde de soufre dans l'acide sulfurique doivent être manipulés avec beaucoup de précautions car ils sont particulièrement corrosifs. La fumée qu'ils dégagent aggrave le problème. Cette fumée est en fait un aérosol de minuscules gouttelettes d'acide sulfurique.
Structure chimique de Lewis
Dans le tableau périodique, le soufre et l'oxygène appartiennent au groupe 16. Par conséquent, le soufre et l'oxygène ont six électrons de valence. Puisque SO3 a un atome de soufre et trois atomes d'oxygène, donc :
- électrons de valence d'un atome de soufre = 6 × 1 = 6;
- électrons de valence de trois atomes d'oxygène = 6 × 3 = 18.
Et le total des électrons de valence du trioxyde de soufre SO3 = 6 + 18 = 24.
Synonymes, antonymes
Voir tous les synonymes pour "trioxyde de soufre".2 synonymes (sens proche) de "trioxyde de soufre" :
- anhydride sulfurique
- SO3
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à TRIOXYDE DE SOUFRE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression TRIOXYDE DE SOUFRE est dans la page 4 des mots en T du lexique du dictionnaire.
Mots en T à proximité
trimonoïque trimorphe trioïque triops Triopsidés trioxyde de soufretripartite tripeptide triple liaison triploblastique triploïde
En rapport avec "trioxyde de soufre"
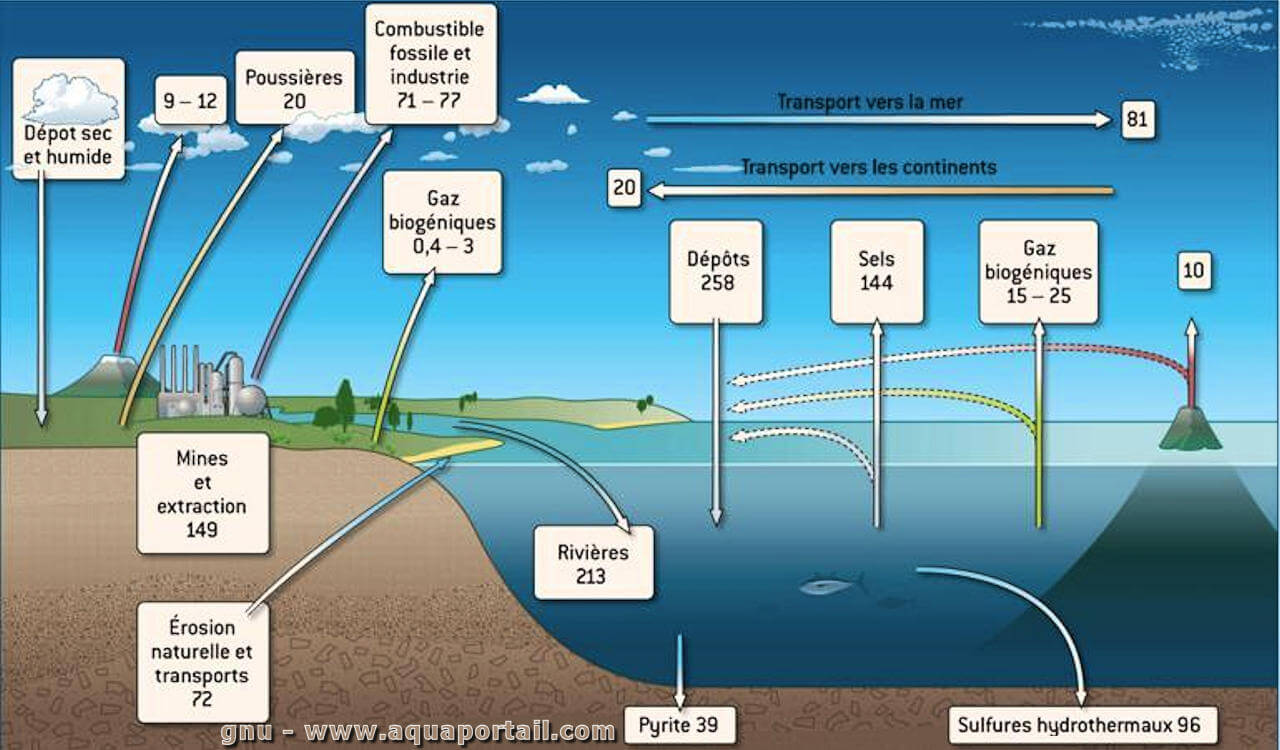
Le cycle du soufre est l'ensemble des processus par lesquels le soufre se déplace vers les minéraux et les systèmes vivants.

Le dioxyde de soufre, ou l'anhydride sulfureux, est un oxyde dont la formule moléculaire est SO₂.

Le soufre (S, numéro atomique 16) est un élément chimique non-métal qui existe dans la nature et peut être trouvé dans le sol, les plantes, les aliments...

Le molly soufre Poecilia sulphuraria, connu localement sous le nom vernaculaire de Molly del Teapa, est une espèce de poisson poécilidé comme le molly...
