Dioxyde de soufre
Définition
Le dioxyde de soufre, ou l'anhydride sulfureux, est un oxyde dont la formule moléculaire est SO2. C'est un gaz incolore irritant pour les muqueuses, avec une odeur caractéristique, qui sent mauvais et a un goût amer. Cette substance réductrice devient, avec le temps, et en contact avec l'air et l'humidité, du trioxyde de soufre. La vitesse de cette réaction dans des conditions normales est faible.
Molécule du dioxyde de soufre :
Dans l'eau, le dioxyde de soufre se dissout pour former une solution acide. Il peut être conçu comme l'anhydride d'un (hypothétique) acide sulfureux H2SO3, ceci par analogie avec ce qui se passe avec l'acide carbonique pour le dioxyde de carbone. L'anhydride sulfureux est instable dans les solutions acides mais forme des sels, des sulfites et des hydrogénosulfites.
Explications
Le dioxyde de soufre est très soluble (physiquement) dans l'eau pure et forme très peu d'acide sulfurique avec l'eau. Entre autres choses, il est produit par la combustion de combustibles fossiles contenant du soufre, tels que le charbon ou les produits pétroliers, qui contiennent jusqu'à 4 % de soufre.
En conséquence, il contribue de manière significative à la pollution atmosphérique. C'est la cause des pluies acides, où le dioxyde de soufre est d'abord oxydé par l'oxygène en trioxyde de soufre, puis réagit avec de l'eau pour former de l'acide sulfurique H2SO4.
Pour empêcher l'entrée de dioxyde de soufre, il existe différentes méthodes de désulfuration des gaz de combustion. En outre, le dioxyde de soufre se trouve dans l'environnement des zones à haute température et des volcans actifs.
Dans l'industrie alimentaire, le dioxyde de soufre est utilisé comme agent de conservation, antioxydant et désinfectant, en particulier pour les fruits séchés, les plats de pommes de terre, les jus de fruits, les confitures et le vin. Les fûts de vin et de bière sont désinfectés avant d'être utilisés par traitement au SO2.
Production
Le dioxyde de soufre peut être produit (surtout par combustion) par différentes méthodes :
- en brûlant du soufre ou de l'hydrogène sulfuré;
- en grillant des minerais sulfidiques (minéraux sulfurés), tels que la pyrite FeS, la wurtzite ou la blende ZnS, la galène PbS, la calcantite CuSO4 et la cinabre HgS;
- à partir de sulfites par des acides plus forts;
- Par réaction d'acide sulfurique avec du cuivre élémentaire.
Propriétés
Le dioxyde de soufre est un gaz piquant et incolore. À une pression de 3,3 bars, il se liquéfie à la température ambiante. Il a une bonne solubilité dans l'eau, les solutions sont légèrement acides. Le dioxyde de soufre est stabilisé mésomériquement (par mésomérie).
Aspects toxicologiques
Le dioxyde de soufre est un gaz irritant et toxique. Il affecte principalement le mucus et les poumons provoquant des quintes de toux. Bien que cela soit absorbé principalement par le système nasal, l'exposition à des concentrations élevées pendant de courtes périodes de temps peut irriter les voies respiratoires, provoquer une bronchite et encombrer les voies bronchiques des asthmatiques.
La concentration maximale autorisée sur le lieu de travail est de 2 ppm.
Les valeurs recherchées sont :
- La valeur IDLH (Dangerous for Life);
- Valeur létale 100 ppm (262 mg/m3);
- Seuil olfactif de 0,5 ppm (1 mg / m³) (détecté par l'odeur humaine).
Consignes de sécurité
Des concentrations de dioxyde de soufre supérieures à la valeur MAK peuvent provoquer des maux de tête, des nausées et des vertiges chez l'homme. À des concentrations plus élevées, le gaz endommage gravement les bronches et les poumons.
Une exposition à de fortes concentrations de dioxyde de soufre sur une période prolongée peut entraîner une anémie en détruisant la vitamine B12, essentielle à la formation du sang.
Réactions
L'oxydation du dioxyde de soufre en trioxyde de soufre en présence d'oxygène est une réaction qui intervient spontanément très lentement en raison de son énergie d'activation élevée. 8 Pour accélérer la réaction, on utilise des catalyseurs tels que le pentoxyde de vanadium V2O5 ou le platine qui permettent l'oxydation du gaz lorsqu'un contact avec le catalyseur solide intervient.
Auparavant, un mélange d'oxydes d'azote gazeux était utilisé comme catalyseur. L'oxydation à médiation par un catalyseur est utilisée dans la fabrication industrielle d'acide sulfurique.
L'oxydation du dioxyde de soufre en trioxyde de soufre peut également survenir par la réaction avec l'ozone. La réaction intervient spontanément dans les couches supérieures de l'atmosphère. Le trioxyde de soufre, lorsqu'il réagit avec l'eau présente dans les nuages, produit de l'acide sulfurique, qui abaisse le pH de l'eau et précipite sous forme de pluie acide.
La réaction de l'anhydride sulfureux avec de l'hydroxyde de sodium produit du sulfite de sodium.
La réduction du dioxyde de soufre peut exister en présence de réducteurs tels que le sulfure d'hydrogène, en obtenant du soufre élémentaire et de l'eau.
Utilisations
Le dioxyde de soufre a des propriétés désinfectantes, raison pour laquelle il a été utilisé pendant des siècles pour la désinfection, par exemple des cuves de vin brûlant du soufre à l'intérieur. Il est également utilisé dans l'industrie alimentaire comme agent de conservation et antioxydant (E220) généralement dans les jus, les noix, les confitures, le vin, etc.
C'est un intermédiaire dans la fabrication de l'acide sulfurique. La réaction avec le chlore produit du chlorure de sulfuryle SO2Cl2, intermédiaire important dans l'industrie chimique.
Si on le fait réagir avec du chlore et des composés organiques, des chlorosulfonates peuvent être obtenus dans une réaction de chlorosulfonation directe en tant que précurseurs de détergents et d'autres substances. À l'état liquide, c'est un bon solvant.
Le dioxyde de soufre est un réducteur utilisé dans la purification de l'eau, qui aide à éliminer les métaux lourds tels que le chrome hexavalent, le mercure et le plomb.
Le dioxyde de soufre détruit la vitamine B1; de même, les tests de laboratoire montrent des preuves de la destruction des vitamines B12. Dans l'UE, il est également approuvé comme additif alimentaire numéro E220 pour les produits "biologiques". Dans la sulfochloration, il sert à la production de tensioactifs.
En outre, le dioxyde de soufre est un réactif important pour la production de trioxyde de soufre, suivi de l'acide sulfurique concentré, avec la méthode de contact.
Le dioxyde de soufre est également utilisé dans la fabrication de nombreux produits chimiques, médicaments et colorants, ainsi que dans le blanchiment du papier et des textiles. Cela fait disparaître l'encre.
En outre, il est utilisé comme gaz protecteur, par exemple, pour empêcher l'oxydation du métal en fusion dans une fonderie.
Utilisation dans les camps de concentration
Lors d'expériences sur les gaz toxiques menées dans le camp de concentration croate Stara Gradiska, du Zyklon B ainsi que du dioxyde de soufre ont été utilisés pour tuer les femmes et les enfants serbes, juifs et roms.
Stockage
Le dioxyde de soufre est généralement obtenu dans l'industrie à partir de bouteilles de gaz comprimé et est souvent stocké pour le contrôle de la température dans l'environnement de production, c'est-à-dire à l'intérieur, souvent juste à côté des installations de traitement thermique.
Dans le cadre de l'évaluation des risques, le stockage du dioxyde de soufre est réglementé, conformément aux lois sur la santé et la sécurité au travail. Il doit être déterminé si le stockage de substances dangereuses peut mettre en danger les employés ou d'autres personnes.
Pour protéger la santé des employés et satisfaire aux exigences de la loi sur la santé et la sécurité au travail, les bouteilles de dioxyde de soufre doivent donc être stockées dans un lieu de stockage approprié. À cet effet, l'armoire à bouteilles de gaz de sécurité équipée en conséquence, dont l'équipement spécial pour le stockage du dioxyde de soufre comprend les composants essentiels suivants :
- L'enceinte de sécurité elle-même, pour une ou plusieurs bouteilles de dioxyde de soufre et une bouteille d'azote. Souvent, deux bouteilles d'anhydride sulfureux sont fournies pour le fonctionnement et la commutation automatique. Une bouteille est dans l'armoire pour le préchauffage. À partir de la deuxième bouteille, le gaz est retiré pour être utilisé. La bouteille d'azote sert à alimenter le dispositif de rinçage pour un changement de bouteille en toute sécurité. L'enceinte de sécurité est conçue comme une enceinte ignifuge, car le gaz sous pression peut exploser lorsqu'il est chauffé, provoquant des brûlures de la peau et des lésions oculaires graves. L'armoire doit pouvoir être verrouillée car la fiche de données de sécurité du dioxyde de soufre indique P405 - Stocker sous clef.
- Station de contrôle de la pression du dioxyde de soufre en acier inoxydable à commutation automatique, pour une alimentation en fluide ininterrompue. Les bouteilles de dioxyde de soufre sont reliées à un tuyau ondulé en acier inoxydable. Les raccords utilisés doivent être en acier inoxydable, car le dioxyde de soufre est converti avec l'humidité atmosphérique en acide sulfurique.
- Une électrovanne d'arrêt automatique permet d'arrêter la conduite de traitement du dioxyde de soufre jusqu'au point d'utilisation pour l'activation de l'arrêt d'urgence ou l'avertisseur de gaz.
- Le détecteur de gaz détecté dans l'enceinte de sécurité, avec éventuellement des détecteurs de détection de gaz supplémentaires à proximité des points d'utilisation, génère l'alarme de gaz avec signal optique et acoustique.
- Ventilation forcée avec ventilateur pour un fonctionnement manuel par l'utilisateur et déclenchement automatique lorsque le détecteur de gaz est déclenché. La sortie de ventilation est principalement raccordée à un système de ventilation, de sorte que les gaz ne s'échappent pas dans l'environnement de production.
Grâce à cet équipement spécial de l'armoire à dioxyde de soufre, les employés sont protégés en toute sécurité contre le risque de concentration élevée de dioxyde de soufre dans l'air respiratoire et contre les brûlures corrosives lors d'accidents.
Aspects environnementaux
Le dioxyde de soufre est la principale cause des pluies acides, car il se transforme dans l'atmosphère en acide sulfurique.
Il est libéré dans de nombreux processus de combustion car les carburants tels que le charbon, le mazout, le diesel ou le gaz naturel contiennent certaines quantités de composés soufrés. Pour ces raisons, on cherche à éliminer ces composés avant leur combustion, par exemple par hydrodésulfuration en produits pétroliers ou par lavage du gaz naturel le rendant "doux".
Si, malgré ces efforts, des quantités importantes de gaz sont encore générées, des lavages de base peuvent être appliqués p. ex. avec du lait de chaux pour le retenir de l'air évacué ou le transformer en même temps que le sulfure d'hydrogène en soufre élémentaire (procédé Claus).
Les procédés métallurgiques libèrent également certaines quantités de ce gaz car les métaux sont fréquemment utilisés sous forme de sulfures. Dans la nature, le dioxyde de soufre se trouve principalement à proximité des volcans et les éruptions peuvent dégager des quantités importantes.
Le monoxyde de carbone, le dioxyde d'azote, l'ozone, le plomb et l'hydrogène sulfuré sont d'autres éléments susceptibles de causer la pollution de l'air dans les villes.
Le dioxyde de soufre est utilisé à des fins très diverses, par exemple en tant qu'agent réducteur dans la métallurgie, en tant que réfrigérant dans l'industrie du froid, en tant que désinfectant et agent de blanchiment, pour la conservation des substances alimentaires, en tant que décolorant et fumigant pour la fumigation. Le dioxyde de soufre est l'un des composés les plus importants de l'industrie chimique. 98 % du SO2 technique est utilisé pour la production de trioxyde de soufre en tant que précurseur de l'acide sulfurique.
Pollution
Le dioxyde de soufre endommage les humains, les animaux et les plantes à des concentrations élevées. Les produits d'oxydation conduisent à des " pluies acides ", qui mettent en danger des écosystèmes sensibles tels que les forêts et les lacs et attaquent les bâtiments et les matériaux. Cela inclut l'affaiblissement des plantes forestières qui, après des hivers exceptionnels, sont plus endommagées par le gel que les plantes comparables dans des zones moins polluées.
Cependant, les émissions de SO2 des pays industrialisés développés ont été considérablement réduites au cours des deux dernières décennies grâce à l'utilisation de combustibles à faible teneur en soufre ou sans soufre et à la désulfuration des gaz de combustion.
Parmi tous les modes de transport, le transport maritime international est celui qui contribue le plus aux émissions. La teneur maximale en soufre autorisée dans le carburant pour les navires est actuellement de 4,5 %. Toutefois, l'OMI a abaissé le seuil : il devrait être abaissé à 3,5 % d'ici 2012 et à 0,5 % d'ici 2020. Cette limite s'applique déjà aux eaux côtières de la Californie. Il existe des zones de contrôle des émissions de soufre (SECA) en mer Baltique et en mer du Nord, où la limite actuelle est de 1,5 %. À compter du er juillet 2010, il est de 1 % et depuis le er janvier 2015, il est abaissé à 0,1 %.
Dans une étude, l'Institut Max Planck de météorologie a montré qu'il existait une couverture nuageuse beaucoup plus dense à proximité des ports très fréquentés de Rotterdam, d'Anvers et de Milford Haven que dans les zones environnantes. Le dioxyde de soufre et les oxydes d'azote agissent comme des noyaux de condensation et stimulent la formation de nuages. L'albédo renforcé par cette couverture nuageuse réduit le rayonnement solaire dans les zones sous-jacentes.
Le dioxyde de soufre peut également contribuer à assombrir l'atmosphère au niveau mondial en augmentant la teneur en aérosol, par exemple après de fortes éruptions volcaniques.
Synonymes, antonymes
Voir tous les synonymes pour "dioxyde de soufre".3 synonymes (sens proche) de "dioxyde de soufre" :
- anhydride sulfureux
- dioxyde soufré
- SO2
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à DIOXYDE DE SOUFRE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression DIOXYDE DE SOUFRE est dans la page 3 des mots en D du lexique du dictionnaire.
Mots en D à proximité
dioïque diorite dioxyde dioxyde de carbone dioxyde de silicium dioxyde de soufredioxygénase dioxygène dipeptide diphycerque diphyodonte
En rapport avec "dioxyde de soufre"
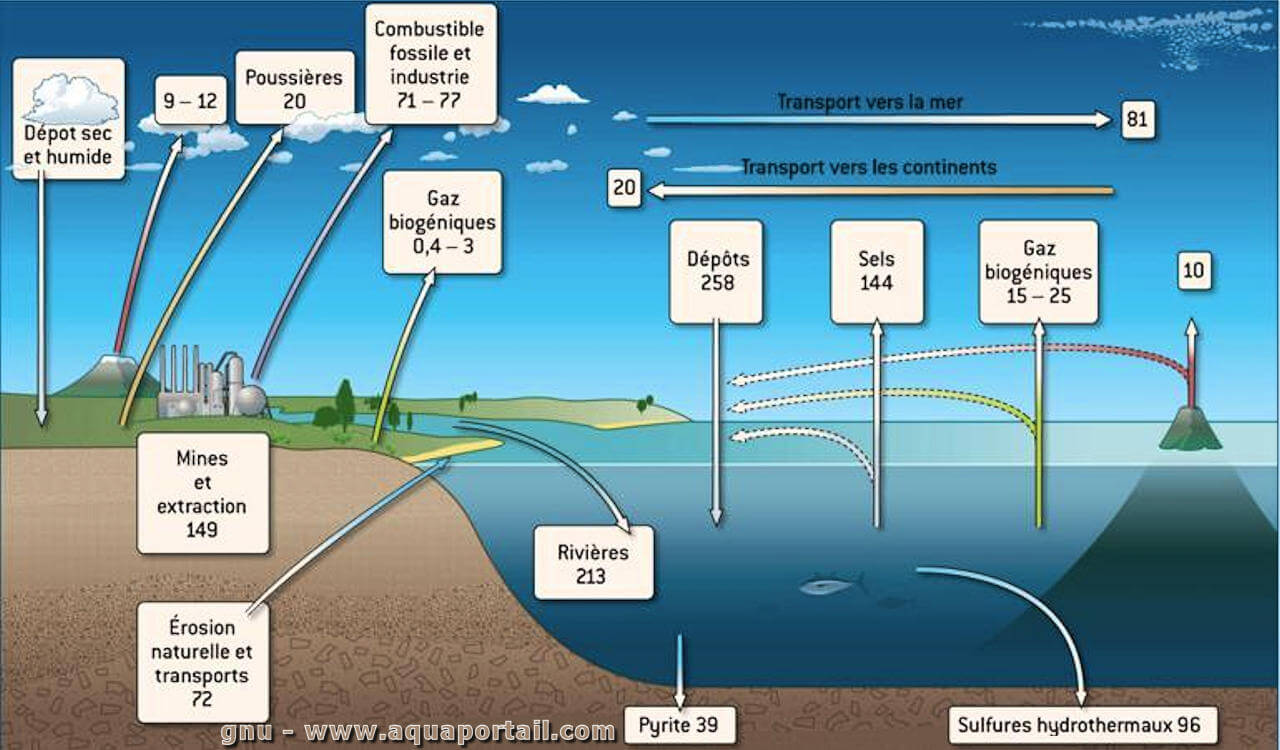
Le cycle du soufre est l'ensemble des processus par lesquels le soufre se déplace vers les minéraux et les systèmes vivants.

Le dioxyde est un anion de double oxyde, un composé chimique avec deux atomes d'oxygène, de formule O₂⁻ dans chaque molécule.

Le dioxyde de carbone (CO₂) est un gaz incolore, inodore et ininflammable à température et pression atmosphériques.

Le soufre (S, numéro atomique 16) est un élément chimique non-métal qui existe dans la nature et peut être trouvé dans le sol, les plantes, les aliments...
