Caspase
Définition
Une caspase est une protéase à cystéine. Les caspases clivent des protéines telles que la cytokine pro-IL-1β qui est ensuite sécrétée du cytoplasme cellulaire vers l'espace extracellulaire pour initier une réponse inflammatoire dans le tissu.
Les caspases sont une famille d'endoprotéases qui fournissent des liens critiques dans les réseaux de régulation cellulaire contrôlant l'inflammation et la mort cellulaire.
Schéma de l'activation des caspases :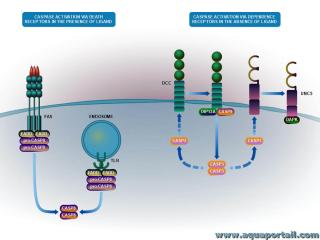
Les caspases exécutent la mort cellulaire apoptotique. Les caspases existent sous forme de zymogènes inactifs dans les cellules et subissent une cascade d'activation catalytique au début de l'apoptose. L'initiation de l'apoptose se produit par une voie cellulaire intrinsèque ou extrinsèque cellulaire. Les signaux de mort cellulaire par voie extrinsèque proviennent de la membrane plasmique.
Explications
Le terme "caspase" est un acronyme de l'anglais Cysteinyl-aspartate-cleaving proteASE. Les caspases ont été regroupées à l'origine sur la base d'études démontrant leur rôle fonctionnel dans un processus biologique spécifique.
Cependant, il a maintenant été démontré que de nombreuses caspases sont impliquées dans des processus distincts de leurs fonctions initialement définies, brouillant les frontières entre ces classes fonctionnelles.
En plus de leurs rôles bien caractérisés dans l'apoptose et la maturation des cytokines, il a été démontré que les caspases participent à plusieurs processus biologiques via des mécanismes autonomes cellulaires et non autonomes cellulaires. Mais comment et pourquoi les caspases ont évolué pour programmer des fonctions apparemment opposées telles que l'inflammation, la cornification de la peau et l'apoptose est un mystère.
La découverte séminale selon laquelle la signalisation du récepteur de la mort cellulaire nécessitait, dans sa forme la plus élémentaire, simplement un récepteur transmembranaire, une molécule adaptatrice et une caspase a révélé une solution au problème déroutant de la façon dont le premier signal protéolytique a été généré pendant l'apoptose, puisqu'il impliquait une caspase. directement dans l'événement déclencheur.
Comme la plupart des enzymes protéolytiques, les caspases résident sous forme de formes latentes qui sont généralement activées par une protéolyse limitée.
Rôle chez les métazoaires
Les caspases sont conservées phylogénétiquement dans tous les métazoaires et remplissent de nombreux rôles différents. Les caspases de mammifères sont classées en deux groupes fonctionnels, celles impliquées dans l'immunité et celles qui facilitent la mort cellulaire apoptotique.
Les caspases sont exprimées sous forme de précurseurs inactifs à l'intérieur des cellules et doivent être activées pour cliver des substrats cibles spécifiques.
Les caspases pro-apoptotiques clivent un plus grand sous-ensemble de protéines intracellulaires pour médier le suicide cellulaire par apoptose, tandis que les caspases impliquées dans l'immunité peuvent tuer les cellules par des mécanismes alternatifs non apoptotiques. Les caspases pro-apoptotiques sont essentielles au développement embryonnaire et à l'homéostasie tissulaire normale.
Classe de cystéinyl protéases
Les caspases définissent une classe de cystéinyl protéases appartenant à la famille C14 de la classification de Barrett et Rawlings Barrett (1997). Ces enzymes ont une exigence absolue pour un résidu d'acide aspartique en position P1 de la liaison scissile.
La famille des gènes caspase contient jusqu'à présent 11 membres humains qui peuvent être divisés en trois groupes. Le groupe 1 (caspases 1, 4 et 5) est composé d'enzymes impliquées dans la régulation de l'inflammation. Le groupe 2 (caspases 2, 3 et 7) et le groupe 3 (caspases 6, 8, 9 et 10) sont composés de caspases régulant l'apoptose. Les caspases 11 et 12 sont des protéines murines dont les caspases 5 et 4 peuvent être les homologues humains.
La dernière addition aux caspases humaines, la caspase-14, ne semble pas être impliquée dans la régulation de l'apoptose ou de l'inflammation mais pourrait jouer un rôle dans la différenciation cellulaire. La caspase-13, initialement confondue avec une protéine humaine, correspond très probablement à l'orthologue bovin de la caspase-4 humaine.
Des preuves récentes indiquent que certaines des caspases impliquées dans l'induction de l'apoptose dans certains systèmes cellulaires sont nécessaires pour les programmes de différenciation dans d'autres.
La survie des cellules ayant activé leurs caspases n'est pas totalement comprise mais peut être médiée par le clivage de substrats de caspases non conventionnels, tels que RasGAP, qui génèrent des signaux anti-apoptotique une fois clivés.
Mort cellulaire apoptotique
Un ligand extracellulaire (FasL) se lie à son "récepteur de mort" transmembranaire de surface cellulaire (récepteur Fas), induisant une oligomérisation du récepteur. Les " récepteurs de la mort " sont des récepteurs de surface cellulaire spécialisés, notamment Fas/CD95, le récepteur 1 du facteur de nécrose tumorale alpha (TNF-alpha) et deux récepteurs, DR4 et DR5, qui se lient au ligand induisant l'apoptose lié au TNF-alpha (PISTE).
La liaison du ligand favorise le regroupement des protéines qui se lient au domaine intracellulaire du récepteur (par exemple, FADD ou protéine contenant le domaine de mort associé au Fas), qui se lie ensuite au prodomaine des caspases initiatrices (caspase-8 ou -10) pour promouvoir leur dimérisation et leur activation.
La caspase-8/-10 active peut alors directement cliver et activer les caspases effectrices, telles que la caspase-3 ou elle peut cliver Bid, ce qui facilite la libération du cytochrome c mitochondrial.
Un groupe unique de protéines appelées récepteurs à dépendance (DpR) transduisent des signaux positifs (souvent prosurvie ou procroissance) lorsqu'ils sont engagés par un ligand, mais émettent des signaux proapoptotiques en l'absence de ligand. La famille DpR comprend le récepteur de la neurotrophine p75 (p75NTR), supprimé dans le cancer du côlon (DCC) et les homologues UNC5, entre autres des récepteurs membranaires de surface cellulaire.
Synonymes, antonymes
1 synonyme (sens proche) de "caspase" :
- protéase à cystéine
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à CASPASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CASPASE est dans la page 2 des mots en C du lexique du dictionnaire.
Mots en C à proximité
cascabelle cascade cascade trophique cascail caséine caspasecasse-lunette castagnole castoréum catabolisme catabolisme des glucides
En rapport avec "caspase"

L'apoptose est un type de mort cellulaire programmée où une série d'étapes moléculaires entraîne la mort d'une cellule.
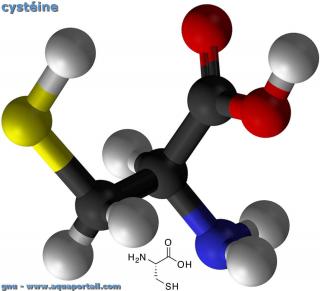
La cystéine (Cys ou C) est un acide alpha-aminé soufré constitutif des protéines, de formule chimique HS-CH2-CH(NH2)-COOH, portant un groupement thiol (-SH).

L'inflammasome est un complexe multimérique intracellulaire de différentes protéines et est un acteur clé de l'immunité innée.

Une protéase est une peptidase, une enzyme protéolytique qui coupe une liaison peptidique au sein d'une séquence protéique, mais pas aux extrémités.
