Invertase
Définition
L'invertase est une enzyme (glycoprotéine de type hydrolase) qui sépare le saccharose en glucose et en fructose. Elle est largement distribuée dans la biosphère, en particulier dans les plantes et les micro-organismes. Par exemple, les abeilles utilisent une invertase de pollen pour fabriquer du miel à partir du nectar.
La réaction avec une invertase et exemples :
En haut, schéma de la réaction produite avec une invertase. En bas, structure des invertases de la levure Schwanniomyces occidentalis, la bactérie Thermotoga maritima et la plante Arabidopsis thaliana.
Explications
Une invertase a la même fonction qu'une inulinase, isomaltase, maltase, saccharase, sucrase ou levansucrase, car toutes ces enzymes hydrolysent également le saccharose, mais chacune le réalise par un mécanisme différent. L'invertase dans la nature existe sous différentes isoformes.
L'invertase est utilisée dans l'industrie alimentaire pour produire du fructose qui est plus sucré et ne cristallise pas facilement.
Le nom officiel de l'invertase est bêta-fructofuranosidase (EC.3.2.1.26, β-fructosidase), ce qui implique que la réaction catalysée par l'enzyme est l'hydrolyse des résidus bêta-fructofuranosides terminaux non réducteurs en bêta-fructofuranosides. Elle a été décrite par le chimiste-biologiste Marcellin Berthelot (1827–1907) pour la première fois en 1860.
Chez les levures
Chez les levures, l'invertase est présente sous forme d'invertase extracellulaire ou d'invertase intracellulaire. Son action est idéale avec un pH optimal de 4,5 et une stabilité à 50 °C. La levure de boulanger Saccharomyces cerevisiae est la principale souche utilisée pour la production et la purification de l'enzyme invertase.
Il a été établi que dans les cellules déprimées, la majeure partie de l'invertase est extracellulaire (externe) alors qu'à l'état complètement réprimé, toute l'invertase est intracellulaire (interne). Les deux diffèrent dans les séquences d'acides aminés, en particulier l'invertase intracellulaire ne contient pas de cystéine.
Chez les plantes
Chez les plantes, il existe trois isoformes, chacune différant par ses propriétés biochimiques et ses emplacements subcellulaires. L'invertase dans les plantes est essentielle non seulement pour le métabolisme, mais aussi pour l'osmorégulation, le développement et le système de défense. L'invertase de la paroi cellulaire est cruciale pour le métabolisme, la croissance et la différenciation des plantes. L'invertase extracellulaire catalyse le clivage du sucre de transport.
Trois sous-groupes biochimiques d'invertase existent chez les plantes : vacuolaire (acide soluble), cytoplasmique (alcalin soluble) et invertase liée à la paroi cellulaire. La présence de multiples isoformes d'invertase dans la nature a un rôle fonctionnellement bénéfique pour les plantes.
Pour fournir aux cellules, du carburant pour la respiration, du carbone et de l'énergie pour la synthèse de différents composés, l'invertase clive le saccharose en monosaccharide correspondant. En générant le gradient de concentration de saccharose nécessaire entre les sites de chargement et de déchargement du phloème, l'Invertase aide également au transport longue distance du saccharose. L'hydrolyse du saccharose en glucose et fructose influence la pression osmotique des cellules et contribue ainsi à l'allongement cellulaire et à la croissance des plantes.
Chez l'humain
Chez l'Homme, l'enzyme invertase agit comme un stimulant immunitaire, comme un antioxydant, un antiseptique et utile pour les patients atteints d'un cancer des os ou d'un cancer de l'estomac dans certains cas.
L'invertase entraîne une réaction de liaison entre la dégradation des glucides et les réponses des agents pathogènes. Cela inclut le phénomène de résistance élevée au sucre dans lequel des gènes clés liés à la pathogenèse qui sont inductibles par le sucre sont surexprimés. Cela se traduit par une expression accrue des protéines liées aux agents pathogènes (PR) et donc une résistance accrue contre les infections virales.
Rappel de biologie
La principale source d'énergie de tous les organismes vivants est constituée par les glucides. Même les disaccharides non réducteurs comme le tréhalose ou le saccharose ont également d'autres rôles comme agir comme molécule de signalisation ainsi que comme protecteurs du stress. De plus, un monosaccharide comme le glucose ou le fructose joue des fonctions régulatrices dans la voie métabolique centrale du métabolisme d'une cellule.
Ainsi, l'invertase joue un rôle central car il s'agit d'une enzyme hydrolysant le saccharose, nommée en raison de l'inversion de la rotation optique lors de l'hydrolyse du saccharose. Alors le résultat est un mélange de fructose et glucose, appelé "sucre inverti".
Extraction d'invertase
En exemple, l'extraction et la purification de l'invertase de la levure Candida guilliermondii isolée de déchets solides de pêche.
Les meilleures conditions pour l'hydrolyse du saccharose in vitro basée sur l'invertase de Candida guilliermondii (ICg) ont été étudiées et les paramètres cinétiques KM, Vmax et la stabilité thermique de l'ICg ont été déterminés. La levure Candida guilliermondii (Cg) isolée et lyophilisée à partir de déchets solides de pêche a été identifiée à l'aide de la méthode API 20C AUX. Par la suite, le Cg a été soumis à un processus d'autolyse utilisant du NaHCO3 à 200 mM sous agitation à 200 tr/min et 40 °C pendant 24 h. Les extraits enzymatiques obtenus ont été récupérés par précipitation à l'acétone suivie d'une dialyse et d'une chromatographie échangeuse d'ions. L'extrait purifié par précipitation avec de l'acétone avait une activité de 27,7 U/mg et une récupération de 56 % alors que le procédé de chromatographie a donné 46,5 U/mg et 44,8 %. Les conditions optimales d'hydrolyse du saccharose étaient pH 5, 0 et 50 °C, résultant en KM de 30, 5 mM et 28, 7 mM de saccharose, respectivement, à 25 °C et 50 °C, tous deux avec un comportement michaelien. L'inactivation thermique d'ICg présentait une cinétique apparente de premier ordre et son activité résiduelle était typiquement linéaire entre 40 °C et 70 °C. Trois isoenzymes ont été détectées par électrophorèse.
L'invertase est une enzyme qui catalyse l'hydrolyse de la molécule de saccharose à l'extrémité non réductrice du résidu β–D-fructofuranosidase, résultant en un mélange équimolaire de glucose et de fructose appelé sucre inversé.
Le sucre inverti est un produit majeur de l'industrie agro-alimentaire, où il est utilisé comme sirop, ingrédient des confitures, des bonbons en bonbon, et des sucreries en général du fait de sa cristallisation lente, de son fort pouvoir sucrant (environ 40 % supérieur à celui du saccharose), et une durée de conservation plus longue. Le bioprocédé le plus souvent utilisé pour produire du sucre inverti est l'hydrolyse acide. Cependant, le produit subit facilement des changements de couleur et de saveur qui entravent sa durée de conservation.
Ces altérations sont une conséquence de la formation d'hydroxyméthylfurfural (HMF), un produit à fort potentiel cancérogène pour l'homme, formé lors de son traitement à faible pH et à haute température. Le procédé nécessite l'utilisation de bases pour neutraliser la formation de résidus toxiques.
Le processus enzymatique est une alternative importante car il utilise des conditions plus douces telles qu'un pH compris entre 4,5 et 5,0 et une température dans la plage de 30 à 50 °C, ce qui réduit l'impact sur l'environnement.
Cependant, il présente l'inconvénient d'un coût élevé par rapport au procédé acide. Néanmoins, le procédé enzymatique peut fournir un degré élevé d'hydrolyse lorsque les critères cinétiques d'une enzyme sont bien équilibrés avec l'opération, par exemple, l'utilisation d'enzymes immobilisées dans des supports solides insolubles. Le produit obtenu est de qualité supérieure, avec de faibles teneurs en cendres, colorants et HMF. Il ne nécessite pas non plus de neutralisation.
Les invertases se trouvent dans des organismes tels que les invertébrés, les vertébrés, les algues vertes, les champignons et les levures. La levure Saccharomyces cerevisiae est la principale source d'invertase et est classée comme généralement reconnue comme sûre (GRAS). Saccharomyces cerevisiae synthétise deux invertases : l'une glycosylée et l'autre non glycosylée. L'enzyme non glycosylée se trouve dans le cytoplasme, tandis que l'enzyme glycosylée se trouve dans le périplasme lié à la paroi cellulaire de la levure, qui est la forme prédominante. La levure Candida utilis produit également les deux isoformes de l'enzyme. Plus de 160 types de micro-organismes ont été identifiés dans les fruits tels que la pêche et ses déchets de transformation, parmi lesquels la levure Saccharomyces cerevisiae se distingue par son potentiel fermentatif et sa résilience thermique importante identifié les levures Saccharomyces cerevisiae, Rhodotorula mucilaginosa et Trichosporum mucoidesi de la purée de pêche gâtée. Toutes ces levures sont positives pour le saccharose et le raffinose, donc porteuses d'un potentiel de production d'invertase.
Ici, l'invertase a été extraite de Candida guilliermondii (Cg) à partir de déchets solides de pêche par autolyse, purifiée par précipitation suivie d'une dialyse et identifiée par électrophorèse horizontale. Les meilleures conditions pour l'hydrolyse du saccharose in vitro ainsi que les paramètres cinétiques KM, Vmax et la stabilité thermique de l'ICg ont également été étudiés. L'identification de levures isolées à partir de déchets solides de pêche à l'aide d'API 20C AUX et d'une levure commerciale Saccharomyces cerevisiae comme témoin a également été étudiée.
Synonymes, antonymes
Voir tous les synonymes pour "invertase".4 synonymes (sens proche) de "invertase" :
- bêta-fructofuranosidase
- hydrolase
- maltase
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à INVERTASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot INVERTASE est dans la page 2 des mots en I du lexique du dictionnaire.
Mots en I à proximité
inuline invadopodeinvagination invaginer inversion chromosomique invertaseinvertébré involucelle involucre involucrine involuté
En rapport avec "invertase"
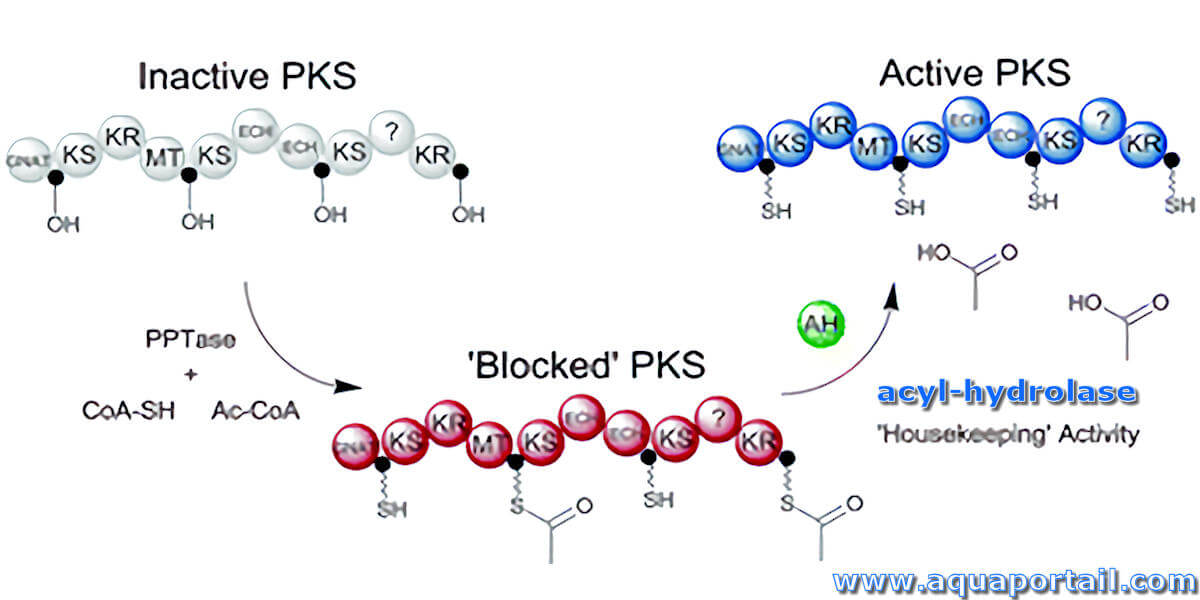
Une acyl-hydrolase est une enzyme de type hydrolase à radical (R-CO)- susceptible de dissoudre les molécules à liaison acyle en fixant de l'eau.

La biocatalyse est le processus chimique par lequel des enzymes ou d'autres catalyseurs biologiques effectuent des réactions entre des composants organiques.

Une hydrolase est une enzyme responsable de la catalyse du clivage de substrats moléculaires de grande taille en composants plus petits, par un processus...
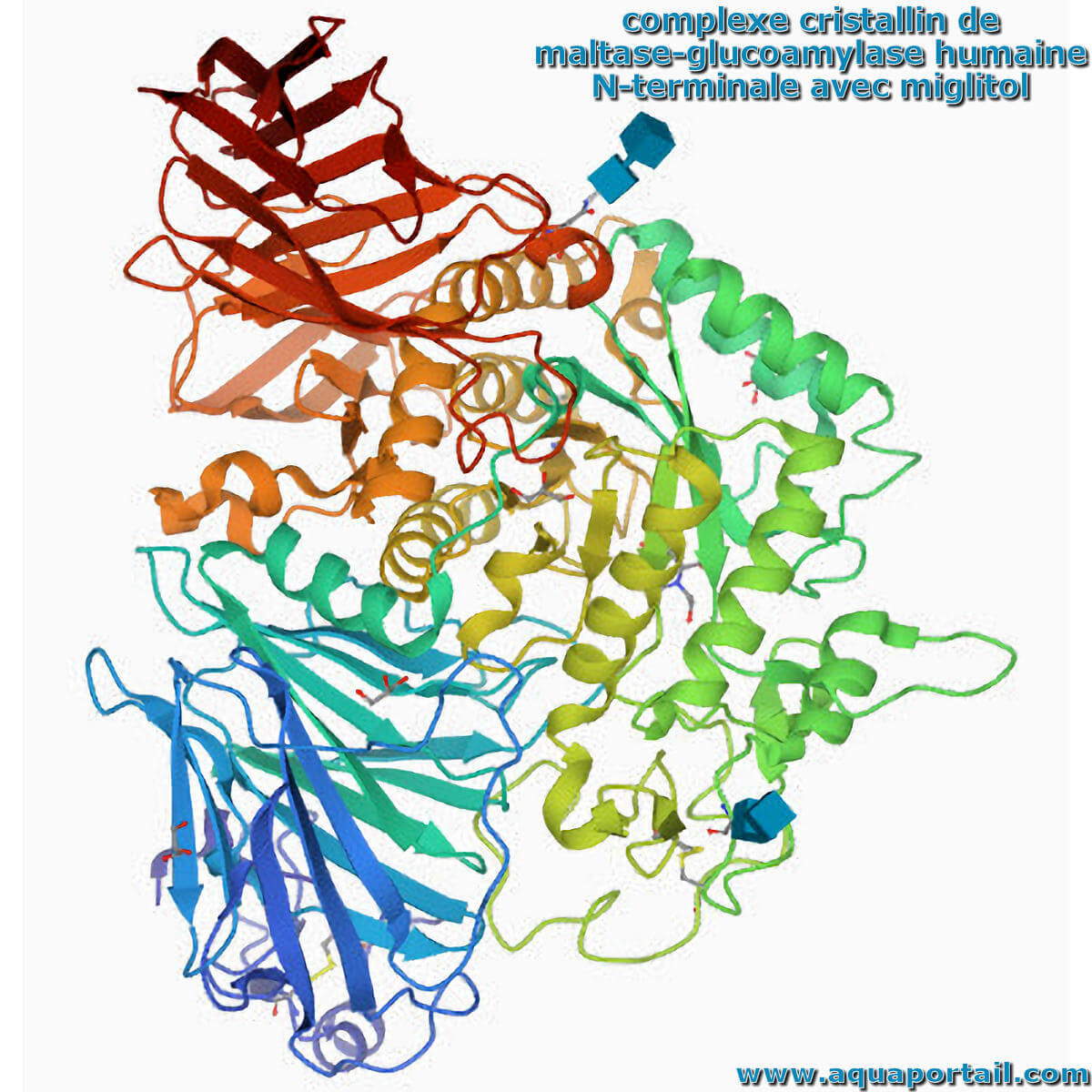
La maltase est une enzyme qui transforme le maltose (disaccharide) en les deux glucoses dont elle est composée.
