Rubisco
Définition
La Rubisco est une enzyme importante impliquée dans la photosynthèse qui catalyse l'incorporation de dioxyde de carbone dans le ribulose-1,5-bisphosphate et la dégradation en 3-phosphoglycérate. Ces enzymes interviennent avec les plantes et les bactéries phototrophes.
La Rubisco peut constituer environ 30 % du nombre de protéines végétales et constitue probablement la protéine la plus commune de la biosphère.
Représentation de la Rubisco :
La Rubisco, ici en représentation 3D, est activée à partir d'épinards sous forme ouverte avec un site actif accessible. Les résidus de site actif Lys175 sont marqués en rose et un gros plan du résidu est fourni à droite pour l'un des monomères composant l'enzyme.
Explications
Cette enzyme catalyse la carboxylation du ribulose-1,5-bisphosphate (phase d'incorporation du CO2 du cycle de Calvin) ou son oxygénation, dans les chloroplastes et chez les bactéries photosynthétiques.
"rubisco" est l'abréviation de ribulose-1,5-bisphosphate carboxylase/oxygénase, et est synonyme de carboxydismutase (désuet), RuBP carboxylase (désuet). "rbcL" est l'abréviation qui désigne la "grande sous-unité de la Rubisco". Voir aussi un carboxysome.
Rubisco est un complexe composé de seulement deux sous-unités, la grande sous-unité (LS) (53 kDa) étant codée par le gène rbcL du chloroplaste et la petite sous-unité (SS) (14 kDa) étant codée par la famille de gènes nucléaires RBCS.
Structure
La Rubisco dans les chloroplastes des plantes et des algues se compose de huit grandes sous-unités de taille 51–58 kDa et de huit petites sous-unités de taille 12–18 kDa. Le centre actif de l'enzyme est situé dans de grandes sous-unités.
Les petites sous-unités peuvent améliorer l'activité catalytique des principales sous-unités, mais leur principale fonction est de soutenir la structure de l'enzyme. Les petites sous-unités ne sont pas nécessaires à l'activité de Rubisco et, par exemple, certaines bactéries violettes ne sont pas présentes du tout et il n'y a que deux grandes sous-unités.
La rubisco est formée de huit grandes sous-unités (56 kDa) codées par l'ADN chloroplastique et de huit petites (14 kDa) codées par l'ADN nucléaire. Le site actif est portée par les grandes sous-unités.
Dans les plantes, les algues, les cyanobactéries et les protéobactéries phototrophes et chimioautotrophes, l'enzyme se compose généralement de deux types de sous-unités protéiques, appelées grande chaîne L et petite chaîne S.
rbcL (grande sous-unité de la Rubisco)
rbcL est une abréviation de la Rubisco désignant la grande sous-unité de la Rubisco, un gène de plante. Écrit autrement, RbCl ("R" majuscule) est du chlorure de rubidium, un halogénure de métal alcalin.
Chez les plantes, les algues, les cyanobactéries et les protéobactéries phototropes et chimiotrotropes, l'enzyme se compose habituellement de deux types de sous-unités protéiques, appelées la grande chaîne (L, environ 55 000 Da, l'apoenzyme) et la petite chaîne (S, environ 13 000 Da, la coenzyme ou cofacteur).
Le gène à grande chaîne (rbcL) est codé par l'ADN chloroplastique chez les plantes. Il existe généralement plusieurs gènes apparentés à petites chaînes dans le noyau des cellules végétales, et les petites chaînes sont importées dans le compartiment stromal des chloroplastes du cytosol en traversant la membrane chloroplastique externe.
Les sites de liaison enzymatiquement actif substrat (ribulose 1,5-bisphosphate) sont situés dans les grandes chaînes qui forment des dimères comme le montre la figure 1 (ci-dessus, à droite) dans laquelle les acides aminés de chaque grande chaîne contribuent à la des sites de liaison.
Un total de huit grandes chaînes (= 4 dimères) et huit petites chaînes s'assemblent en un plus grand complexe d'environ 540 000 Da. Dans certaines protéobactéries et dinoflagellés, des holoenzymes constituées uniquement de grandes sous-unités ont été trouvées.
Mécanisme
Pour que la Rubisco agisse comme une enzyme catalytiquement active, le résidu d'acide aminé de la chaîne latérale de l'acide aminé lysine situé sur le site de contrôle enzymatique doit être du dioxyde de carbone pour former un groupe carbamate qui se lie aux ions magnésium actifs dans la coenzyme. Cependant, le substrat enzymatique ribulose-1,5-bisphosphate se lie fortement à cette chaîne latérale et empêche la fonction complète de la rubisco.
En conséquence, la seconde enzyme activant le décapage élimine le ribulose-1,5-bisphosphate par une réaction consommant de l'ATP, provoquant ainsi la carboxylation de la chaîne latérale et la conformation de l'enzyme devient active. L'action de frottement est donc une protéine régulatrice.
Le ribulose-1,5-bisphosphate se lie aux ions magnésium par l'intermédiaire de son groupe cétone et du groupe hydroxyle de carbone adjacent. L'ion magnésium est également lié aux chaînes latérales des acides asparagine et glutamique de l'enzyme en plus du groupe carbamate de lysine. Le groupe amino de la lysine élimine le proton du substrat pour former un intermédiaire ènediolate.
En conséquence du transfert de protons, l'ènediolate est isomérisé en le deuxième ènediolate auquel le rubisco est lié par réaction d'addition nucléophile au dioxyde de carbone pour former le 1,5-bisphosphate de 2-carboxy-3-céto-darabinitol. C'est un intermédiaire très stable qui implique une molécule d'eau et forme l'hydroxy-β-céto-acide. Ceci se dégrade en 3-phosphoglycérate par la réaction inverse de la condensation d'aldol.
La rubisco peut également catalyser une réaction secondaire dans laquelle l'ènediolate formé à partir du ribulose-1,5-bisphosphate réagit avec l'oxygène au lieu du dioxyde de carbone. Dans ce cas, une molécule de 3-phosphoglycérate et une molécule de phosphoglycolate sont produites. Cette réaction nécessite également que la chaîne latérale de la lysine ait formé du carbamate. On pense que la réaction se déroule par l'intermédiaire d'un hydroperoxyde intermédiaire qui se décompose lorsqu'il est accompagné d'une molécule d'eau.
La plante phosphoglycolate est traitée par voie métabolique appelée photorespiration. La photorespiration est plus active par temps chaud et sec lorsque les plantes ferment leurs orifices de drainage en dioxyde de carbone.
Conditions et facteurs réglementaires
Rubisco doit fonctionner comme une coenzyme avec un ion magnésium. Dans certaines bactéries, le magnésium peut également être remplacé par du manganèse ou du fer. Le dioxyde de carbone doit être associé au site de régulation pour permettre la liaison des ions métalliques. La lumière active aussi la Rubisco. Les mécanismes de radiation sont compliqués et pas complètement compris.
Le rayonnement provoque le passage des protons à travers la membrane de l'anatoxine dans l'espace extérieur et les ions magnésium dans le thylakoïde. Il en résulte un gradient de protons sur les différentes faces du film de thylakoïde et le pH du thylakoïde est d'environ 8, ce qui est approprié pour l'activité du rubisco et est particulièrement bon pour la formation d'un groupe carbamate.
La Rubisco inhibe de nombreux phosphates de sucre organiques. L'un des inhibiteurs les plus importants est le 2-carboxyabinabinol-1-phosphate qui ressemble à une réaction catalysée par le rubisco du 1,5-bisphosphate de 2-carboxy-3-cétodi-arabinitol intermédiaire. Il se lie à l'enzyme plus de 1 000 fois plus fort que le ribulose-1,5-bisphosphate et empêche ainsi son activité. Le 2-carboxy-arabinitol-1-phosphate s'accumule dans les feuilles des plantes pendant la nuit.
Lorsque le soleil brille, son rayonnement active un activateur de décapant qui élimine l'enzyme inhibitrice et est dégradé par l'enzyme spécifique appartenant aux phosphatases.
Voies alternatives de fixation du carbone
La Rubisco est importante sur le plan biologique car elle catalyse la réaction chimique primaire par laquelle le carbone inorganique pénètre dans la biosphère organique. Alors que beaucoup de bactéries autotrophes et d'archées fixent le carbone via la voie réductrice de l'acétyl-CoA, le cycle 3-hydroxypropionate ou le cycle de Krebs inverse, ces voies contribuent relativement moins à la fixation globale du carbone que celle catalysée par Rubisco.
La phosphoénolpyruvate carboxylase, contrairement à la Rubisco, ne fixe que temporairement le carbone. Reflétant son importance, la Rubisco est la protéine la plus abondante dans les feuilles, représentant 50 % des protéines solubles dans les feuilles des plantes C3 (20–30 % de l'azote total des feuilles) et 30 % des protéines solubles dans les plantes C4 (5–9 % d'azote total des feuilles).
Compte tenu de son rôle important dans la biosphère, le génie génétique de la Rubisco dans les cultures présente un intérêt constant.
Génie génétique
Étant donné que la Rubisco limite souvent la vitesse de la photosynthèse chez les plantes, il est possible d'améliorer l'efficacité de la photosynthèse en modifiant les gènes Rubisco dans les plantes pour augmenter l'activité catalytique et/ou diminuer les taux d'oxygénation. Cela pourrait améliorer la bioséquestration du CO2 et constituer à la fois une stratégie importante en matière de changement climatique et une stratégie visant à accroître les rendements des cultures.
Les approches étudiées incluent :
- le transfert des gènes Rubisco d'un organisme dans un autre organisme,
- l'ingénierie de la Rubisco activase des cyanobactéries thermophiles dans des plantes sensibles à la température,
- l'augmentation du niveau d'expression des sous-unités Rubisco,
- l'expression de petites chaînes Rubisco à partir de l'ADN chloroplastique,
- la modification des gènes Rubisco augmenter la spécificité du dioxyde de carbone ou augmenter autrement le taux de fixation du carbone. Bien que les niveaux de CO2 augmentent, les efforts pour accroître la spécificité pour le CO2 peuvent être inutiles.
Mutagenèse chez les plantes
En général, la mutagenèse dirigée de Rubisco a été peu fructueuse, bien que des formes mutées de la protéine aient été obtenues chez des plants de tabac avec des sous-unités C4, et une Rubisco avec plus de caractéristiques cinétiques été atteint dans le riz via la transformation nucléaire. Voir la mutagenèse dirigée.
L'une des solutions consiste à introduire des variantes de Rubisco avec des valeurs de spécificité naturellement élevées telles que celles de l'algue rouge Galdieria partita dans les plantes. Cela peut améliorer l'efficacité photosynthétique des plantes cultivées, même si les impacts négatifs possibles doivent encore être étudiés. Les progrès dans ce domaine incluent le remplacement de l'enzyme du tabac par celui de la bactérie photosynthétique violette Rhodospirillum rubrum.
En 2014, deux lignées de tabac transplastomiques avec la Rubisco fonctionnelle de la cyanobactérie Synechococcus elongatus PCC7942 (Se7942) ont été créées en remplaçant la Rubisco par les gènes de grande et de petite sous-unité de l'enzyme Se7942, en combinaison RbcX, ou une protéine carboxysomale interne, C cmM35. Les deux mutants avaient un taux de fixation du CO2 accru lorsqu'ils étaient mesurés en tant que molécules de carbone par Rubisco. Cependant, les plantes mutantes ont augmenté plus lentement que les plantes sauvages.
Une théorie récente explore le compromis entre la spécificité relative (c.-à-d. la capacité de favoriser la fixation du CO2 par rapport à O).
L'incorporation, qui conduit au processus de photorespiration peu énergivore) et à la vitesse à laquelle le produit est formé. Les auteurs concluent que Rubisco a en fait évolué pour atteindre un point de "quasi-perfection" dans de nombreuses plantes (avec des disponibilités et des conditions environnementales très variables), atteignant un compromis entre spécificité et vitesse de réaction.
Étant donné que la photosynthèse est le régulateur naturel de l'atmosphère le plus efficace du dioxyde de carbone dans l'atmosphère terrestre, un modèle biochimique de la réaction de Rubisco est utilisé comme module central des modèles de changement climatique. Ainsi, un modèle correct de cette réaction est essentiel à la compréhension de base des relations et des interactions des modèles environnementaux. Une nouvelle théorie et un nouveau modèle de la réaction biochimique de la photosynthèse et des inconvénients du modèle de photosynthèse le plus largement utilisé aujourd'hui sont discutés.
Synonymes, antonymes
Voir tous les synonymes pour "Rubisco".1 synonyme (sens proche) de "rubisco" :
- carboxydismutase
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à RUBISCO sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot RUBISCO est dans la page 3 des mots en R du lexique du dictionnaire.
Mots en R à proximité
royaume floristique ruban d'arpentagerubané Rubiacées rubigineux RubiscoRuBP ruche rudéral rudologierufisme
En rapport avec "Rubisco"

L'acide 2,3-diphosphoglycérique, anciennement appelé diphosphoglycérate (DPG), est un métabolite intermédiaire du glucose synthétisé à partir de l'acide...
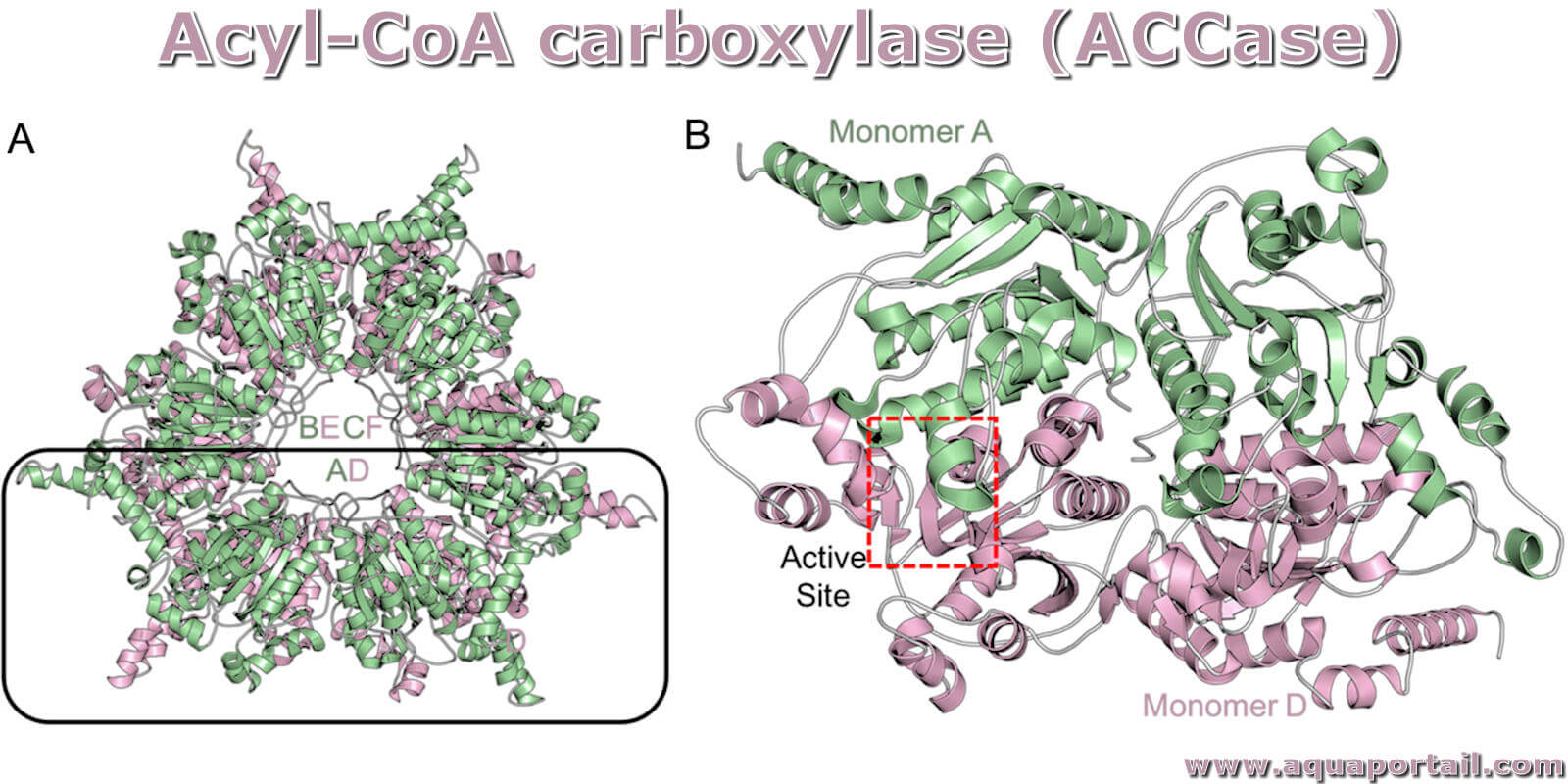
Une carboxylase est une enzyme qui catalyse la fixation du CO₂, un acide, sur un composé organique par carboxylation.

Une décarboxylase est une enzyme qui catalyse une réaction de décarboxylation, c'est-à-dire le détachement d'une molécule de CO₂ qui conduit à l'élimination...
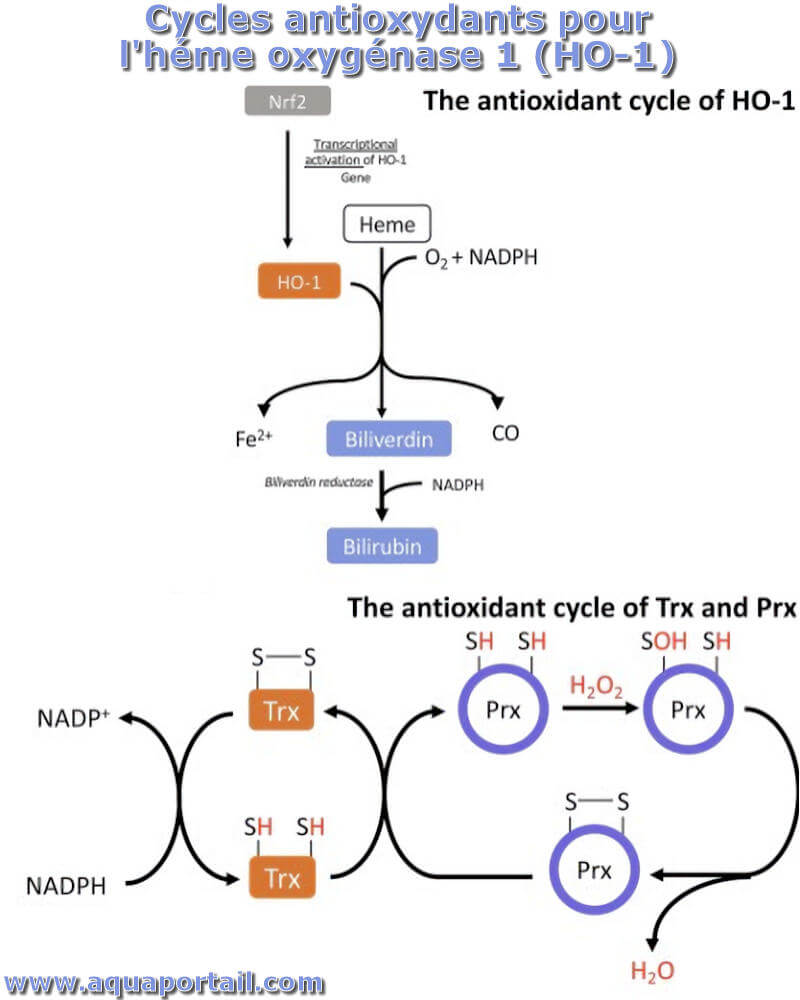
Une oxygénase est une enzyme du groupe des oxydoréductases qui catalyse l'addition d'un (monooxygénase) ou de deux (dioxygénase) atomes d'oxygène (dioxygène).
