Acide méthanesulfonique
Définition
L'acide méthanesulfonique (acide méthylsulfonique) est un alcane d'acide sulfonique dans lequel le groupe alkyle directement lié à la fonctionnalité sulfo est le méthyle. Il a un rôle de métabolite d'Escherichia coli. Cet acide conjugué d'un méthanesulfonate est un composé à un seul carbone.
L'acide méthanesulfonique :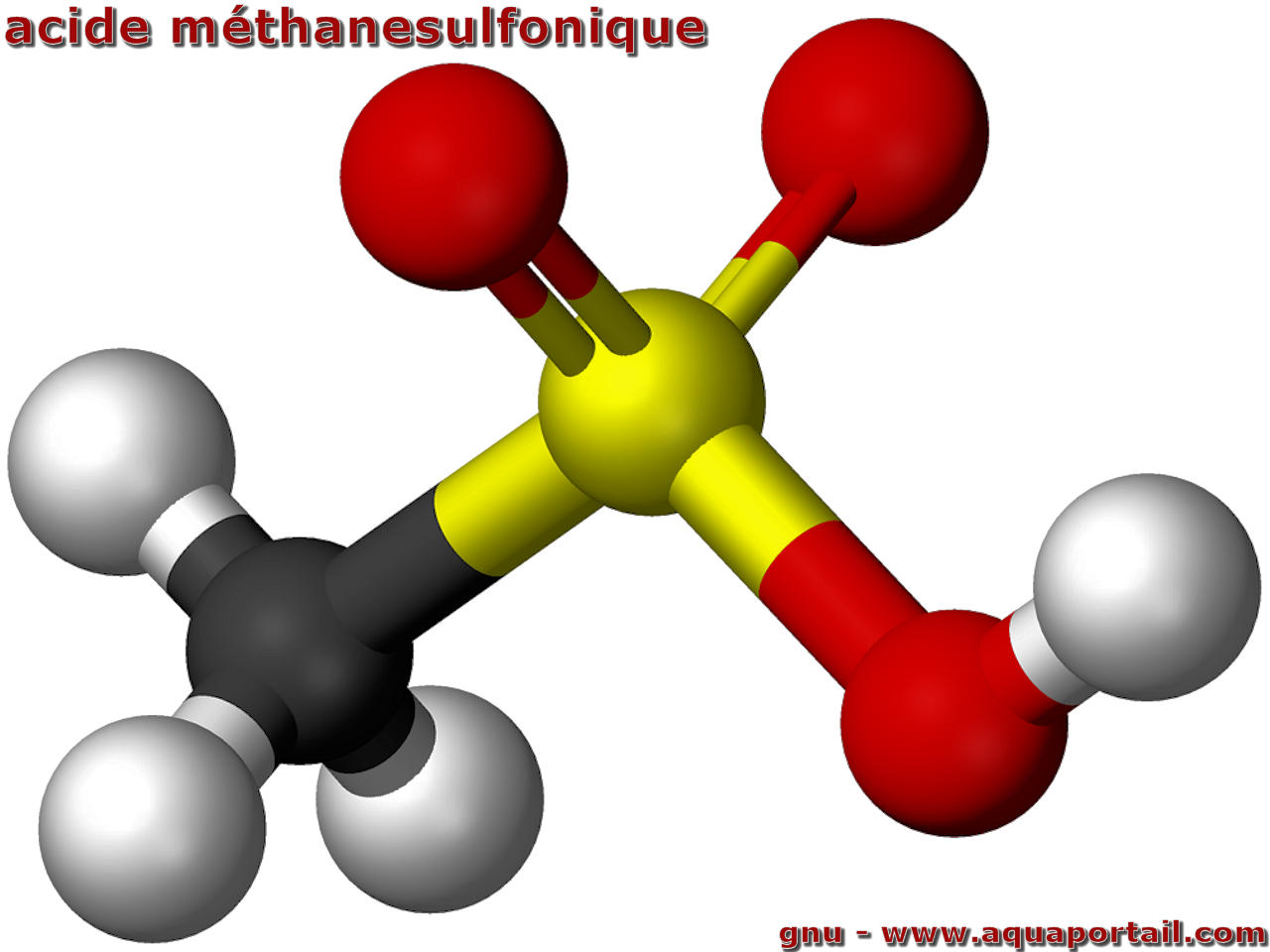
L'acide méthanesulfonique, de formule semi-développée CH3SO3H et de structure H3C−S(=O)2−OH, a un poids moléculaire égal à 96,11 g/mol. C'est le plus simple des acides alkylsulfoniques (R-S(=O)2-OH).
Explications
L'acide méthanesulfonique (AMS, CH4O3S) est un liquide hygroscopique incolore (organosulfurique) ou un solide blanc, selon que la température ambiante est supérieure ou inférieure à 20 °C. Il est très soluble dans l'eau et les solvants oxygénés, mais peu soluble dans la plupart des hydrocarbures. En solution aqueuse, c'est un acide fort (complètement ionisé).
Les propriétés d'acidité et de solubilité de l'AMS lui confèrent une valeur industrielle en tant que catalyseur dans les réactions organiques, en particulier la polymérisation. Dans de nombreuses applications, son avantage par rapport à l'acide sulfurique concentré est qu'il a une force d'acide similaire mais n'est pas un oxydant.
Le premier rapport de synthèse de l'AMS était dans un brevet de 1950 accordé à John C. Snyder et Aristid V. Grosse. Ils ont chauffé le méthane et le trioxyde de soufre à 200–325 °C sous pression en présence d'un catalyseur au mercure. BASF produit actuellement l'acide via un processus en deux étapes dans lequel le méthanol et le soufre élémentaire réagissent pour donner du disulfure de diméthyle, qui est ensuite oxydé en produit final.
Pendant des décennies, les chimistes ont essayé de trouver un moyen de préparer de l'acide méthanesulfonique à partir de méthane et de trioxyde de soufre dans des conditions beaucoup plus douces que celles utilisées dans la méthode originale. En 2015, Grillo-Werke (Duisburg, Allemagne), dans une demande de brevet mondiale, a décrit la préparation d'acides alcanesulfoniques à partir d'alcanes et de SO3 en présence d'un peroxyde organique à des températures allant jusqu'à 65 °C et des pressions allant jusqu'à 11 MPa. Finalement, Grillo a annoncé son intention de concurrencer BASF en construire une usine pour produire de l'AMS avec un procédé qui est probablement basé sur ce brevet.
La souche TR3 de Marinosulfonomonas methylotropha est un méthylotrophe marin qui utilise l'acide méthanesulfonique (AMS) comme seule source de carbone et d'énergie. Les gènes de la souche TR3 de M. methylotropha codant pour la méthanesulfonate monooxygénase, l'enzyme responsable de l'oxydation initiale de l'AMS en formaldéhyde et sulfite, ont été clonés et séquencés. Ils étaient situés sur deux groupes de gènes sur le chromosome de cette bactérie.
Système d'acide méthanesulfonique
L'acide méthanesulfonique avec une acidité élevée n'est pas seulement le catalyseur dans le processus d'acylation de la chitine, mais est également un bon solvant pour la chitine partiellement acylée. Ainsi, une acylation homogène de la chitine peut être obtenue dans le système d'acide méthanesulfonique.
De la chitine acétylée est obtenue en mélangeant de la chitine, de l'acide méthanesulfonique et de l'acide acétique glacial selon différents rapports molaires. Ensuite, il faut laisser réagir à 0 °C pendant une nuit complète. Dans cette expérience, une phase homogène se forme progressivement au fur et à mesure que la réaction progresse, ce qui contribue à une acylation supplémentaire. Cette réaction doit être maintenue à basse température pour éviter la dégradation de la chitine dans des conditions acides.
L'agent d'acylation n'est pas limité à l'acide carboxylique mais également au chlorure d'acide.
De la chitine acylée est obtenue en mélangeant la chitine, l'acide méthanesulfonique et le chlorure d'acide, puis le mélange est mis à réagir à 0 °C pendant 2 h, suivi d'une réaction d'une nuit à -20 °C. En modifiant le type et la quantité molaire de chlorure d'acide, l'hexanoylation, l'acylation d'oxime et l'acylation de dodécyle de la chitine peuvent être obtenus. Dans ce processus, la cristallinité de la chitine peut être efficacement détruite par une acylation supplémentaire en réagissant à -20 °C pendant la nuit.
En général, la capacité d'acylation du chlorure d'acide est supérieure à celle de l'acide carboxylique. Plus le groupe d'acylation est grand, plus les dommages à la région cristalline de la chitine sont importants.
Diméthylsulfoxyde et acide méthanesulfonique
Le diméthylsulfoxyde (DMSO) et l'acide méthanesulfonique (AMS) sont deux des produits d'oxydation organiques les plus importants du sulfure de diméthyle (DMS). Il n'est pas tout à fait clair comment l'acide méthanesulfonique, CH3S(O)(O)(OH), se forme, mais l'acide méthanesulfinique, CH3S(O)(OH)CH3, a été signalé lors de l'oxydation dans les systèmes OH-DMS. Une addition supplémentaire d'OH à l'acide méthanesulfinique, suivie d'une réaction avec l'oxygène, peut donner de l'acide méthanesulfonique.
À des températures plus basses trouvées dans l'Arctique, il existe une grande variété de produits d'oxydation du DMS qui comprennent l'AMS, le DMS et la diméthylsulfone, CH3S(O)(O)CH3.
Bien que le DMS ne soit que modérément soluble dans l'eau de pluie, il y a eu un certain intérêt pour l'oxydation en phase liquide, où la modélisation suggère que les réactions multiphasiques peuvent être importantes. L'ozone semble être l'oxydant le plus important, où il y a une durée de vie prévue pour le DMS de quelques jours dans les nuages. Les réactions d'oxydation offrent la possibilité à ces processus hétérogènes de produire des composés soufrés oxydés plus solubles, tels que le DMSO et le DMSO2.
Les concentrations de DMSO ont été mesurées dans le sud de l'océan Indien avec des rapports de mélange allant de 0,3 à 5,8 ppt. En règle générale, les concentrations de DMSO dans l'air représentent environ 1 à 2 % des concentrations de DMS dans l'air. Il existe un cycle saisonnier avec un minimum en hiver et un maximum en été similaire à celui observé pour le DMS atmosphérique. Il existe également un cycle diurne pour le DMSO avec des valeurs maximales vers 09h00 et des valeurs minimales pendant la nuit, ce qui implique des réactions OH avec le DMS comme source importante. Le DMSO étant soluble se trouve également dans l'eau de pluie avec des concentrations de 7,0 à 369 nM et un maximum saisonnier en été suivant à peu près le même schéma que le DMS dans l'atmosphère.
Le DMSO peut être facilement éliminé sur des particules et là, il peut subir une oxydation efficace jusqu'au méthanesulfonate. Cela ajoute une voie importante à la production en phase gazeuse d'acide méthanesulfonique, qui est présent en grande partie dans la fraction d'aérosol submicronique. Les concentrations estivales maximales sont de 0,6 ± 0,3 nmol/m3 et parfois cela peut représenter près d'un quart du sulfate autre que le sel marin dans l'atmosphère marine éloignée.
Le DMSO est également oxydé en SO2, qui peut ensuite être converti en sulfate sans sel marin. Le rendement varie probablement de 50 % à 100 % sous les tropiques avec le potentiel qu'il soit légèrement inférieur, peut-être 20 à 40 % aux latitudes moyennes.
Synonymes, antonymes
Voir tous les synonymes pour "acide méthanesulfonique".2 synonymes (sens proche) de "acide méthanesulfonique" :
- acide mésylique
- acide méthylsulfonique
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ACIDE MÉTHANESULFONIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ACIDE METHANESULFONIQUE est dans la page 2 des mots en A du lexique du dictionnaire.
Mots en A à proximité
acide lactique acide linoléique acide lipoïque acide lipotéichoïque acide malique acide méthanesulfoniqueacide méthylsulfonique acide mévalonique acide minéral acide muginéique acide N-acétylmuramique
En rapport avec "acide méthanesulfonique"
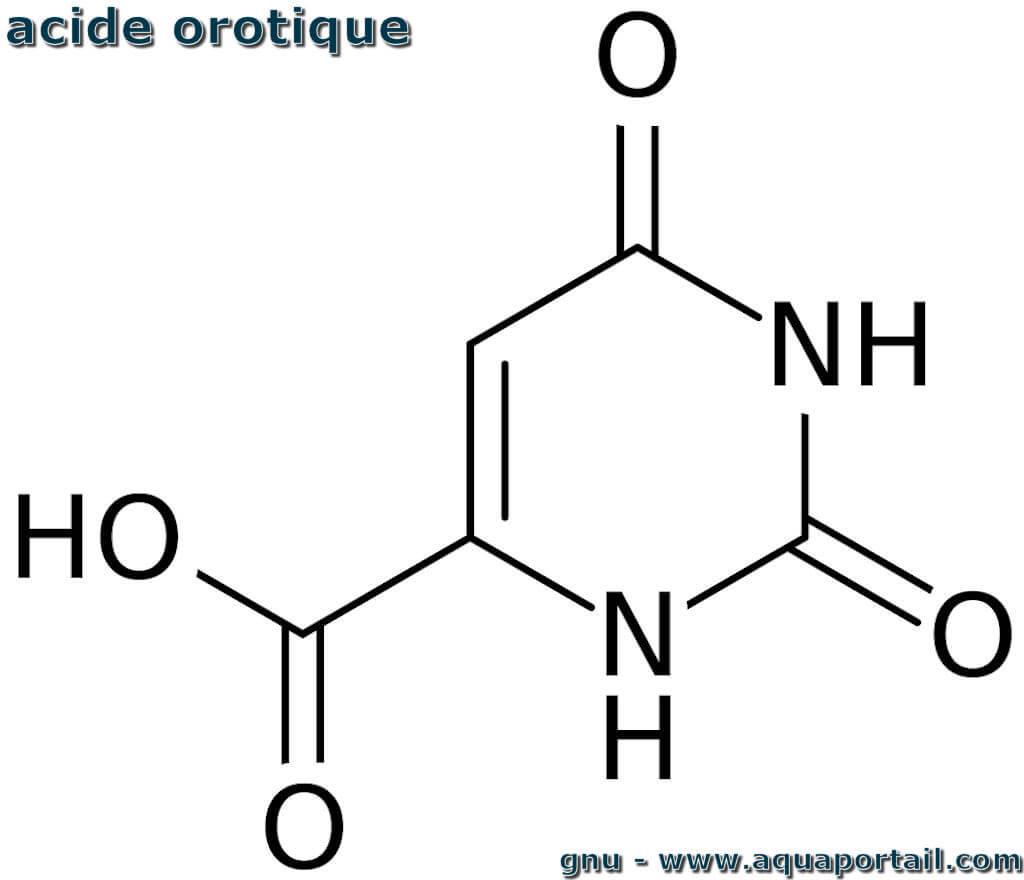
Un acide orotique désigne un métabolite intermédiaire de la biosynthèse des bases pyrimidiques, un dérivé de pyrimidine et un intermédiaire dans la biosynthèse...
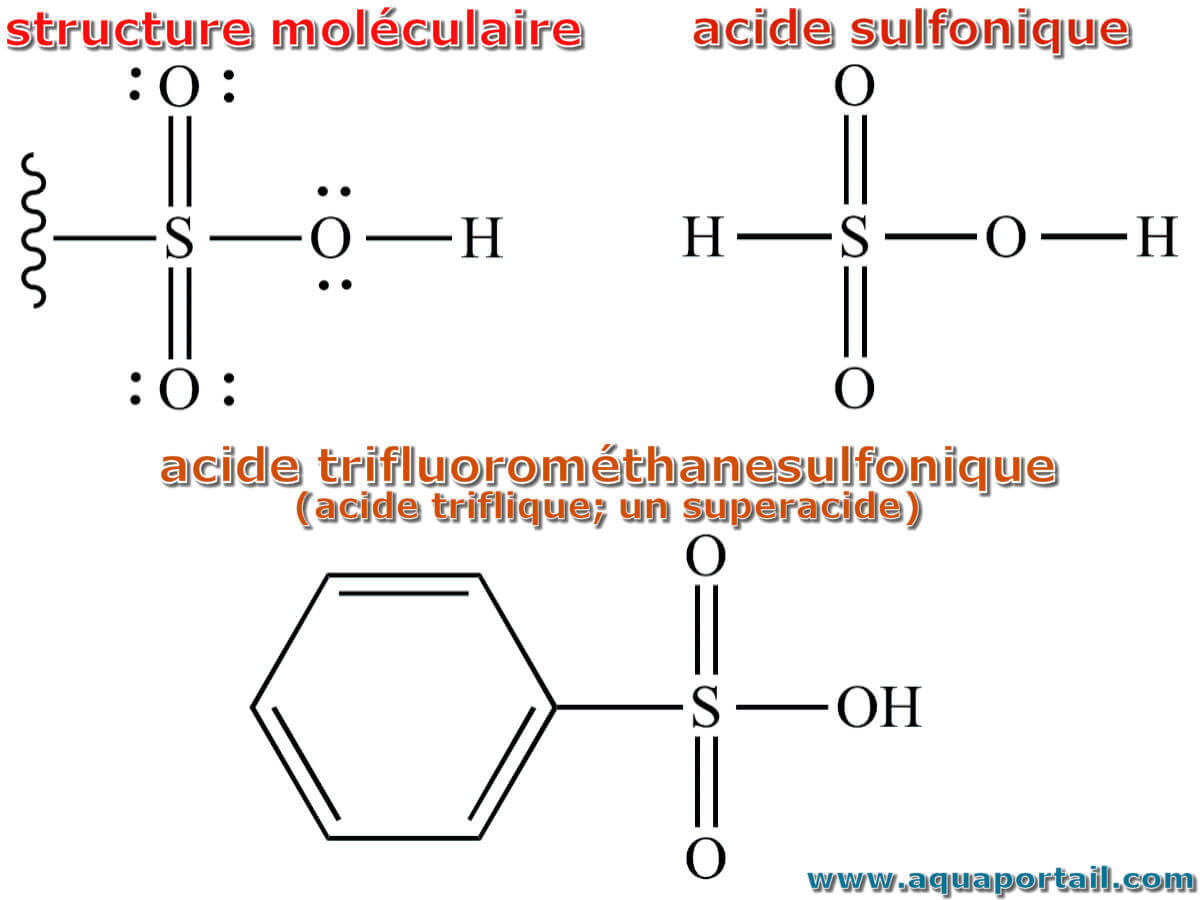
L'acide sulfonique est un acide fort avec un groupe fonctionnel caractérisé par un atome de soufre doublement lié à deux atomes d'oxygène, un groupe hydroxyle...

Les lignosulfonates sont des macromolécules hautement ramifiées et sont formés d'unités phénylpropane reliées de manière non régulière par des liaisons éther...

Le méthane CH₄ est l'hydrocarbure le plus simple et appartient au groupe des alcanes. Il est un gaz à température et à pression atmosphérique ambiante.
