Titrage
Définition
Le titrage ou la titrimétrie est une méthode d'analyse chimique quantitative en laboratoire utilisée pour déterminer la concentration inconnue d'un réactif à partir d'un réactif de concentration connue. Parce que les mesures de volume jouent un rôle fondamental dans les titrages, on parle aussi d'analyse volumétrique.
Un réactif appelé titrant, de volume et de concentration connus (typiquement en solution étalon) est utilisé pour réagir avec une solution de l'analyte (espèce titrée) de concentration inconnue.
Un titrage acide-base :
Le titrage acide-base est une analyse quantitative de la concentration d'une solution d'acide ou de base inconnue.
Explications
Attention, le terme titration est un faux-ami en français, issu de traduction anglo-saxonne, qui n'a rien à voir avec un titrage en chimie analytique ! La titration (titration à la morphine par exemple) est une méthode médicale en médecine clinique qui consiste à soulager la douleur sévère d'un patient grâce à la morphine avec un respect de la posologie et utilisation d'une fiche de surveillance.
Voir aussi le titrage biologique (ci-dessous).
Principe d'évaluation
Il existe différents types d'évaluations. De nombreuses méthodes peuvent être utilisées pour indiquer le point final d'une réaction : des indicateurs visuels sont souvent utilisés (ils changent de couleur). Dans un titrage acide-base simple, un indicateur de pH tel que la phénolphtaléine, qui est normalement incolore mais acquiert une couleur rose lorsque le pH est égal ou supérieur à 8,2, peut être utilisé. Un autre exemple est l'orange de méthyle, le rouge en milieu acide et le jaune en solution basique. Tous les degrés n'exigent pas d'indicateur. Dans certains cas, les réactifs ou les produits sont fortement colorés et peuvent servir d'indicateur. Par exemple, un titrage ou un titrage redox utilisant du permanganate de potassium comme solution standard (rose/violet) ne nécessite pas d'indicateur car il subit un changement de couleur facile car il reste incolore lorsque le permanganate est réduit. Après le point d'équivalence, il y a un excès de solution de titrant (permanganate) et une couleur rose faible persiste qui ne disparaît pas.
En raison de la nature logarithmique de la courbe de pH, les transitions au point final sont très rapides; puis, une simple goutte peut modifier le pH de façon très significative et provoquer un changement de couleur dans l'indicateur. Il y a une légère différence entre le changement de couleur de l'indicateur et le point d'équivalence du titrage ou de l'évaluation. Cette erreur est appelée erreur d'indicateur. Pour cette raison, il est conseillé de faire des déterminations vierges avec l'indicateur et de soustraire le résultat du volume dépensé dans l'évaluation.
Préparation d'un échantillon pour le titrage ou l'évaluation
Dans un titrage, la substance étalon et l'analyte doivent être en phase liquide (ou en solution). Si l'échantillon n'est pas un liquide ou une solution, il doit être dissous. Si l'analyte est très concentré dans l'échantillon à analyser, il est généralement dilué. Bien que la grande majorité des titrages soient effectués en solution aqueuse, d'autres solvants tels que l'acide acétique ou l'éthanol ayant le même objectif peuvent être utilisés pour certaines analyses.
Une quantité mesurée d'échantillon est placée dans un bocal où elle est dissoute et diluée si nécessaire. Le résultat mathématique de la valorisation peut être calculé directement par la quantité de la valeur mesurée. Lorsque l'échantillon a été dissous ou dilué avant le titrage, la quantité de solvant utilisée pour dissoudre ou diluer doit être bien connue (il s'agit généralement d'un coefficient entier) pour pouvoir le considérer dans le résultat mathématique de l'évaluation initiale de l'échantillon. De nombreux titrages nécessitent un certain contrôle du pH de la réaction. Pour cela, des solutions tampons ajoutées dans le ballon de la solution à analyser sont utilisées pour maintenir le pH de la solution. Dans d'autres cas, un certain ion doit être masqué : cela est nécessaire lorsqu'il y a deux réactifs dans l'échantillon qui peuvent réagir avec la substance étalon et que l'on veut seulement évaluer l'un d'entre eux ou lorsque la réaction peut être inhibée ou altérée. Il procède en ajoutant une autre solution à l'échantillon pour masquer ou séquestrer l'ion indésirable, en formant une liaison faible avec lui ou même en formant une substance insoluble. Certaines réactions redox peuvent nécessiter de chauffer la solution avec l'échantillon et de titrer pendant qu'il est encore chaud (pour augmenter la vitesse de réaction).
Par exemple, l'oxydation de certaines solutions d'oxalate nécessite de chauffer la solution à environ 60 °C pour maintenir une vitesse de réaction adéquate.
Procédure
Un titrage ou une analyse volumétrique commence par un bécher ou un erlenmeyer contenant un volume précis du réactif à analyser et une petite quantité d'indicateur placé sous une burette contenant la solution étalon. En contrôlant soigneusement la quantité ajoutée, il est possible de détecter le point auquel l'indicateur change de couleur. Si l'indicateur a été choisi correctement, cela devrait également être le point de neutralisation des deux réactifs.
En lisant à l'échelle de la burette, nous connaîtrons précisément le volume de solution ajouté. Comme la concentration de la solution étalon et le volume ajouté sont connus, on peut calculer le nombre de moles de cette substance. Ensuite, à partir de l'équation chimique qui représente le processus qui a lieu, nous pouvons calculer le nombre de moles de la substance à analyser présentes dans l'échantillon. Enfin, en divisant le nombre de moles de réactif par son volume, nous connaîtrons la concentration recherchée.
Courbes d'évaluation
Les évaluations sont représentées par des courbes de valorisation dans lesquelles le volume de solution standard, titrant ou standard est généralement représenté comme une variable indépendante, tandis que la variable dépendante est la concentration de l'analyte dans la phase de valorisation correspondante (dans une évaluation acido-basique). c'est généralement le pH de la solution qui change en fonction de la composition des deux solutions).
Dans le cas des titrages acide-base, les courbes de titrage reflètent la force de l'acide et de la base correspondants. Par exemple, dans une évaluation d'acide fort avec une base faible, la courbe d'évaluation sera relativement lisse, bien que très raide pour les points proches du point d'équivalence de la valorisation. Dans ce cas, de petits changements dans le volume de titrant produisent de grands changements de pH près du point d'équivalence. Dans ce cas, un large éventail d'indicateurs serait approprié (par exemple tournesol, phénolphtaléine ou bleu de bromothymol). En revanche, si l'un des composants d'une titration acide-base est un acide faible ou une base faible et l'autre un acide fort ou une base forte, la courbe de titrage est nettement irrégulière près du point d'équivalence (et le pH ne change pas "autant" avec l'addition de petits volumes de titrant).
À titre d'exemple, la courbe de valorisation de l'acide oxalique (un acide faible) avec de l'hydroxyde de sodium (une base forte) est montrée dans l'image précédente. Ici, le point d'équivalence se situe à un pH compris entre 8 et 10, et donc l'analyte est basique au point d'équivalence (plus précisément, l'ion hydroxyde subit une réaction d'hydrolyse dans l'eau produisant des ions hydroxyde). Un indicateur tel que la phénolphtaléine serait approprié pour cette évaluation particulière. La courbe de titrage correspondant à une évaluation d'une base faible avec un acide fort se comporte de manière analogue, en obtenant une solution acide au point d'équivalence. Dans ce cas, des indicateurs tels que l'orange de méthyle ou le bleu de bromothymol sont couramment utilisés. D'autre part, les titrages acide-base dans lesquels les composants sont une base et un acide faible sont de nature assez irrégulière. En raison de la nature de ces évaluations, il n'y a pas d'indicateur chimique approprié et, par conséquent, le pH-mètre est souvent utilisé.
La méthode d'évaluation rétrospective est utilisée lorsque la signification de l'évaluation est inversée, en changeant la substance à évaluer. Au lieu d'évaluer l'analyte d'origine, un excès connu de réactif standard est ajouté à la solution, puis l'excès est évalué. Cette méthode est utile si le point final du titrage vers l'arrière est plus facile à identifier que le point final du titrage normal. Il est également utilisé si la réaction entre l'analyte et le réactif est extrêmement lente.
Types de titrages
Les évaluations par titrage sont classées par type d'objet à analyser :
- Titrages acide-base : basés sur la réaction de neutralisation entre l'analyte et une solution de référence d'acide ou de base. Pour déterminer le point final, utilisez un indicateur de pH, un pH-mètre ou un conductimètre.
- Titrages redox : basés sur la réaction d'oxydoréduction ou la réaction redox entre l'analyte et un oxydant de référence ou une solution réductrice. Pour déterminer le point final, utiliser un potentiomètre ou un indicateur redox, bien que parfois la substance à analyser ou la solution de référence standard aient une couleur suffisamment intense pour qu'un indicateur supplémentaire ne soit pas nécessaire.
- Formation de complexes ou titrages complexométriques : basés sur la réaction de formation d'un complexe entre l'analyte et la substance titrant. L'agent chélatant l'EDTA est largement utilisé pour titrer les ions métalliques en solution. Ces évaluations nécessitent généralement des indicateurs spécialisés qui forment des complexes plus faibles avec l'analyte. Un exemple est l'Eriochrome Black T pour le titrage des ions de calcium, de magnésium ou de cuivre (II).
- Évaluation des précipitations : celles basées sur les réactions de précipitation L'un des types les plus courants est l'argentométrie.
Titrage biologique
Le titrage biologique consiste en un bioessai de l'analyse biologique réalisée sur des cellules ou organismes vivants, pour détecter parfois des quantités infimes de substances qui influent sur la croissance.
Le titrage biologique consiste alors en une estimation quantitative de substances biologiquement actives, par exemple l'estimation de l'acide indole acétique (AIA) produit par Azotobacter. Le titrage biologique est un terme qui, par définition, est utilisé pour l'évaluation de la toxicité basée sur l'utilisation de différents organismes, en incluant un paramètre tel que la demi-vie du produit. Voir aussi écotoxicologie.
Le titrage américain est un système de référence de longueur de fil de filet par unité de poids, soit en mètres par kilogramme, soit en yards par livre; par exemple, un titrage de 4 000 m/kg.
Synonymes, antonymes
2 synonymes (sens proche) de "titrage" :
- analyse volumétrique
- titrimétrie
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à TITRAGE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot TITRAGE est dans la page 3 des mots en T du lexique du dictionnaire.
Mots en T à proximité
tissu nodal tissu osseux tissu ostéoïde tissu secondaire tissu végétal titragetitrage biologique titrant toile à bluter toise toit optique
En rapport avec "titrage"

Le densimètre est un appareil qui mesure une densité relative d'un fluide, typiquement la salinité de l'eau de mer.

Une hydrotimétrie est une mesure de la dureté d'une eau ou d'une solution aqueuse par dosage de ses sels de calcium et de magnésium.
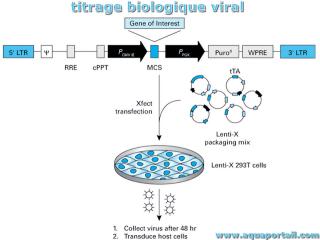
Le titrage biologique consiste en un bioessai de l'analyse biologique réalisée sur des cellules ou organismes vivants, pour détecter parfois des quantités...
