Point d'ébullition
Définition
Le point d'ébullition est la température à laquelle une substance passe de l'état liquide à l'état gazeux. Il correspond à la température à laquelle la pression de vapeur du liquide est égale à celle de l'atmosphère à laquelle il est soumis.
De l'eau à son point d'ébullition :
La définition formelle du point d'ébullition (ici de l'eau bouillante) est la température à laquelle la pression de vapeur du liquide est égale à la pression de vapeur du milieu dans lequel il se trouve. En langage courant, on dit que c'est la température à laquelle la matière passe de l'état liquide à l'état gazeux.
Explications
Le point d'ébullition, notamment pour l'eau bouillante, est le moment où un liquide bout et passe à l'état de vapeur (à pression constante). La température d'ébullition peut être comprise comme la période d'un processus dans lequel un liquide subit un changement de phase, réduisant sa fraction à l'état liquide et augmentant sa fraction à l'état gazeux, étant donné les conditions limitrophes comme la pression atmosphérique et le taux de chaleur, le plus rapidement possible, généralement en observant la formation rapide de bulles de gaz dans le liquide.
Ces bulles, émergeant à la surface, se dispersent dans la phase gazeuse. Habituellement, le point d'ébullition se rapporte également à la température (ou aux températures) à laquelle cette condition intervient.
Voir aussi la vapeur d'eau, la vapeur atmosphérique et le point de condensation (phénomène inverse quand le gaz passe à l'état liquide).
Température d'ébullition
La température d'une substance ou d'un corps dépend de l'énergie cinétique moyenne des molécules. À des températures inférieures au point d'ébullition, seule une petite fraction des molécules sur la surface a suffisamment d'énergie pour rompre la tension de surface et s'échapper. Cette augmentation d'énergie constitue un échange de chaleur qui entraîne l'augmentation de l'entropie du système (tendance au désordre des particules qui composent votre corps).
La température d'ébullition est, d'une certaine façon par rapport à la congélation, l'inverse du point de congélation.
Le point d'ébullition dépend de la masse moléculaire de la substance et du type de forces intermoléculaires de cette substance. Pour ce faire, il faut déterminer si la substance est polaire covalente, covalente non polaire, et déterminer le type de liaisons (liaisons dipolaires ou hydrogènes permanentes induites par le dipôle).
Le point d'ébullition ne peut pas augmenter indéfiniment. Au fur et à mesure que la pression augmente, la densité de la phase gazeuse augmente jusqu'à devenir, finalement, indiscernable de la phase liquide avec laquelle elle est en équilibre; c'est la température critique, au-dessus de laquelle il n'y a pas de phase liquide claire. L'hélium a le point d'ébullition normal le plus bas (-268,9 °C), proche de la température du zéro absolu pour n'importe quelle substance, et le carbure de tungstène, l'un des plus élevés (5555 °C).
Le point d'ébullition d'un liquide varie en fonction de la pression de l'environnement qui l'entoure. Un liquide sous vide partiel a un point d'ébullition inférieur à celui d'un liquide à pression atmosphérique. Un liquide à haute pression a un point d'ébullition plus élevé qu'à pression atmosphérique.
Point d'ébullition standard
Dans les tableaux thermodynamiques des produits chimiques, le diagramme de phase complet n'est pas indiqué, seulement la température d'ébullition dans l'état standard, c'est-à-dire avec une pression d'une atmosphère (1013,25 hPa). Ce point d'ébullition est appelé le point d'ébullition standard (ou "point d'ébullition atmosphérique") et la température est la température d'ébullition standard ou normale. L'expression "point d'ébullition" est souvent utilisé pour désigner le point d'ébullition normal standard.
Les températures d'ébullition standard du tableau périodique :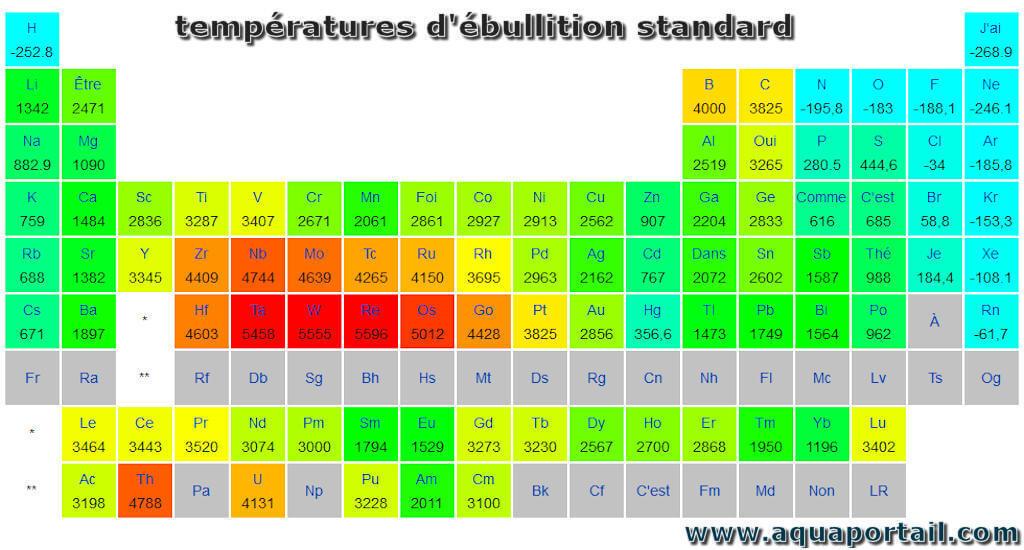
Le tableau suivant montre les températures d'ébullition à l'état standard (1 atm) en °C. Le point d'ébullition normal peut être calculé en utilisant la formule de Clausius-Clapeyron; elle fait entrer en jeu la température en Kelvin, la constante de gaz, la pression de vaporisation et l'enthalpie de vaporisation.
Par exemple, l'eau bout à 100 °C au niveau de la mer, mais à 93,4 °C à 1 900 mètres d'altitude. Pour une pression donnée, différents liquides vont bouillir à différentes températures.
Le point d'ébullition normal (ou standard à la pression atmosphérique) d'un liquide est le cas particulier dans lequel la pression de vapeur du liquide est égale à la pression atmosphérique définie au niveau de la mer, 1 atmosphère. À cette température, la pression de vapeur du liquide devient suffisante pour vaincre la pression atmosphérique et permettre aux bulles de vapeur de se former dans la majeure partie du liquide. Depuis 1982, l'IUPAC définit le point d'ébullition standard comme la température à laquelle l'ébullition intervient sous une pression de 1 bar.
Propriétés des éléments
L'élément dont le point d'ébullition est le plus bas est l'hélium He. Les points d'ébullition du rhénium et du tungstène dépassent 5 000 K à la pression standard. Comme il est difficile de mesurer les températures extrêmes avec précision, sans biais, les deux auteurs ont cité dans la littérature l'avoir un point d'ébullition plus élevé.
Le point critique d'un liquide est la température (et la pression) la plus élevée à laquelle il va réellement bouillir.
Vaporisation, évaporation
La chaleur de vaporisation est l'énergie nécessaire pour transformer une quantité donnée d'un liquide (une mole, un kilo, un litre, etc.) d'un liquide en un gaz à une pression donnée.
Le processus d'évaporation permet de transformer les liquides en vapeur à des températures inférieures à leurs points d'ébullition. L'évaporation est un phénomène de surface dans lequel des molécules situées près du bord du liquide, qui ne sont pas contenues par une pression de liquide suffisante sur ce côté, s'échappent dans l'environnement sous forme de vapeur. En revanche, l'ébullition est un processus au cours duquel des molécules de n'importe quelle partie du liquide s'échappent, entraînant la formation de bulles de vapeur dans le liquide.
Synonymes, antonymes
Voir tous les synonymes pour "point d'ébullition".2 synonymes (sens proche) de "point d'ébullition" :
- température d'ébullition
- température de vaporisation
4 antonymes (sens contraire) :
- point de condensation
- point de congélation
- point de fusion
- Voir la suite...
Les mots ou les expressions apparentés à POINT D'ÉBULLITION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression POINT D'EBULLITION est dans la page 6 des mots en P du lexique du dictionnaire.
Mots en P à proximité
poïkilotherme poil point amphidromique point chaudpoint critique point d'ébullitionpoint de compensation point de congélation point de flétrissement point de jauge point de repère
En rapport avec "point d'ébullition"

En hydraulique, le débit de pointe précise le débit maximal instantané d'un hydrogramme donné (GIH), illustré dans un débit de projet.

L'ébullition est le processus de passage d'un liquide à l'état de vapeur en formant, sous l'action de la chaleur des bulles de gaz qui remontent à la surface.

La maladie du point blanc, en aquarium, distingue essentiellement 3 sources de maladies : l'ichthyophthirius (ichthio, ick), l'oodinium (maladie appelée...

Un point amphidromique est défini pour une composante de la marée, même s'il existe cependant des exceptions.
