Carbonate de calcium
Définition
Le carbonate de calcium (CaCO3) est un composé naturellement présent sous forme de roche calcaire, caractérisé par sa couleur blanchâtre. Ce matériau, obtenu par broyage, trouve une application importante dans les procédés de chaulage. Par ailleurs, le carbonate de calcium joue un rôle crucial dans le développement des coquilles des mollusques, des coraux durs et des coquillages.
Cailloux de carbonate de calcium CaCO3 à l'état naturel :
Présent naturellement, le carbonate de calcium CaCO3 est extrait sous forme de cailloux près à être concassés, ici sous forme de calcaire pour l'industrie papetière avec un degré de blancheur de 75–85 %.
Explications
Doté de la formule chimique CaCO3 et d'une masse molaire de 100,1 g/mol, le carbonate de calcium est constitué de trois éléments fondamentaux : le carbone, l'oxygène et le calcium.
Poudre de carbonate de calcium précipité :
L'industrie exploite le carbonate de calcium sous forme de poudre pour fabriquer des additifs alimentaires ou médicamenteux, ici en bonne pureté avec 97,5 à 98 % de calcaire et un volume de sédimentation ≥ 2.8 ml/g, largement utilisé pour la peinture, le caoutchouc, la fabrication du papier, plastique, etc.
Le carbonate de calcium est une substance largement répandue dans les formations géologiques à travers le monde, et constitue l'un des principaux composants des coquilles et coquillages des organismes marins, ainsi que des escargots, perles, boules de charbon et coquilles d'oeufs.
Ce composé est également l'ingrédient actif de la chaux agricole, se formant lorsque les ions Ca présents dans l'eau dure interagissent avec des ions carbonates pour former des dépôts calcaires. Sur le plan médical, il est communément utilisé comme supplément de calcium ou antiacide; toutefois, une consommation excessive peut engendrer des effets indésirables.
Voir la carbonatation et l'équivalent en carbonate de calcium.
Modèle d'une partie de la structure cristalline du carbonate de calcium CaCO3 :
Le carbonate de calcium partage les propriétés typiques des autres carbonates.
Les réactions chimiques du calcaire sont notamment :
- il réagit avec les acides forts, en libérant du dioxyde de carbone :
CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
- il libère du dioxyde de carbone en chauffant, appelé décomposition thermique réaction, ou une calcination, au-dessus de 840 °C dans le cas de CaCO3, pour former l'oxyde de calcium, communément appelé chaux vive CaO, avec réaction enthalpie mesurée à 178 kJ/mole :
CaCO3(s) → CaO(s) + CO2(g)
- le carbonate de calcium réagit avec l'eau qui est saturé avec du dioxyde de carbone pour former le soluble dans du bicarbonate de calcium :
CaCO3 + CO2 + H2O → Ca(HCO3)2
Cette dernière réaction est importante dans l'érosion des roches carbonatées, formant des cavernes, et conduit à l'eau dure dans de nombreuses régions.
Une variante hydratée du carbonate de calcium, connue sous le nom d'ikaïte (CaCO3·6H2O), représente une forme unique contenant de l'eau cristalline. Ce minéral demeure stable uniquement à des températures inférieures à 6 °C.
Sources de CaCO3
Dans l'industrie, la majorité du carbonate de calcium provient de l'extraction minière ou des carrières. Cependant, pour répondre aux exigences alimentaires ou pharmaceutiques, une version pure, généralement extraite du marbre, peut être utilisée. Alternativement, le carbonate de calcium peut être synthétisé à partir d'oxyde de calcium (CaO). L'ajout d'eau à l'oxyde de calcium forme de l'hydroxyde de calcium, auquel on introduit du dioxyde de carbone pour précipiter le carbonate de calcium. Ce procédé est essentiel à la production industrielle du carbonate de calcium précipité (PCC) :
CaCO3 → CaO + CO2
CaO + H2O → Ca(OH)2
Ca(OH)2 + CO2 → CaCO3 + H2O
Sur le plan géologique, les principales formes minérales du carbonate de calcium pur comprennent la calcite, l'aragonite et la vatérite. Les roches mères d'importance industrielle incluent principalement le calcaire, la craie, le marbre et le travertin.
Enfin, des sources biologiques telles que les coquilles d'oeufs, les coquilles d'escargots et la majorité des coquillages, dont les valves sont essentiellement constituées de carbonate de calcium, sont également exploitées comme matières premières industrielles. Les coquilles d'huîtres ont récemment attiré une attention particulière en tant que source potentielle de calcium alimentaire tout en constituant également une ressource industrielle utile. Bien que moins adaptées à des utilisations industrielles directes, certains légumes verts à feuilles comme le brocoli ou le chou frisé contiennent également du carbonate de calcium en quantités significatives sur le plan nutritionnel.
Synonymes, antonymes
Voir tous les synonymes pour "carbonate de calcium".0 synonyme (sens proche) pour "carbonate de calcium".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à CARBONATE DE CALCIUM sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression CARBONATE DE CALCIUM est dans la page 2 des mots en C du lexique du dictionnaire.
Mots en C à proximité
carbocation carbohémoglobine carbonacé carbonatation carbonate carbonate de calciumcarbone carbone inorganique carbone inorganique dissous carbone organique carbone organique assimilable
En rapport avec "carbonate de calcium"

L'ion bicarbonate (ou ion mono-hydrogénocarbonate) est un anion de formule chimique HCO₃−.

La carbonatation est une réaction chimique dans laquelle l'hydroxyde de calcium réagit avec le dioxyde de carbone pour former du carbonate de calcium insoluble...

Un carbonate, en chimie, est un sel de l'acide carbonique, caractérisé par la présence de l'ion carbonate, CO₃²⁻.
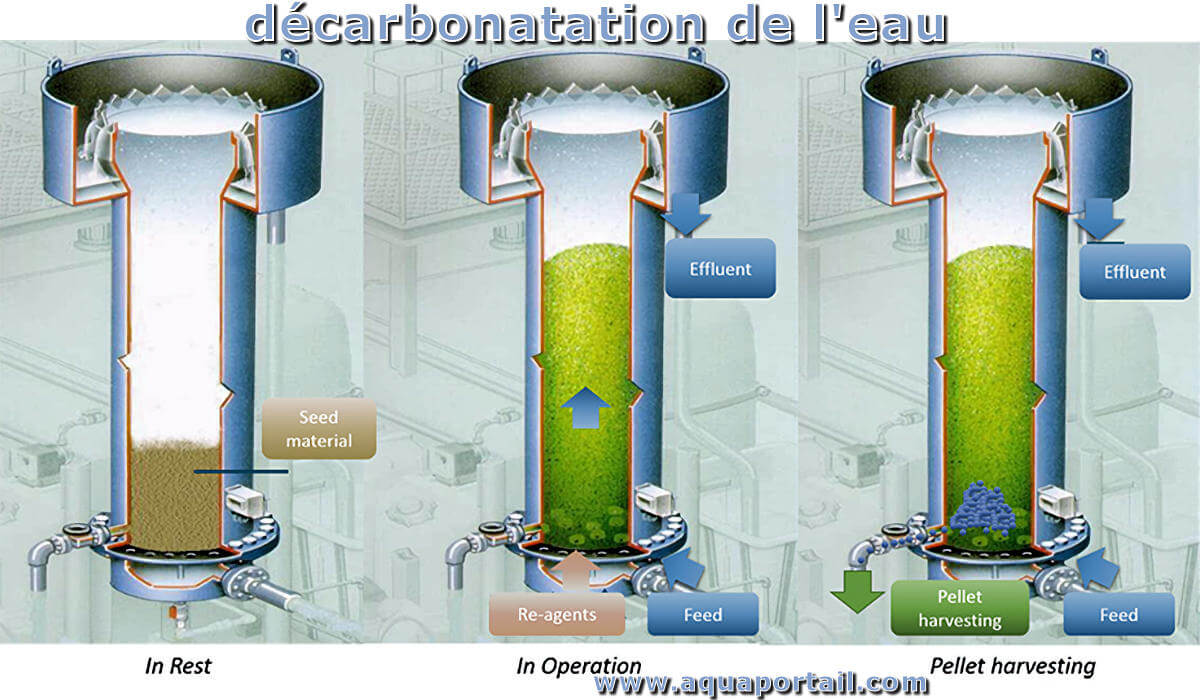
La décarbonatation est le processus par lequel les carbonates contenus dans un milieu sont progressivement dissous par des eaux chargées de gaz carbonique...
