Masse atomique
Définition
La masse atomique est la masse d'un atome, en relation avec le poids atomique d'un élément chimique de la table périodique ou d'un composé chimique plus complexe. Elle s'exprime en g/mol (gramme par mole). L'addition de masses atomiques d'une molécule donne son poids moléculaire.
L'oxygène et sa masse atomique :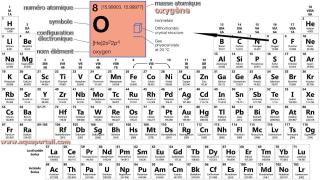
Détails de l'oxygène avec sa masse atomique, son numéro atomique, etc., extraits d'une table périodique.
Explications
La masse atomique peut être considérée comme la masse totale des protons et des neutrons (puisque la masse des électrons dans l'atome est pratiquement négligeable) en un seul atome (lorsque l'atome n'a pas de mouvement).
La masse atomique est parfois incorrectement utilisée comme synonyme de la masse atomique relative, de la masse atomique moyenne et du poids atomique; ceux-ci diffèrent subtilement de la masse atomique. La masse atomique est fréquemment appelée le nombre de masse.
Masse isotopique
La masse atomique est définie comme la masse d'un atome, qui ne peut être qu'un isotope à la fois et n'est pas une moyenne pondérée de l'abondance des isotopes.
Dans le cas de nombreux éléments qui ont un isotope dominant, la similitude/différence numérique réelle entre la masse atomique de l'isotope le plus commun et la masse atomique relative ou le poids atomique standard peut être très faible, de sorte qu'elle n'affecte pas beaucoup de calculs grossiers, mais une telle erreur peut être critique pour des atomes individuels.
Pour les éléments contenant plus d'un isotope commun, la différence peut être d'une demi-unité ou plus (par exemple, le chlore). La masse atomique d'un isotope rare peut différer de la masse atomique relative ou du poids atomique standard en plusieurs unités de masse.
La masse isotopique relative est la masse relative d'un isotope donné (plus spécifique, tout nucléide seulement), mise à l'échelle avec exactement 12 atomes de carbone. Il n'y a pas d'autres nucléides autres que le carbone 12 qui ont exactement une masse entière.
Cela est dû à deux facteurs : la masse différente de neutrons et de protons qui agissent pour modifier la masse totale dans les nucléides avec des rapports proton/neutron autres que le rapport 1 : 1 du carbone-12; et un nombre exact ne sera pas trouvé s'il y a une perte de masse/gain différente de l'énergie de liaison nucléaire par rapport à l'énergie de liaison nucléaire moyenne du carbone-12.
Cependant, tout défaut de masse dû à la L'énergie de liaison nucléaire est une petite fraction (inférieure à 1 %) comparée à la masse d'un nucléon (encore moins comparée à la masse moyenne par nucléon au carbone-12, qui est modérément à fortement liée), et étant donné que les protons et les neutrons diffèrent en masse les uns des autres par une petite fraction (environ 0,0014 uma), la pratique consistant à arrondir la masse atomique de n'importe quel nucléide donné ou isotope au nombre entier le plus proche, donne toujours l'entier simple de la somme totale les nucléons.
Le nombre de neutrons peut être calculé en soustrayant le nombre atomique.
Par exemples, la masse atomique de l'hydrogène H est 1,0079 g/mol, celle du sodium Na 22,99 g/mol et celle du fer Fe est 55,845 g/mol.
Poids atomique
Le poids atomique standard se réfère à la moyenne des masses atomiques relatives d'un élément dans l'environnement local de la croûte terrestre et de l'atmosphère (atmosphère terrestre), telle que déterminée par la Commission sur les poids atomiques et les abondances isotopiques (Commission des poids atomiques et des abondances isotopiques) de l'UICPA.
Ces valeurs sont celles qui sont incluses dans un tableau périodique standard, et c'est ce qui est le plus utilisé pour les calculs ordinaires. Une incertitude entre parenthèses est incluse qui reflète souvent la variabilité naturelle de la distribution isotopique, au lieu de l'incertitude dans la mesure.
Pour les éléments synthétiques, l'isotope formé dépend des milieux de synthèse, de sorte que le concept d'abondance isotopique naturelle n'a pas de sens. Par conséquent, pour les éléments synthétiques, le nombre total de nucléons de l'isotope le plus stable (c'est-à-dire l'isotope dont la demi-vie est la plus longue) est indiqué entre parenthèses à la place du poids atomique standard.
Le lithium représente un cas unique où l'abondance naturelle des isotopes a été perturbée par les activités humaines au point d'affecter l'incertitude de leur poids atomique standard, même dans les échantillons provenant de sources naturelles, telles que les rivières.
La masse atomique relative est un synonyme de poids atomique et est étroitement liée à la masse atomique moyenne (mais pas un synonyme de masse atomique), la moyenne pondérée des masses atomiques de tous les atomes d'un élément chimique trouvé dans un échantillon particulier, pondéré par l'abondance isotopique.
Ceci est souvent utilisé comme synonyme de poids atomique relatif, et il n'est pas faux de le faire, puisque les poids atomiques standard sont des masses atomiques relatives, bien qu'elles soient moins spécifiques.
La masse atomique relative fait également référence à des environnements non terrestres et à des environnements terrestres hautement spécifiques qui s'écartent de la moyenne ou ont des certitudes différentes (nombre de chiffres significatifs) par rapport aux poids atomiques standard.
Synonymes, antonymes
3 synonymes (sens proche) de "masse atomique" :
- masse isotopique
- nombre de masse
- poids atomique
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à MASSE ATOMIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression MASSE ATOMIQUE est dans la page 2 des mots en M du lexique du dictionnaire.
Mots en M à proximité
marronnage marsouin marsupium martin-pêcheur martre masse atomiquemasse cellulaire interne masse d'eau masse lenticulaire masse molaire masse moléculaire
En rapport avec "masse atomique"

La table de Mendeleïev est une version primaire du tableau périodique des éléments chimiques.

Le tableau périodique des éléments est un arrangement des éléments chimiques sous la forme d'une table, ordonnée par leur nombre atomique (nombre de protons)...

La masse de 1 mole d'atome s'appelle la masse molaire. La masse molaire d'une substance est égale à la masse atomique d'une substance exprimée en grammes.

La masse moléculaire est la masse d'une molécule, complémentaire de la masse atomique. Elle correspond à la somme des masses de chaque atome de la molécule.
