Isotope
Définition
Les isotopes sont appelés atomes du même élément, dont les noyaux ont un nombre différent de neutrons, et par conséquent, diffèrent en nombre de masse. Le mot isotope est utilisé pour indiquer que tous les types d'atomes du même élément chimique isotopiques sont dans le même emplacement du tableau périodique.
Une réaction nucléaire produit des isotopes :
Les isotopes apparaissent dans cette partie du diagramme de chaos de réaction avec apport d'un neutron, ce qui illustre les réactions nucléaires en général.
Explications
Les isotopes sont des atomes d'un même élément chimique dont les noyaux ne contiennent pas le même nombre de neutrons. Les atomes qui sont des isotopes les uns avec les autres sont ceux qui ont le même numéro atomique (nombre de protons dans le noyau), mais des nombres de masse différents (somme du nombre de neutrons et du nombre de protons dans le noyau). Les différents isotopes d'un élément diffèrent donc en nombre de neutrons.
La plupart des éléments chimiques ont plus d'un isotope. Seuls 8 éléments (par exemple le béryllium ou le sodium) ont un seul isotope naturel. En revanche, l'étain est l'élément avec des isotopes plus stables (10).
D'autres éléments ont des isotopes naturels, mais instables, comme l'uranium, dont les isotopes peuvent se transformer ou se désintégrer en d'autres isotopes plus stables, émettant des radiations dans le processus, donc nous disons qu'ils sont radioactifs.
Les isotopes instables sont utiles pour estimer l'âge de la variété des échantillons naturels, tels que les roches et la matière organique. Ceci est possible, à condition que le taux moyen de désintégration d'un certain isotope soit connu, par rapport à ceux qui ont déjà diminué. Grâce à cette méthode de datation isotopique au carbone 14, il est possible d'estimer l'âge de la Terre grâce à la demi-vie du carbone 14.
Sur les 91 éléments naturels, 69 se trouvent dans la nature sous forme de mélanges de plusieurs isotopes (éléments de mélange). Les 22 autres sont appelés éléments purs. Le poids atomique chimique des éléments de mélange est la valeur moyenne des différentes masses atomiques des isotopes impliqués. Voir aussi l'atomicité d'un élément.
Types
Tous les isotopes ont le même numéro atomique mais diffèrent par le nombre de masse. Si la relation entre le nombre de protons et de neutrons n'est pas appropriée pour obtenir la stabilité nucléaire, l'isotope est radioactif.
Par exemple, dans la nature, le carbone est présenté sous la forme d'un mélange de trois isotopes de masses 12, 13 et 14 : 12 C, 13 C et 14 C. Leurs abondances par rapport à la quantité globale de carbone sont respectivement de 98,89 %, 1,11 % et des traces.
Il y a les :
- isotopes naturels : ils sont ceux que l'on trouve dans la nature. Par exemple, l'hydrogène a trois isotopes naturels, le protium, le deutérium et le tritium. Le tritium est largement utilisé dans les travaux nucléaires; C'est l'élément essentiel de la pompe à hydrogène. Un autre élément qui est formé par des isotopes très importants est le carbone, qui est le carbone 12, qui est la base de référence du poids atomique de tout élément, le carbone 13 qui est le seul carbone à propriétés magnétiques et le carbone 14 radioactif., très important puisque sa demi-vie est de 5730 ans et est largement utilisé en archéologie pour déterminer l'âge des fossiles organiques. L'uranium 235 est utilisé dans les centrales nucléaires et les bombes atomiques.
- isotopes artificiels : ils sont produits dans les laboratoires nucléaires par bombardement de particules subatomiques ou dans des centrales nucléaires. Ces isotopes ont généralement une courte durée de vie, principalement en raison de l'instabilité et de la radioactivité qu'ils présentent. L'un d'entre eux est le césium, dont les isotopes artificiels sont utilisés dans les centrales nucléaires. L'iridium -192 est un autre procédé couramment utilisé pour vérifier l'étanchéité des soudures de tuyaux, en particulier dans les tubes de transport de pétrole brut lourd et de carburant. Certains isotopes de l'uranium, tels que l'uranium 233, sont également utilisés en technologie nucléaire.
Les isotopes sont subdivisés en isotopes stables (il y en a moins de 300) et isotopes non stables ou isotopes radioactifs (il y en a environ 1 200). Le concept de stabilité n'est pas précis, car il existe des isotopes presque stables. Sa stabilité est due au fait que, bien qu'ils soient radioactifs, ils ont une demi-vie extrêmement longue comparée à l'âge de la Terre.
Noms
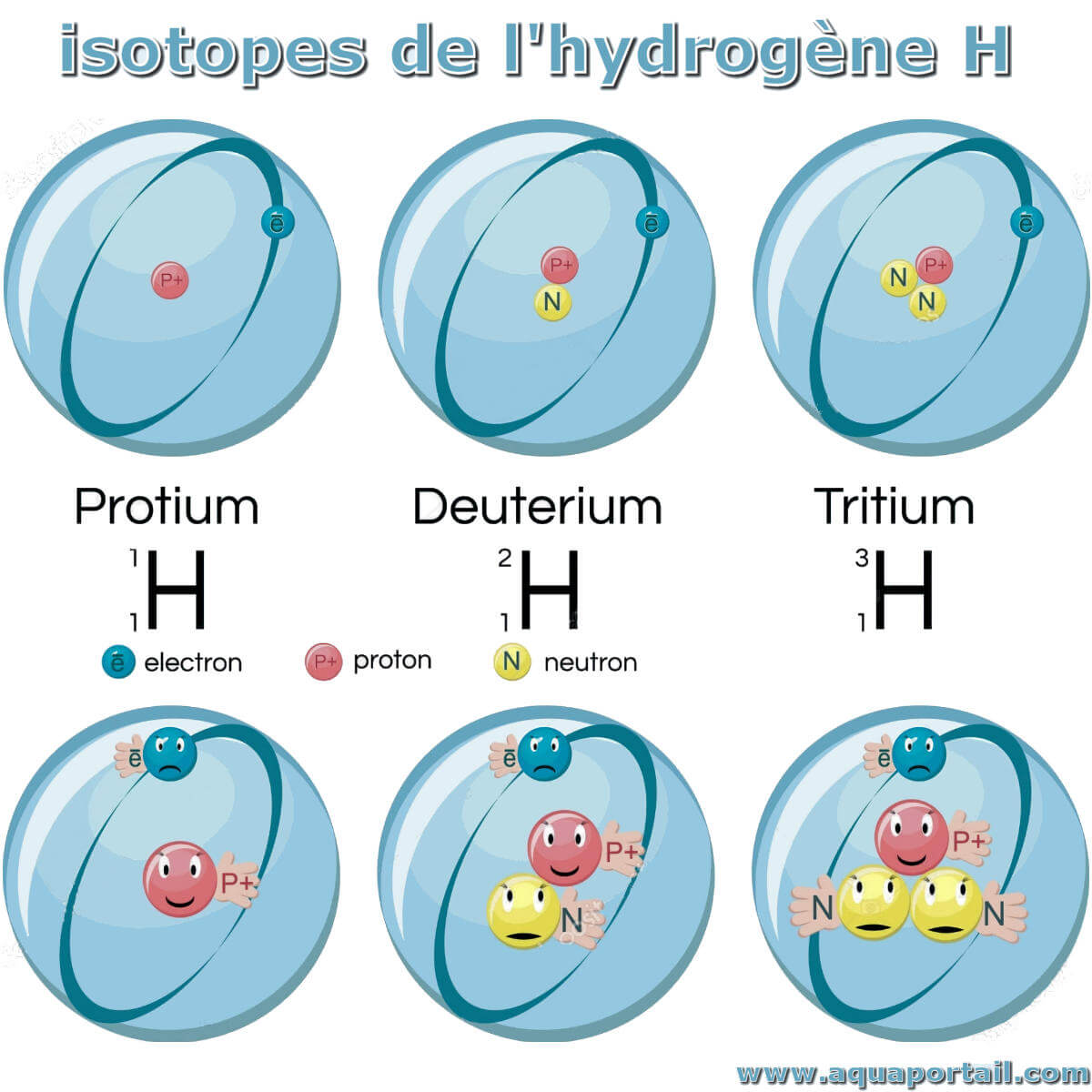
Initialement, les noms des isotopes de chaque élément découvert recevaient leur propre nom différent de celui de l'élément auquel ils appartenaient. Ainsi, lorsque trois isotopes d'hydrogène ont été découverts, ils ont reçu les noms de protium, deutérium et tritium. Le noyau du protium est constitué d'un proton, celui du deutérium d'un proton et d'un neutron et celui du tritium d'un proton et de deux neutrons.
Lorsque des isotopes de presque tous les éléments ont été découverts, des centaines ou des milliers de noms étaient nécessaires et le système de nomenclature a été modifié. Actuellement, chaque isotope est représenté par le symbole de l'élément auquel il appartient, en plaçant son numéro atomique sous forme d'indice sur la gauche (nombre de protons dans le noyau), et sur son indice supérieur gauche, son nombre de masse (somme du nombre de protons et de neutrons).). Ainsi, les isotopes de l'hydrogène protium, du deutérium et du tritium sont respectivement notés 11H, 12H et 13H.
Étant donné que tous les isotopes d'un même élément ont le même numéro atomique, qui correspond à l'ordre du tableau périodique, et le même symbole, le numéro atomique est généralement élué. Donc, pour les isotopes de l'hydrogène, nous écrirons 1H, 2H et 3H. Cela est fait car tous les isotopes d'un élément particulier se comportent de la même manière dans toute réaction chimique. Par exemple, un atome de l'isotope à faible teneur en oxygène qui porte le numéro de masse 18 se combinera exactement avec deux atomes d'hydrogène pour former de l'eau comme s'il s'agissait de l'abondant atome d'oxygène de la masse numéro 16. Cependant, lors de la description des réactions nucléaires Il est utile d'avoir le numéro atomique comme référence.
Dans le cas de textes non scientifiques, tels que des textes journalistiques, cette notation avec indices et indices supérieurs est inconfortable, de sorte qu'une notation consistant en le nom de l'élément joint par un trait d'union au nombre de masse de l'isotope en question est également utilisée. De cette manière, les isotopes d'hydrogène 11H, 12H et 13H peuvent également être appelés hydrogène-1, hydrogène-2 et hydrogène-3, respectivement.
Ce sont les règles de nomenclature scientifiquement acceptées, correspondant à la nomenclature de chimie inorganique. Recommandations de 2005 (Livre rouge de l'UICPA), telles qu'elles figurent dans la section IR-3.3.
Il faut se rappeler que les noms des éléments chimiques sont des noms communs et qu'ils doivent donc être écrits sans majuscule, à moins que cela ne soit imposé par une autre règle d'orthographe.
Le terme isotope est plus ancien que le terme nucléide, qui signifie généralement "espèce atomique". "Isotope" est donc encore souvent utilisé au sens de nucléide, d. h. même si non seulement les atomes du même élément sont mentionnés.
Radioisotopes
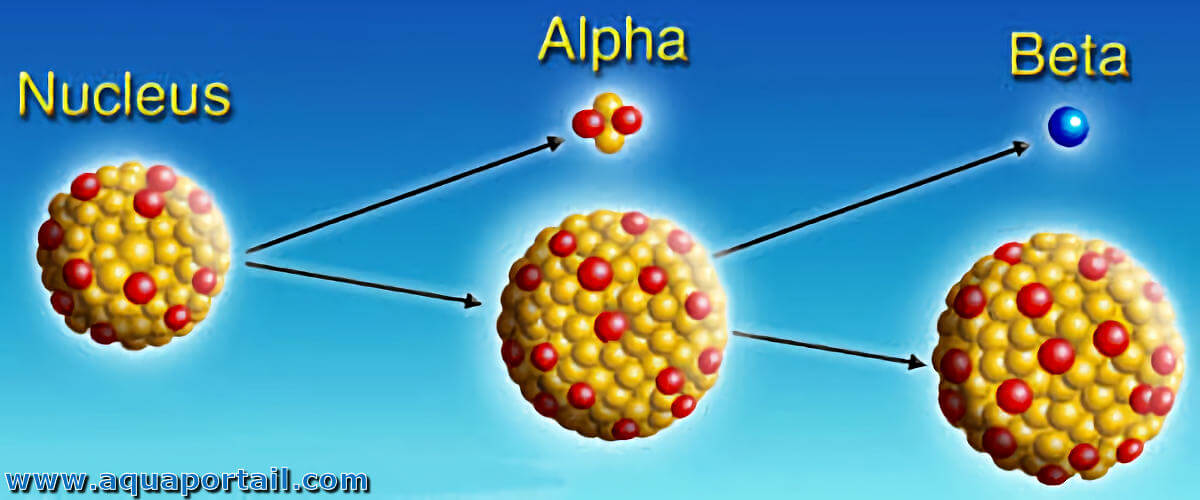
Les radio-isotopes sont des isotopes radioactifs car ils ont un noyau atomique instable et émettent de l'énergie et des particules lorsqu'ils se transforment (se désintègrent) en un isotope différent plus stable. L'énergie libérée lors de la désintégration peut être détectée avec un compteur Geiger ou un film photographique.
L'instabilité est principalement due à l'excès de protons ou de neutrons. La force nucléaire puissante, qui relie protons et neutrons entre eux, exige que le nombre de neutrons et de protons soit proche d'une certaine relation. Lorsque le nombre de neutrons est supérieur à celui requis par cette relation, l'atome peut avoir une désintégration bêta négative. Lorsque l'atome présente un excès de protons (défaut neutronique), il présente généralement une désintégration bêta positive.
Cela est dû au fait que la force nucléaire résiduelle dépend de la proportion de neutrons et de protons. Si la relation est très biaisée vers l'un des extrêmes, la faible force nucléaire responsable de la désintégration bêta peut provoquer sporadiquement la perte d'un nucléon. Pour les nombres atomiques élevés (Z > 80), la désintégration alpha devient également fréquente (ce qui est presque beaucoup plus fréquent lorsqu'il existe également un excès de proton).
Chaque radioisotope a une demi-vie ou une demi-vie caractéristique. L'énergie peut être libérée principalement sous forme de rayonnement alpha (particules constituées de noyaux d'hélium), de bêta (particules formées par des électrons ou des positrons) ou de gamma (énergie sous forme de rayonnement électromagnétique).
Plusieurs isotopes radioactifs instables et artificiels ont des applications dans les techniques de radiothérapie en médecine. Par exemple, un isotope de technétium (99m Tc, le "m" indiquant qu'il s'agit d'un isomère nucléaire métastable) peut être utilisé pour identifier les vaisseaux sanguins bloqués.
Plusieurs isotopes radioactifs naturels sont utilisés en datation radiométrique pour déterminer des chronologies, par exemple archéologiques.
Utilisation des propriétés chimiques
Dans l'étiquetage isotopique, des isotopes inhabituels sont utilisés comme marqueurs de réactions chimiques. Les isotopes ajoutés réagissent chimiquement de la même manière que ceux présents dans la réaction, mais peuvent ensuite être identifiés par spectrométrie de masse ou spectroscopie infrarouge. Si des radio - isotopes sont utilisés, ils peuvent également être détectés grâce aux radiations qu'ils émettent. Les processus de séparation isotopique ou d'enrichissement isotopique représentent un défi.
La géochimie traite des isotopes dans les minéraux, les roches, le sol, l'eau et l'atmosphère de la terre.
Synonymes, antonymes
Voir tous les synonymes pour "isotope".2 synonymes (sens proche) de "isotope" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ISOTOPE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ISOTOPE est dans la page 2 des mots en I du lexique du dictionnaire.
Mots en I à proximité
isostatique isotache isotherme isotonie isotonique isotopeisotope stable isotopique isotrope isotropie isotype
En rapport avec "isotope"

Un atome est la plus petite partie d'une substance qui ne peut être décomposée chimiquement.
Le deutérium est un isotope de l'hydrogène. Dans la molécule d'hydrogène simple, il y a un proton, un électron et pas de neutrons, protons, électrons...

Un isotope stable est une forme non radioactive d'un atome. Bien que ces types d'isotopes n'émettent pas de rayonnement, leurs propriétés uniques leur...
Un radioisotope est l'isotope radioactif d'un élément (radioélément) qui se désintègre spontanément, un radionucléide.
