Réactif de Grignard
Définition
Un réactif de Grignard, de formule type R-Mg-X, est une base forte et un excellent nucléophile. Ces réactifs sont synthétisés par réaction entre du magnésium métallique et des halogénures d'alkyle ou d'aryle. L'halogène associé, noté X, peut correspondre à Cl, Br ou I, mais jamais à F. La partie R désigne un composé organique.
L'époxyde et les réactifs de Grignard :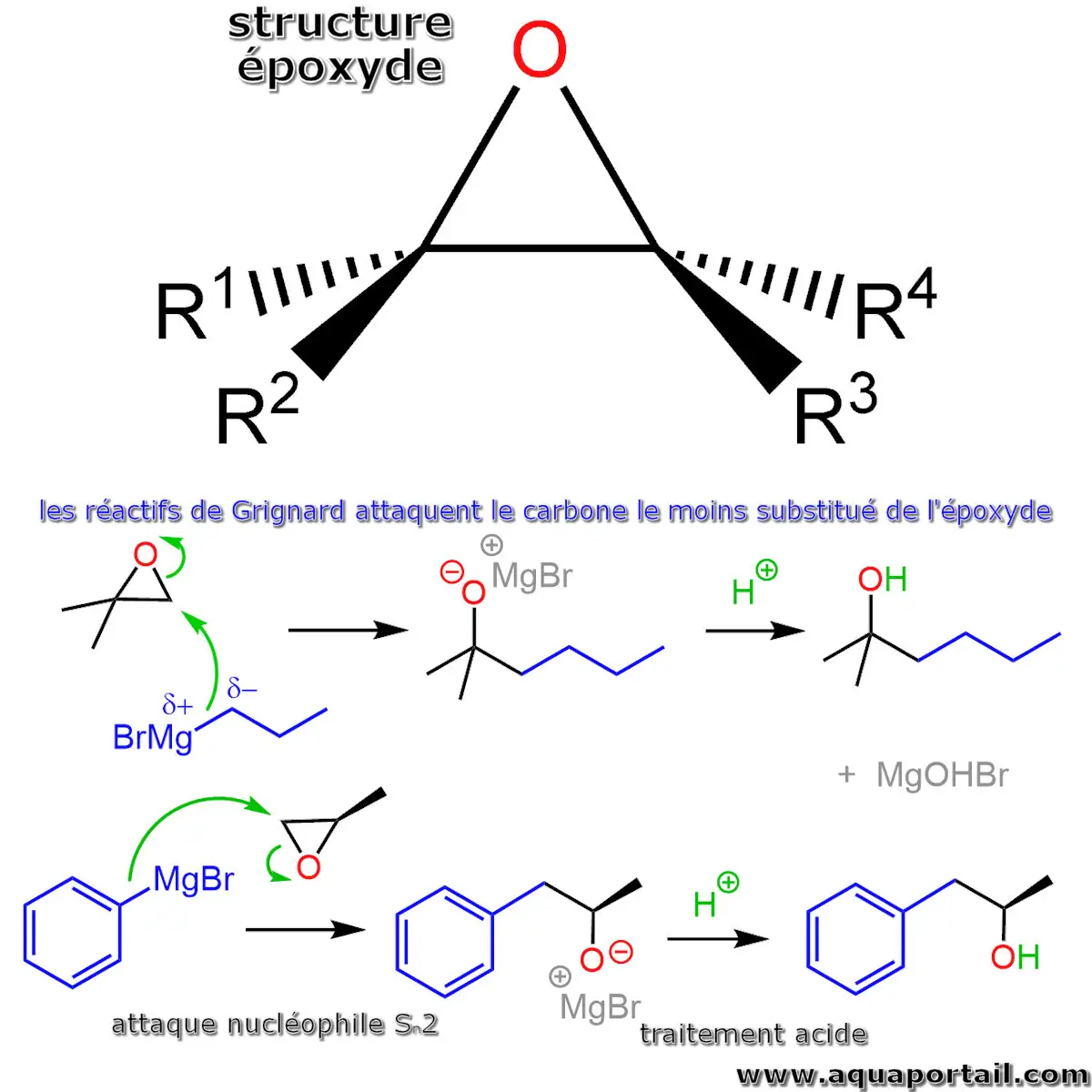
Lorsqu'ils interagissent avec des époxydes, les réactifs de Grignard attaquent préférentiellement l'atome de carbone le moins substitué. Ce processus se déroule en deux étapes pour aboutir à la formation d'un alcool. Dans un premier temps, l'ouverture du cycle époxyde se produit, générant un intermédiaire alcoolate. Cet alcoolat est ensuite hydrolysé à l'aide d'eau ou traité par un acide afin de produire l'alcool souhaité.
Explications
Les réactifs de Grignard présentent une grande réactivité avec les aldéhydes, cétones et esters, entraînant la formation d'alcools. En réagissant avec des aldéhydes, ils produisent des alcools secondaires, tandis que l'interaction avec des cétones génère des alcools tertiaires. Quant aux esters, ils nécessitent un excès de réactif de Grignard pour former des alcools tertiaires.
Il est crucial de noter que les réactifs de Grignard agissent comme des bases très puissantes. L'atome de carbone lié au magnésium (C-Mg) est doté d'une densité électronique importante, ce qui en fait à la fois un nucléophile efficace et une base forte.
Une règle fondamentale à suivre lors de l'utilisation des réactifs de Grignard, ou même des organolithiens, est de garantir que les conditions de réaction soient parfaitement anhydres. La moindre trace d'eau interfère immédiatement avec le réactif avant qu'il ne puisse agir comme nucléophile. Cela détruit le réactif de Grignard et empêche toute progression de la réaction.
Cette contrainte s'étend au-delà de l'eau. Tout composé contenant un proton suffisamment acide pour réagir avec le réactif de Grignard doit être évité. Cela inclut, par exemple, les alcools et les acides carboxyliques. Pour contourner ce problème et protéger la réaction, il est courant d'utiliser des groupes protecteurs adaptés aux alcools.
Le plus connu des réactifs de Grignard est le chlorure de méthylmagnésium Cl-Mg-CH3.
Les réactifs de Grignard peuvent également réagir avec les chlorures d'acide, les anhydrides, les nitriles et les époxydes.
Réaction de Grignard
La réaction de Grignard est une méthode classique utilisée pour établir des liaisons carbone-carbone. Ce procédé repose sur l'emploi d'un réactif de Grignard, une espèce organomagnésienne de type R-Mg-X, où R représente un résidu organique et X un halogène. Ce réactif favorise l'addition du résidu organique à un substrat électrophile.
Le principe de cette réaction repose sur un fort déséquilibre dans la répartition électronique. La liaison polaire entre carbone et magnésium (C-Mg) est presque ionique, tandis que dans le groupement carbonyle (C=O), la densité électronique est concentrée sur l'oxygène, rendant le carbone extrêmement électrophile.
Lorsqu'ils interagissent, le réactif de Grignard, très réactif, met à profit la paire d'électrons de la liaison C-Mg pour se lier à l'atome de carbone du groupement carbonyle. Cette attaque nucléophile déplace les électrons de la liaison π vers l'oxygène, ce qui aboutit à la formation d'un ion alcoxyde. Ce dernier, associé au magnésium (Mg2⁺) et à l'halogénure, est ensuite stabilisé par addition d'eau ou d'un acide.
Découverte par Victor Grignard en 1912, cette réaction fondamentale de la chimie organique lui a valu le prix Nobel. Elle est particulièrement significative lorsqu'il s'agit de composés contenant des groupes carbonyles.
Des réactions de Grignard :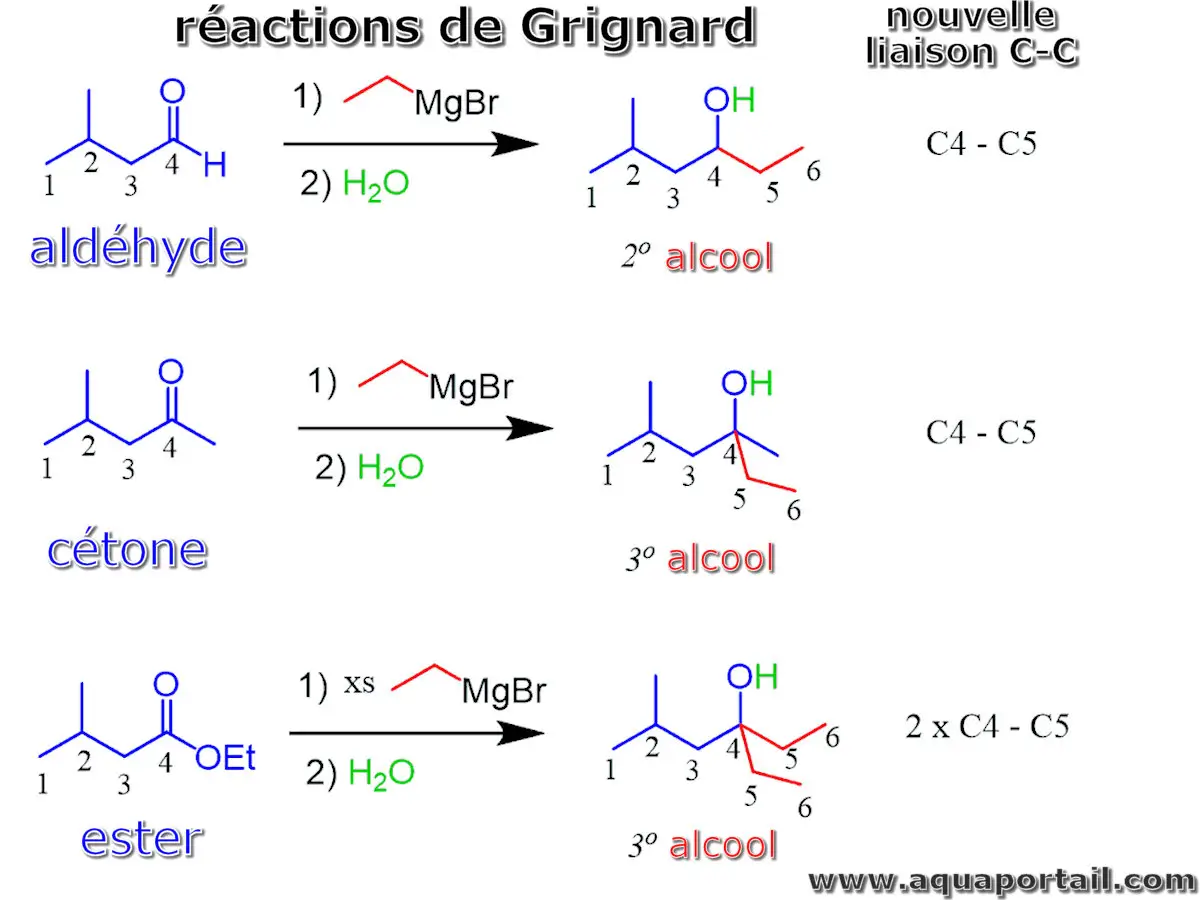
Il est impératif d'ajouter l'eau ou l'acide uniquement après que le réactif de Grignard ait entièrement réagi avec l'électrophile. On distingue deux étapes dans la réaction : d'abord l'attaque nucléophile du réactif de Grignard, suivie du traitement acide.
Cas des époxydes
L'issue stéréochimique d'une réaction de Grignard dépend directement de la structure de l'époxyde impliqué. Les époxydes achiraux donnent, dans la majorité des cas, des produits également achiraux. Par exemple, un époxyde achiral produit, après interaction avec un réactif de Grignard, un alcool dépourvu de chiralité.
Cependant, la réaction entre un époxyde achiral et un réactif de Grignard peut aussi générer un mélange racémique d'énantiomères. Un exemple notable est l'époxyde de cyclohexène, considéré achiral car il s'agit d'un composé méso. Les composés méso, bien qu'ayant des centres de chiralité, apparaissent comme achiraux grâce à la présence d'un plan de symétrie interne. Lorsqu'un tel époxyde entre en réaction avec un réactif de Grignard, l'ouverture de l'époxyde entraîne une rupture asymétrique d'une des liaisons C-O. Cette rupture perturbe la symétrie de la molécule, conduisant ainsi à un mélange racémique d'énantiomères.
Synonymes, antonymes
Voir tous les synonymes pour "réactif de Grignard".1 synonyme (sens proche) de "réactif de Grignard" :
- organomagnésien mixte
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à RÉACTIF DE GRIGNARD sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression REACTIF DE GRIGNARD est dans la page 1 des mots en R du lexique du dictionnaire.
Mots en R à proximité
rayonnement non ionisant raz de marée rbcL réabsorption réacteur à bactéries réactif de Grignardréactif iodo-ioduré réaction acrosomienne réaction allergique réaction chimique réaction claire
En rapport avec "réactif de Grignard"

L'alkylation est le transfert d'un groupe alkyle d'une particule en mouvement à une autre molécule au repos.
La carboxylation en chimie est une réaction chimique dans laquelle un groupe acide carboxylique est introduit dans un substrat.
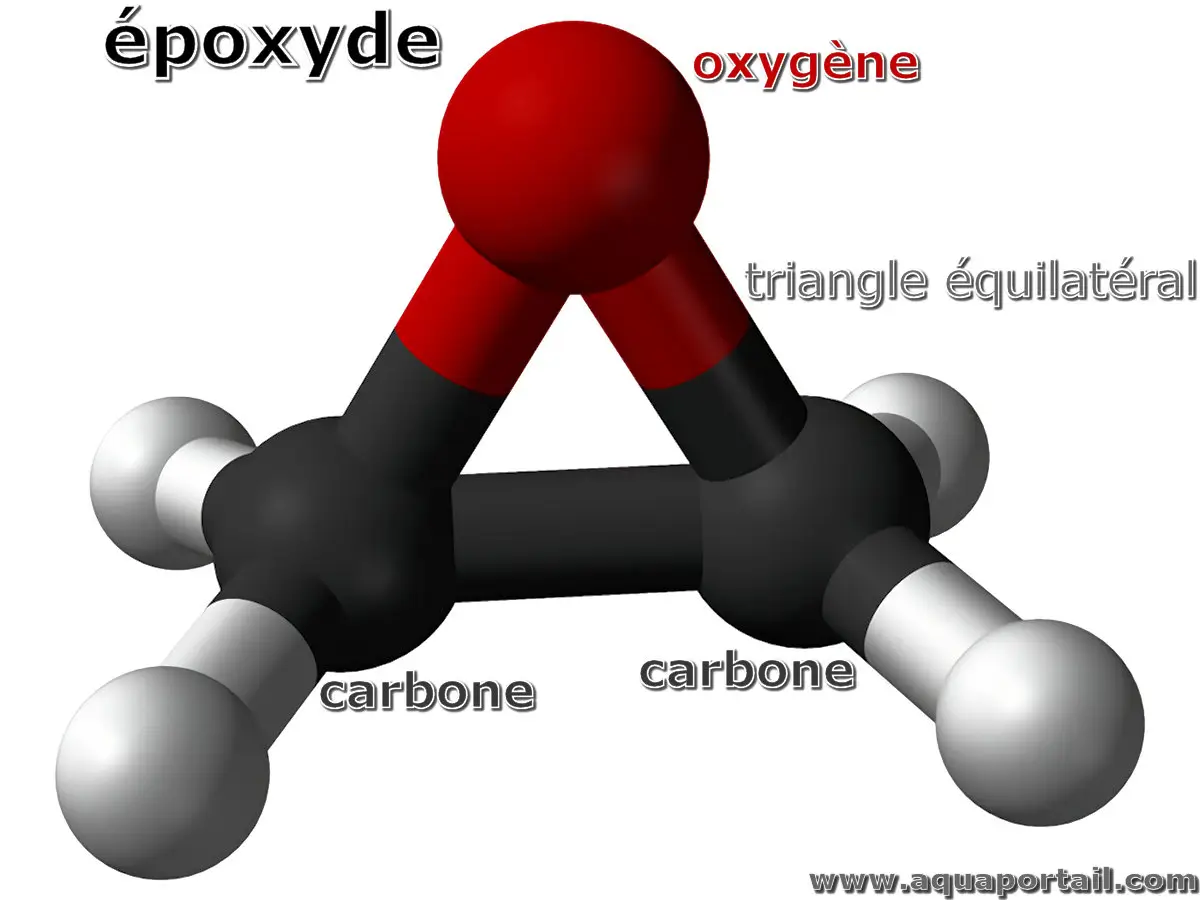
Un époxyde est un éther organique caractérisé par une structure cyclique à trois atomes formant un triangle équilatéral, composée d'un atome d'oxygène...
Le réactif iodo-ioduré est en relation avec le lugol et l'eau iodée. Cette solution est utilisée comme test indicateur de la présence d'amidons dans...
