Nitrile
Définition
Un nitrile est un groupe fonctionnel caractérisé par un groupe cyano (–C≡N) constitué d'un atome de carbone triplement lié à un atome d'azote. Cette triple liaison confère des propriétés chimiques distinctes aux composés avec un groupe nitrile. Ex. : le cyanogène est formé d'un double groupe nitrile avec la formule N≡C–C≡N.
Les structures du nitrile et de l'acétonitrile :
La structure d'un nitrile (groupe cyano ou carbonitrile) est R–C≡N. Ainsi, l'acétonitrile a pour formule chimique CH3–C≡N.
Explications
Dans un nitrile, la triple liaison entre un atome de carbone et un d'azote conduit à une géométrie linéaire au sein de la molécule, avec un angle de liaison linéaire autour de la triple liaison carbone-azote. Cette triple liaison rend le nitrile hautement polarisé, l'atome de carbone présentant une charge partielle positive et l'atome d'azote présentant une charge partielle négative. Cette polarisation influence leur réactivité et leur interaction avec d'autres molécules.
La géométrie planaire du nitrile contribue à sa stabilité et facilite diverses réactions chimiques, ce qui en fait un intermédiaire polyvalent en synthèse organique. La présence du groupe cyano permet diverses interactions, notamment la liaison hydrogène et la coordination avec les ions métalliques.
Les nitriles sont des composés chimiques qui possèdent un atome d'azote avec une paire d'électrons libres, ce qui les rend capables de participer à la liaison hydrogène. Ils peuvent remplacer les groupes hydroxyle dans certaines applications en raison de leur polarité élevée et de leur demande stérique minimale.
La fonctionnalité nitrile a été découverte dans une gamme de biomolécules, depuis les simples nitriles d'alkyle jusqu'aux produits naturels complexes tels que la borrélidine, la cyanopuupéhénone et les glycosides cyanogéniques. Ces composés sont largement distribués dans la nature.
Hydrolyse
L'hydrolyse du nitrile implique le clivage de la triple liaison carbone-azote (–C≡N) par l'eau, formant des acides carboxyliques ou leur sel. Cette réaction nécessite généralement un catalyseur acide ou basique fort pour faciliter le processus. Dans des conditions acides, le nitrile est protoné, ce qui le rend plus sensible aux attaques nucléophiles des molécules d'eau. L'ion iminium instable intermédiaire subit une hydrolyse supplémentaire pour donner un acide carboxylique. Dans des conditions basiques, les ions hydroxyde attaquent le nitrile, conduisant à la formation de l'ion carboxylate.
Le processus démarre par protonation du nitrile, facilitant la fixation de la molécule d'eau comparativement moins nucléophile à la triple liaison CN. Lors de l'interaction entre l'eau et le carbone contenu dans le nitrile, un proton est transféré par résonance, créant un amide protoné. L'eau, fonctionnant comme une base faible, prive le carbonyle d'un proton, générant un amide tout en restaurant le catalyseur hydronium. L'hydrolyse ultérieure transforme l'amide en acide carboxylique. L'azote contenu dans le nitrile est déplacé sous forme d'entité partante, formant finalement de l'ammonium (NH4+).
Réduction
Les nitriles peuvent être réduits en amines primaires grâce à diverses méthodes de réduction. Une réduction typique implique des agents réducteurs comme l'hydrure de lithium et d'aluminium (LiAlH4) ou l'hydrogène gazeux (en présence d'un catalyseur tel que le nickel ou le platine). Lors de la réduction, la triple liaison carbone-azote est convertie en une simple liaison, formant des amines primaires.
Réaction avec les organométalliques
Les réactifs organométalliques comme les réactifs de Grignard comprennent un groupe alkyle ou aryle lié à un halogénure de magnésium. Il s'agit d'une addition nucléophile qui consiste à ajouter du réactif de Grignard à l'atome de carbone du groupe nitrile, entraînant la formation d'une nouvelle liaison carbone-carbone. Lorsqu'il réagit avec un nitrile, l'atome de carbone de la triple liaison du nitrile, étant déficient en électrons, attire la nature riche en électrons du composé organométallique. Cela conduit à l'ajout du groupe alkyle ou aryle du réactif de Grignard au carbone du nitrile, formant un intermédiaire imine, qui subit finalement une hydrolyse ou d'autres réactions pour produire une variété de composés fonctionnalisés.
Synthèses (production) possibles
Les nitriles sont des précurseurs synthétiques à la fois pour la transformation de groupes fonctionnels et les réactions de formation de liaisons carbone-carbone. Ils sont généralement formés par une réaction de substitution SN2 dans laquelle l'ion cyanure déplace un groupe partant d'un halogénure d'alkyle ou d'un ester sulfonate. Alternativement, les nitriles peuvent être formés par déshydratation d'amides. Une fois le nitrile formé, la réduction du groupe cyano avec LiAlH4 donnera une amine primaire, de sorte que les nitriles fonctionnent comme des groupes aminométhyle protégés (latents ou de substitution).
L'alkylation du sel de cyanure est l'une des voies fondamentales de production de nitrile. Ce processus implique généralement la réaction d'un sel de cyanure, souvent du cyanure de potassium (KCN) ou du cyanure de sodium (NaCN), avec un halogénure d'alkyle dans des conditions appropriées. Le groupe alkyle de l'halogénure déplace l'ion cyanure, formant l'alkylnitrile correspondant.
La formation de cyanhydrine représente une autre voie importante pour synthétiser les nitriles. Ce processus implique l'ajout de cyanure d'Hydrogène (HCN) ou d'un ion cyanure à un composé carbonyle, généralement un aldéhyde ou une cétone, formant un intermédiaire cyanhydrine. La déshydratation ultérieure de cet intermédiaire conduit à la libération d'eau et à la formation de la fonctionnalité nitrile.
La déshydratation de l'amide présente une méthode alternative pour la synthèse du nitrile. Ce processus implique la déshydratation des amides primaires pour produire des nitriles. Dans des conditions appropriées, telles que des températures élevées et des agents de déshydratation ou des catalyseurs appropriés, les amides primaires subissent des réactions d'élimination, dans lesquelles l'oxygène carbonyle et le groupe amino sont éliminés sous forme d'eau, laissant derrière eux la fonctionnalité nitrile.
Caoutchoucs nitriles
Les caoutchoucs nitriles contiennent trois sites réactifs différents : des doubles liaisons, des groupes nitrile et parfois des groupes carboxyliques (issus de la copolymérisation avec de petites quantités d'acides acryliques ou méthacryliques). Les groupes hydroxyméthyle d'un résol peuvent réagir avec l'un ou l'autre de ces sites pour former respectivement un ester, une chromone ou un imino éther. La polyfonctionnalité du résol conduit à une réticulation. Les conditions de durcissement sont de 150 à 260 °C pendant 30 min ou moins sous des pressions de liaison de 1 à 2 M Pa. Les liaisons ont un faible fluage en dessous de 90 °C et présentent une bonne résistance à la fatigue et aux chocs.
Le latex de caoutchouc nitrile synthétique est un terpolymère de butadiène, d'acrylonitrile et d'acide méthacrylique, communément appelé caoutchouc nitrile, largement utilisé pour la fabrication de gants d'examen médical.
Nitrilases et nitrile hydratase
Les nitrilases et les enzymes nitrile hydratase manipulent les groupes nitrile. Les nitrilases s'hydrolysent en acide carboxylique et les hydratases en carboxamide. De nombreux processus industriels à grande échelle sont exécutés avec ces enzymes pour produire des matériaux achiraux, mais ces enzymes peuvent être utilisées pour fabriquer des acides chiraux. Dans le cas des nitriles hydratases, l'hydratation du groupe nitrile se déroule souvent avec une faible énantiosélectivité, mais la coexpression ou l'ajout d'une amidase aboutira souvent à une résolution efficace pour produire des acides carboxyliques chiraux. Les deux classes d'enzymes manipulant le nitrile (nitrilase ou combinaison nitrile hydratase/amidase) conviennent à la désymétisation des mésodinitriles.
Synonymes, antonymes
Voir tous les synonymes pour "nitrile".3 synonymes (sens proche) de "nitrile" :
- carbonitrile
- cyanide
- groupe cyano
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à NITRILE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot NITRILE est dans la page 2 des mots en N du lexique du dictionnaire.
Mots en N à proximité
nitrate nitrate de potassium nitrate de sodium nitrate réductase nitrification nitrilenitritation nitrite Nitrobacter nitrobactérie nitrogénase
En rapport avec "nitrile"
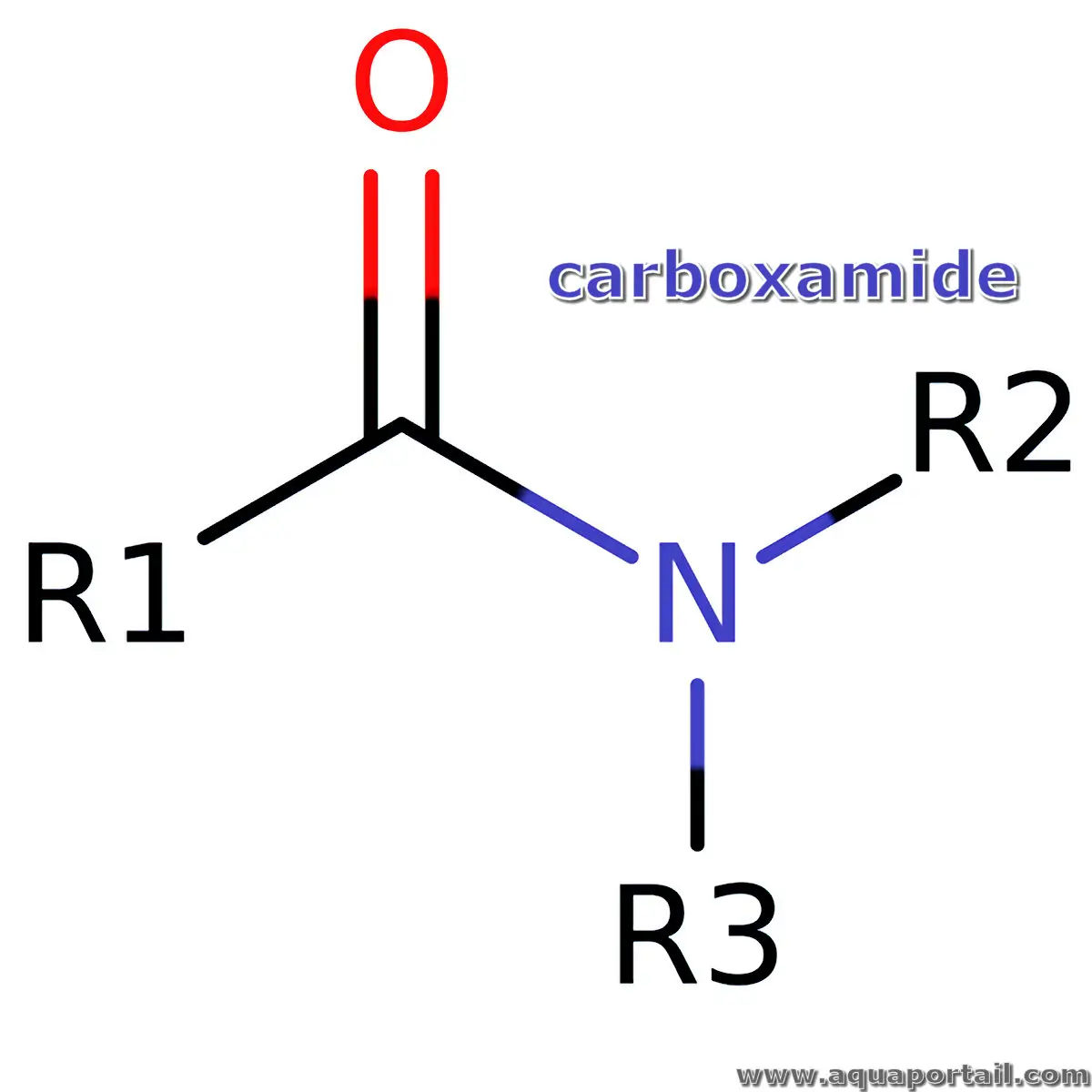
Le carboxamide est un amide d'acide carboxylique ayant la structure RC(=O)NR₂. Le terme est utilisé comme suffixe dans la formation systématique de noms pour...

Un cyanamide est l'amide de l'acide cyanique (acide cyanhydrique). Le composé, de formule chimique CN-NH₂, dérive de l'ammoniac par substitution du groupe...

Le groupe fonctionnel est une partie structurelle d'une molécule caractérisée par des éléments spécifiques et une organisation précise bien définie.

Le groupe phosphoryle est un groupement phosphate de formule PO₃²⁻. L'addition d'un groupe phosphoryle à une molécule est une réaction de phosphorylation.
