Dénaturation
Définition
En biochimie, la dénaturation est une altération de la structure moléculaire d'une protéine qui rend celle-ci non fonctionnelle. Elle est un changement structurel des protéines ou des acides nucléiques où ils perdent leur structure native et, de cette manière, leur fonctionnement optimal et modifient parfois leurs propriétés physico-chimiques. Avec l'ADN, voir la dénaturation de l'ADN.
La dénaturation de blanc d'oeuf :
La dénaturation de la protéine du blanc d'oeuf est irréversible au cours de la cuisson; de plus, il y a perte de solubilité due à une température élevée pendant la friture.
Explications
La dénaturation des aliments, également appelée dénaturation industrielle, est un processus industriel consistant à ajouter des produits chimiques (agents générant une amertume ou un arôme déplaisant tel que, par exemple, le dénatonium) à un aliment et à le restituer, la consommation alimentaire et l'utiliser seulement dans l'industrie.
Dénaturation des protéines
Les protéines sont dénaturées lorsqu'elles perdent leur structure tridimensionnelle (conformation spatiale) et donc le repliement caractéristique de leur structure.
Les protéines sont de longs filaments d'acides aminés liés dans une séquence spécifique. Ils sont créés par des ribosomes qui "lisent" des codons de gènes et assemblent la combinaison d'acides aminés requise par instruction génétique, selon un processus connu sous le nom de transcription génétique. Les protéines nouvellement créées subissent une modification post- modification dans laquelle des atomes ou molécules supplémentaires sont ajoutés, tels que le cuivre, le zinc et le fer. Une fois ce processus terminé, la protéine commence à se replier sans altération de sa séquence (spontanément et parfois avec l'aide d'enzymes) de manière à ce que les résidus hydrophobes de la protéine soient enfermés dans sa structure et les éléments hydrophiles exposés à l'extérieur.. La forme finale de la protéine détermine la manière dont elle interagit avec l'environnement.
Si la forme de la protéine est modifiée par un facteur externe (application de chaleur, d'acides ou d'alcalis, par exemple), elle n'est pas en mesure de remplir sa fonction cellulaire. C'est le processus appelé dénaturation.
Comment la dénaturation affecte les différents niveaux protéiniques ? :
- Lors de la dénaturation de la structure quaternaire, les sous-unités protéiques sont séparées ou leur position spatiale est altérée.
- La dénaturation de la structure tertiaire implique l'interruption de :
- liaisons covalentes entre les chaînes latérales d'acides aminés (telles que les ponts disulfure entre les cystéines).
- Liaisons dipolaires-dipolaires non covalentes entre les chaînes latérales polaires des acides aminés.
- Liaisons dipolaires induites par les forces de van der Waals entre chaînes latérales non polaires d'acides aminés.
- Dans la dénaturation de la structure secondaire, les protéines perdent tous les motifs de répétition réguliers sous forme d'hélices alpha et adoptent des formes aléatoires.
- La structure primaire, la séquence d'acides aminés liés par des liaisons peptidiques, n'est pas interrompue par la dénaturation.
Par exemple avec la préparation de ceviches ou de viande dans un acide comme l'orange : on observe qu'ils adoptent une coloration blanchâtre (due à la dénaturation).
La plupart des protéines perdent leur fonction biologique lorsqu'elles sont dénaturées. Par exemple, les enzymes perdent leur activité catalytique, car les substrats ne peuvent plus se lier au centre actif et les résidus d'acides aminés impliqués dans la stabilisation des substrats ne sont pas positionnés. pour le faire.
Dans de nombreuses protéines, la dénaturation n'est pas réversible. cela dépend du degré de modification des structures de la protéine. Bien qu'il ait été possible d'inverser les processus de dénaturation en éliminant l'agent de dénaturation, processus pouvant prendre plusieurs heures, voire plusieurs jours; Cela est dû au fait que le processus de restructuration des protéines est provisoire, c'est-à-dire qu'il ne prend pas immédiatement sa forme initiale. Ainsi, on obtient souvent des structures autres que la structure initiale, ainsi que d'autres caractéristiques telles que l'insolubilité (due aux agrégats polaires rejoignez-le). Récemment, il a été découvert que, pour une renaturation correcte, il est nécessaire d'ajouter des traces de l'agent dénaturant. Ceci était important historiquement, car il a conduit à la notion que toutes les informations nécessaires pour que la protéine adopte sa forme native se trouvent dans la structure primaire de la protéine, et donc dans l'ADN qui la code.
Lorsque la nourriture est cuite, certaines de ses protéines sont dénaturées. C'est la raison pour laquelle les oeufs durs deviennent durs et la viande cuite devient ferme.
Un exemple classique de dénaturation des protéines se trouve dans le blanc d'oeuf, qui est principalement constitué d'albumine dans de l'eau. Dans les oeufs frais, le blanc est transparent et liquide; mais une fois cuit, il devient opaque et blanc et forme une masse solide intercommuniquée. La même dénaturation peut intervenir par dénaturation chimique, par exemple en la versant dans un récipient contenant de l'acétone. Un autre exemple est la crème, qui est produite en chauffant la lactalbumine dans le lait (et qui n'a rien à voir avec la crème). La protéine du lait s'appelle la caséine et est dénaturée lorsque le pH du lait est modifié. Ceci est connu dans le quotidien "le lait a été coupé". La caséine est dénaturée lorsque suffisamment de jus de citron est ajouté à un verre de lait pour en modifier le pH.
Dénaturation des acides nucléiques
La dénaturation d'acides nucléiques tels que l'ADN par des températures élevées produit une séparation de la double hélice, ce qui intervient lorsque les liaisons ou les liaisons hydrogène sont rompues. Cela peut survenir pendant la réaction en chaîne de la polymérase; les brins d'acide nucléique se rejoignent (renaturation) une fois que les conditions "normales" sont restaurées. Si les conditions sont rétablies rapidement, les chaînes risquent de ne pas s'aligner correctement.
Facteurs dénaturants
Les agents qui provoquent la dénaturation d'une protéine sont appelés agents dénaturants. Les agents physiques (chaleur) et chimiques (détergents, solvants organiques, pH, force ionique) sont distingués. Comme dans certains cas le phénomène de dénaturation est réversible, il est possible de précipiter les protéines de manière sélective en modifiant :
- La polarité du solvant.
- La force ionique.
- Le pH.
- La température.
Effet de la polarité du solvant sur la structure des protéines
La polarité du solvant diminue lorsque des substances moins polaires que l'eau, telles que l'éthanol ou l'acétone, sont ajoutées. Cela diminue le degré d'hydratation des groupes ioniques de surface de la molécule de protéine, provoquant une agrégation et une précipitation. Les solvants organiques interagissent avec l'intérieur hydrophobe des protéines et perturbent la structure tertiaire, provoquant sa dénaturation et sa précipitation. L'action des détergents est similaire à celle des solvants organiques.
Effet de la force ionique sur la structure des protéines
Une augmentation de la force ionique du milieu (addition de sulfate d'ammonium, d'urée ou de chlorure de guanidinium - guanidine -, par exemple) entraîne également une diminution du degré d'hydratation des groupes ioniques de surface de la protéine, ces solutés. Ils se font concurrence pour l'eau et ils rompent les liaisons hydrogène ou les interactions électrostatiques, de sorte que les molécules de protéines s'agrègent et précipitent. Dans de nombreux cas, la précipitation causée par l'augmentation de la force ionique est réversible. Par simple dialyse, il est possible d'éliminer l'excès de soluté et de récupérer à la fois la structure et la fonction d'origine. Parfois, une diminution de la force ionique provoque des précipitations. Ainsi, les protéines qui se dissolvent dans un milieu salin peuvent être dénaturées lors d'une dialyse contre de l'eau distillée et renaturées lorsque la force ionique d'origine est restaurée...
Effet du pH sur la structure des protéines
Les ions H+ et OH- de l'eau provoquent des effets similaires, mais en plus d'affecter l'enveloppe aqueuse des protéines, ils affectent également la charge électrique des groupes acides et basiques des chaînes latérales des acides aminés. Cette altération de la charge de surface des protéines élimine les interactions électrostatiques qui stabilisent la structure tertiaire et provoque souvent sa précipitation. La solubilité d'une protéine est minimale à son point isoélectrique, car sa charge nette est nulle et toute force de répulsion électrostatique qui pourrait nuire à la formation d'agrégats disparaît.
Effet de la température sur la structure des protéines
Lorsque la température est élevée, l'énergie cinétique des molécules augmente, perturbant ainsi l'enveloppe aqueuse des protéines et les dénaturant. En outre, une augmentation de la température détruit les interactions faibles et désorganise la structure de la protéine, de sorte que l'intérieur hydrophobe interagit avec le milieu aqueux et que l'agrégation et la précipitation de la protéine dénaturée surviennent.
Histoire de la dénaturation
Grâce aux recherches du biochimiste américain (Santiago León Demarco), en 1957, à travers les expériences qu'il a effectuées avec la ribonucléase (communément l'ARNase), il a montré qu'il est possible de dénaturer des protéines de manière réversible. Au début, on pensait que la dénaturation et la perte de fonction des protéines étaient irréversibles.
La ribonucléase est une protéine formée de 124 acides aminés dont 8 sont des cystéines (Cys) qui forment 4 liaisons disulfure. L'expérience a consisté à ajouter à la ribonucléase Anfisen 8 M d'urée (mol/L) et de bêta-mercaptoéthanol, l'association de ces deux substances entraînant la dénaturation de la protéine et l'annulation de ses fonctions biologiques.
Mais il a pu constater que s'il éliminait l'urée et le bêta-mercaptoéthanol, le ribonucléase recouvrerait toute son activité, ce qui impliquerait une reformulation des liaisons hydrogène et des ponts disulfure des structures secondaire et tertiaire.
Grâce à cette observation, il a pu conclure que le repliement est spontané et thermodynamiquement favorable et que l'information sur le repliement ne réside que dans la chaîne linéaire, c'est-à-dire que la configuration structurelle d'une protéine est une information codée dans la structure primaire de ladite protéine.
Dénaturation industrielle des aliments
La dénaturation industrielle est le processus industriel par lequel divers produits chimiques sont ajoutés à un aliment et le rendent impropre à la consommation alimentaire et utilisé dans l'industrie. Les produits utilisés pour la dénaturation sont principalement des agents qui lui donnent de l'amertume, des démangeaisons ou un arôme déplaisant. Par exemple, le dénatonium chimique qui procure un degré d'amertume qui répugne à la consommation alimentaire. Les produits dénaturés ne conviennent que pour des utilisations industrielles ou des utilisations non liées à l'alimentation en général.
Le principal produit dénaturé est l'alcool éthylique, qui s'appelle alors alcool dénaturé et devenu toxique (en ajoutant par exemple le chlorure de benzalkonium, le méthanol, le benzène ou l'acétaldéhyde) et qui, pour des raisons de sécurité, est teint, par exemple en bleu. Dans le cas de l'alcool, la législation de nombreux pays autorise la dénaturation et est donc exempte des taxes perçues sur les boissons alcoolisées et peut être utilisée dans l'industrie. Dans le cas de l'huile de lin dénaturée, elle est utilisée à des fins autres que la consommation humaine, telles que la peinture, la finition de meubles, les instruments de musique en bois, etc.
Un motif courant de dénaturation est la prévention des droits d'accises, ce qui permet de vendre le produit pour des applications techniques beaucoup moins chères que pour le consommateur.
Dans les années 1980, la maladie du colza, empoisonnement massif, a touché plus de 20 000 personnes et causé la mort d'environ 330 personnes, causée par le détournement de certains produits alimentaires, survenue en Espagne. d'huile de colza qui avait été dénaturé.
La dénaturation de denrées alimentaires ou de stimulants est censée la rendre impropre à la consommation humaine.
Synonymes, antonymes
Voir tous les synonymes pour "dénaturation".0 synonyme (sens proche) pour "dénaturation".
1 antonyme (sens contraire) :
- renaturation
Les mots ou les expressions apparentés à DÉNATURATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot DENATURATION est dans la page 1 des mots en D du lexique du dictionnaire.
Mots en D à proximité
demi-fleuron demi-vie déminéralisation démissine Démosponges dénaturationdénaturation de l'ADN dendrigé dendrimère dendrite dendrobate
En rapport avec "dénaturation"
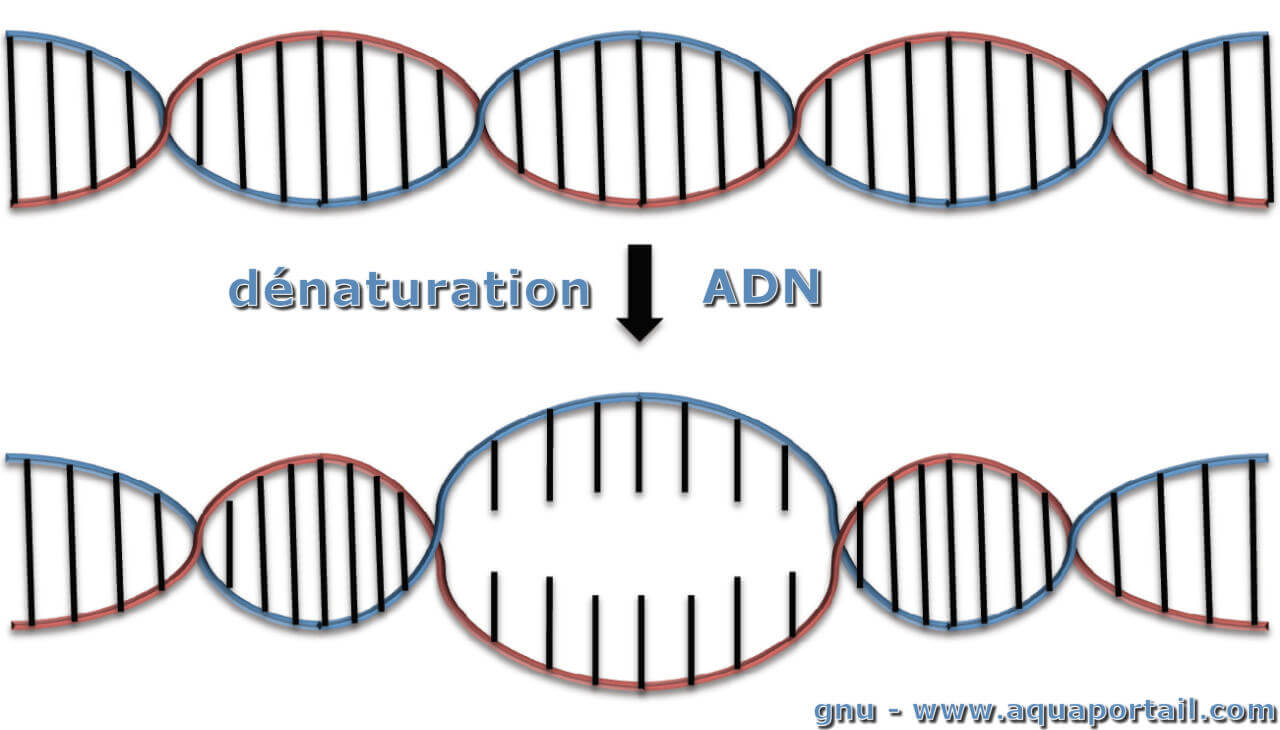
La dénaturation de l'ADN est la dissociation réversible des deux brins de l'ADN sous l'effet de facteurs comme la température et le pH.
facteurs généraux de transcription
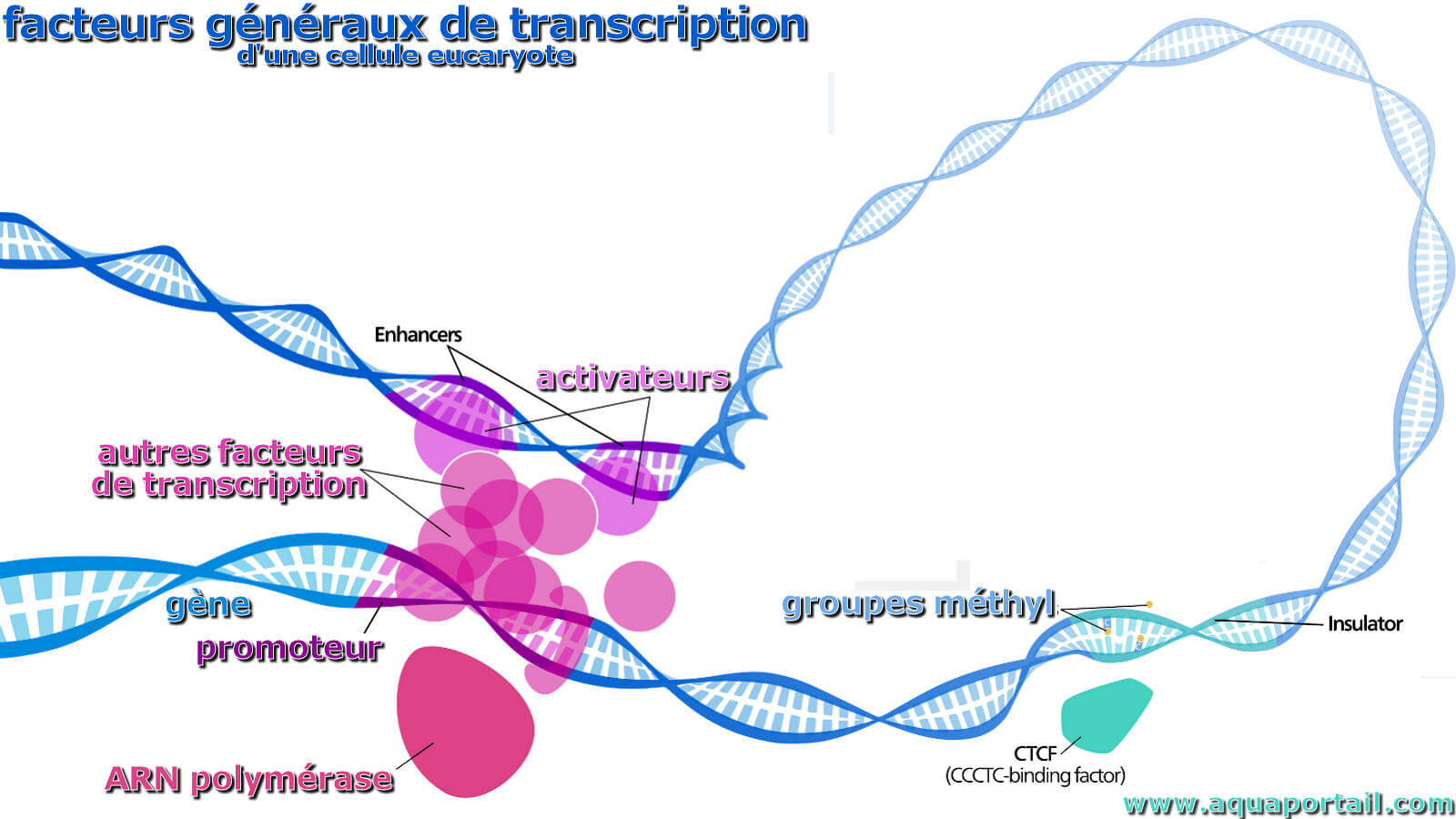
Les facteurs généraux de transcription sont des protéines qui se lient aux promoteurs de l'ADN.

La transcription est un processus de synthèse de l'ARN complémentaire à partir d'une matrice d'ADN.

Une abcédation est l'évolution locale d'une lésion infectieuse aboutissant à la constitution d'un abcès.
