Dissolution
Définition
La dissolution est un processus de décomposition, de transformation d'une substance appelée soluté dans un solvant, afin de produire une solution claire, comme pour le sel et le sucre dissous dans l'eau. Ce processus peut ne pas être instantané et prendre du temps. Par exemple, les engrais subissent une dissolution après leur incorporation dans les sols humides.
Processus de dissolution de sucre :
Le sucre solide subit une dissolution lorsqu'il est plongé dans de l'eau. Le sucre est le soluté, l'eau est le solvant.
Explications
Lorsque le solvant est l'eau, le mot hydratation, plutôt que la solvatation, est utilisé. Une dissolution d'ovule s'appelle une oolyse.
Dissolution chimique
En chimie, la dissolution chimique consiste à mélanger un soluté dans un solvant. L'eau est le solvant universel pour les solutés polaires. La dissolution fractionnée, par exemple, est utilisée pour séparer un mélange de solides, dans lequel l'un est soluble dans un solvant et l'autre ne l'est pas.
Dissolution chimique de sel (chlorure de sodium) dans l'eau pure :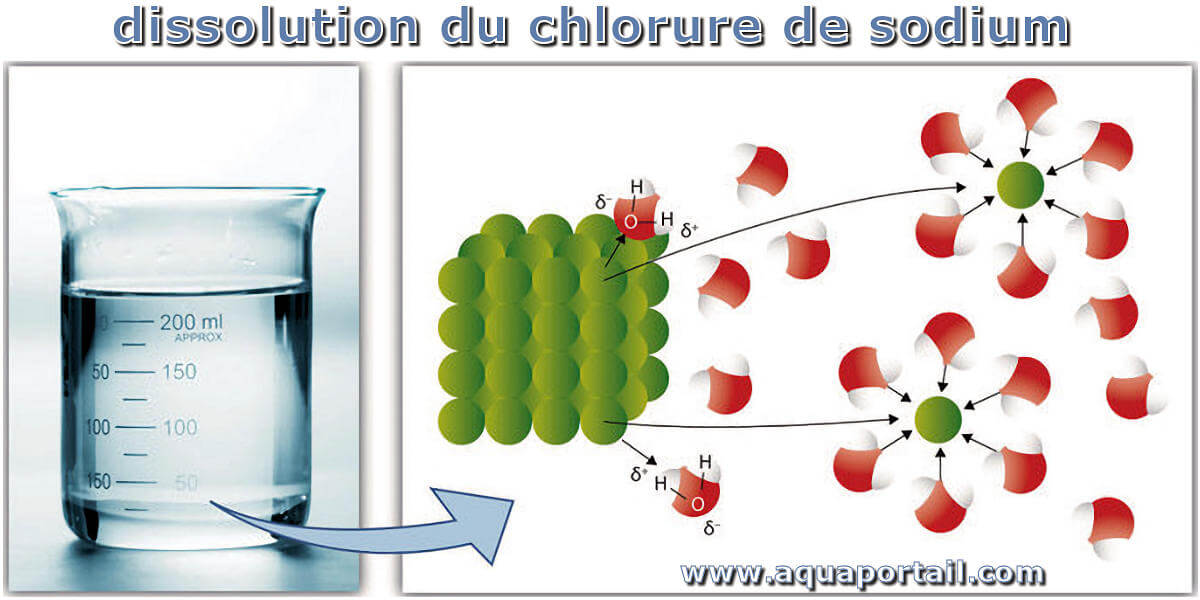
Lors de la dissolution du sel (chlorure de sodium) dans de l'eau pure, un soluté se dissout. Les particules individuelles de soluté sont entourées de particules de solvant. Finalement, la particule se détache du soluté restant, entourée de molécules de solvant en solution.
Par exemple, le cas existe avec un mélange d'hydroxyde de potassium et de carbonate de calcium. Comme l'hydroxyde est assez soluble dans l'eau (ce qui n'est pas le cas du carbonate), en ajoutant cette substance au système, l'hydroxyde se dissout. Par filtration, le carbonate, le composant non dissolvant, est séparé.
Dissolution physique
La dissolution physique est un processus physico-chimique consistant à mélanger un solide, un gaz ou un liquide dans un autre liquide ou un autre gaz, qui crée un mélange homogène, impossible à séparer par des moyens mécaniques. Un tel mélange s'appelle une solution et la substance dans laquelle il est mis en oeuvre s'appelle un solvant.
Dissolution physique de sel dans l'eau :
Lors de la dissolution de sels solides, il se forme une solution ionique (vraie) ou un colloïde.
Le processus de dissolution physique n'est pas considéré comme une réaction chimique, car de nouvelles liaisons chimiques ne se forment pas à la suite de l'interaction entre le soluté et le solvant. Cependant, la dissolution peut être accompagnée de processus de désintégration et de formation de liaisons hydrogène instables, de génération d'ions et de structures supramoléculaires. Ces processus s'appellent solvolyse, solvatation et dissociation électrolytique. Cependant, le principal moteur des processus de dissolution réside dans les interactions intermoléculaires restantes et faibles entre le soluté et le solvant et dans la volonté du système d'atteindre la plus grande entropie et la plus faible énergie interne.
Si la dissolution s'accompagne d'une réaction chimique ou électrochimique entraînant une modification permanente de la composition chimique, ce processus est appelé dissolution chimique (la "vraie" dissolution) ou dissolution électrochimique.
Les processus de dissolution s'accompagnent souvent d'effets thermiques et augmentent presque toujours l'entropie du système. Parfois, cependant, il peut arriver que lors de la dissolution, le système soit auto-ordonné et que son entropie diminue, mais il doit être compensé par l'augmentation de l'entropie de l'environnement.
Chaleur de dissolution
La chaleur de dissolution, c'est-à-dire l'effet thermique total du processus de dissolution, dépend du bilan énergétique de la disparition des interactions survenant dans le soluté initial et de la formation de nouvelles interactions entre le soluté et le solvant. En fonction du processus qui prévaut énergétiquement dans un système donné (substance dissolvante-soluté), le processus de dissolution peut entraîner un refroidissement (processus endothermique) ou un réchauffement (processus exothermique) de l'ensemble du système.
Par exemple, lorsque le cristal de chlorure de potassium se dissout dans l'eau, les liaisons ioniques entre les ions chlorure Cl- et le potassium K+ sont brisées dans un premier temps, ce qui nécessite une dépense d'énergie thermique et conduit à une augmentation de l'entropie du système entier. Dans la deuxième étape, les ions extraits du cristal sont solvatés, c'est-à-dire que les molécules d'eau entourant les deux ions sont formées en raison de l'interaction dipôle permanent-ion, qui est le processus par lequel l'énergie est libérée et que l'entropie du système diminue. Dans le cas du chlorure de potassium, l'effet thermique du premier procédé est décisif, et la dissolution de ce sel dans l'eau provoque le refroidissement de l'ensemble du mélange, tandis que, par exemple, la dissolution de l'acide sulfurique est associée à un fort effet de chauffage.
Pour calculer l'enthalpie de solution (chaleur de solution) à l'aide de données expérimentales :
- Quantité d'énergie libérée ou absorbée est calculée. q = m × Cg × ΔT.
- Calculer les moles de soluté. n = m M.
- Quantité d'énergie (chaleur) libérée ou absorbée par mole de soluté est calculée. ΔHsoln = q n.
Solubilité des substances
La solubilité indique quelle quantité de substance peut être transférée à une certaine quantité de solvant. Par exemple pour les substances inorganiques, la solubilité en grammes de solide est donnée pour 100 g de solvant (combien de grammes de matériau sont dissous dans 100 grammes de solvant). Cependant, la solubilité peut également être exprimée par d'autres valeurs de concentration, si nécessaire en pourcentage.
La loi de Henry régit les gaz dissous dans les liquides (le plus souvent dans l'eau). L'équation exprime l'état d'équilibre du système. La solubilité des gaz dans les liquides diminue avec la température.
Utilisation biologique de la dissolution ionique
Le mécanisme exact d'interaction entre les produits de dissolution ionique de matériaux inorganiques et les cellules humaines n'est pas entièrement compris. Cela a entraîné des travaux de recherche considérables dans la communauté des biomatériaux au cours de la dernière décennie.
Ainsi, les rapports de la littérature qui ont étudié spécifiquement l'effet des produits de dissolution des verres bioactifs silicatés et des vitrocéramiques en relation avec l'ostéogenèse et l'angiogenèse. En particulier, les progrès récents réalisés dans la fabrication de biomatériaux denses et d'échafaudages dopés avec des oligo-éléments (par exemple, Zn, Sr, Mg et Cu) et les études sur l'effet de ces éléments sur les performances biologiques de l'échafaudage sont détaillés.
Une dissolution ionique :
Exemple illustratif d'une dissolution ionique avec la solubilité de la silice amorphe, qui a une concentration de saturation de 77 ppm.
De toute évidence, la réponse biologique aux matériaux artificiels dépend de nombreux paramètres tels que la composition chimique, la topographie, la porosité et la taille des grains. La cinétique de libération des ions des matériaux et l'effet spécifique des produits de dissolution ionique libérés modifient le comportement des cellules humaines, offrant également une portée pour de futures enquêtes. Les performances biologiques des verres de silicate purs et dopés, des verres à base de phosphate avec de nouvelles compositions spécifiques ainsi que plusieurs autres composés à base de silicate sont discutées en détail. Les cellules étudiées dans les articles examinés comprennent les cellules ostéoblastiques et ostéoclastiques humaines ainsi que les cellules endothéliales et les cellules souches.
Rôle de la dissolution dans le devenir biologique
Il a été démontré que la dissolution, la translocation et la disposition jouent un rôle clé dans le devenir et les effets des particules et des fibres inhalées. Les concepts qui ont été appliqués dans la gamme de taille microscopique (au micron) peuvent être utilement appliqués à la gamme nanométrique, mais de nouveaux défis se présentent sur la base de la petite taille et du changement possible dans la relation dissolution :translocation.
La taille de la molécule composant elle-même peut être à l'échelle nanométrique. La concentration de soluté, la surface, la morphologie de surface, l'énergie de surface, les propriétés de la couche de dissolution, les espèces adsorbantes et l'agrégation sont des paramètres pertinents pour considérer la dissolution à l'échelle nanométrique. En ce qui concerne l'étiopathologie (étiologie et pathologie) induite par ces types de particules, les métriques de dose (nombre de particules, surface, masse ou forme) ne sont pas encore bien définies.
Les procédures analytiques pour évaluer la dissolution et la translocation comprennent l'analyse chimique et la caractérisation des particules. La lixiviation des substituants des surfaces des particules peut également être importante. La compartimentation au sein des voies respiratoires peut ajouter une autre dimension de complexité.
La dissolution peut être une étape critique pour certains matériaux à l'échelle nanométrique dans la détermination du devenir dans l'environnement et dans le corps. En combinant des aspects de la toxicologie des particules, de la science des matériaux et de la chimie analytique, les études fournissent une base utile pour le développement d'essais de dissolution pertinents pour les particules nanométriques.
Dissolution géologique
En géologie, la solubilité des substances est différente et dépend principalement de la température, du pH et de la chimie de l'environnement dans laquelle le minéral est présent (par exemple, la solubilité de la calcite dans l'eau ordinaire est très faible, mais lorsque l'eau réagit avec le CO2, la solubilité de la calcite augmente).
Dissolution politique
En politique et autres actions de groupe, la dissolution est la fermeture ou la révocation d'une assemblée, d'une société ou d'un organisme officiel. Par exemple, la dissolution d'un mariage met fin à celui-ci.
Synonymes, antonymes
Voir tous les synonymes pour "dissolution".7 synonymes (sens proche) de "dissolution" :
1 antonyme (sens contraire) :
- solidification
Les mots ou les expressions apparentés à DISSOLUTION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot DISSOLUTION est dans la page 3 des mots en D du lexique du dictionnaire.
Mots en D à proximité
dissépiment dissimilation dissipateur d'énergie dissipation dissociation dissolutiondissymétrie distal distension distillation distique
En rapport avec "dissolution"

La décomposition est un processus de séparation d'une matière en composés plus simples. Elle est l'action de briser, ou de fragmenter quelque chose en plus...

La dissociation est la décomposition réversible d'une combinaison. Un composé est subdivisé en éléments plus petits qui peuvent à nouveau être assemblés...

L'hydratation fait référence à une réaction chimique dans laquelle l'eau est incorporée dans un composé par solvatation ou implique l'absorption d'eau dans...
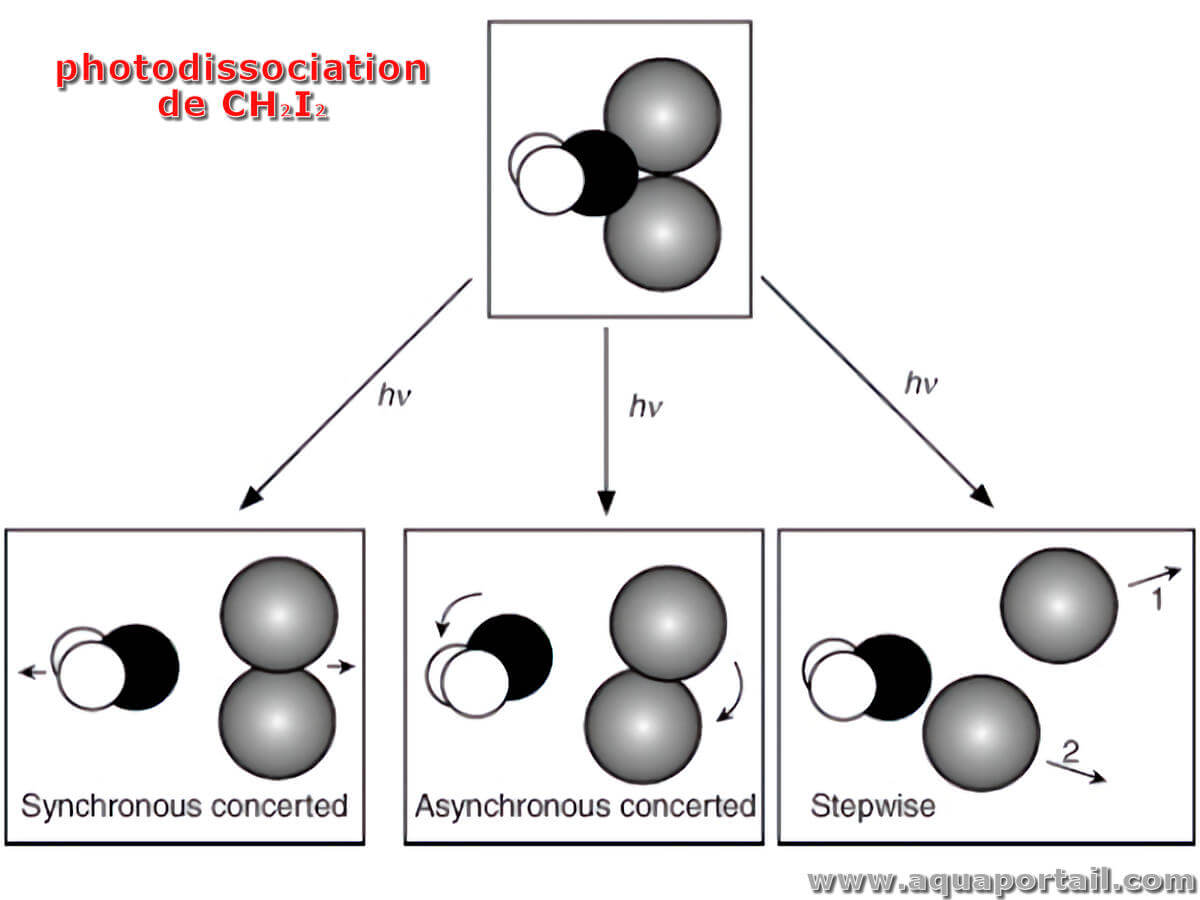
La photodissociation est une réaction chimique qui dégrade les composés en bombardant la molécule de photons.
