Organochloré
Définition
Un composé organochloré a pour effet sur les organisme de se constituer comme un neurotrope qui altère le fonctionnement des canaux sodium indispensables à la transmission de l'influx nerveux. Un composé organochloré, ou un hydrocarbure chloré, un chlorocarbure ou un composé organique chloré est un composé chimique organique : il est composé d'un squelette d'atomes de carbone, dans lequel certains des atomes d'hydrogène liés au carbone ont été remplacé par des atomes de chlore, liés par des liaisons covalentes au carbone. Par exemple parmi les édulcorants : le sucralose.
Le chloroforme est un composé organochloré :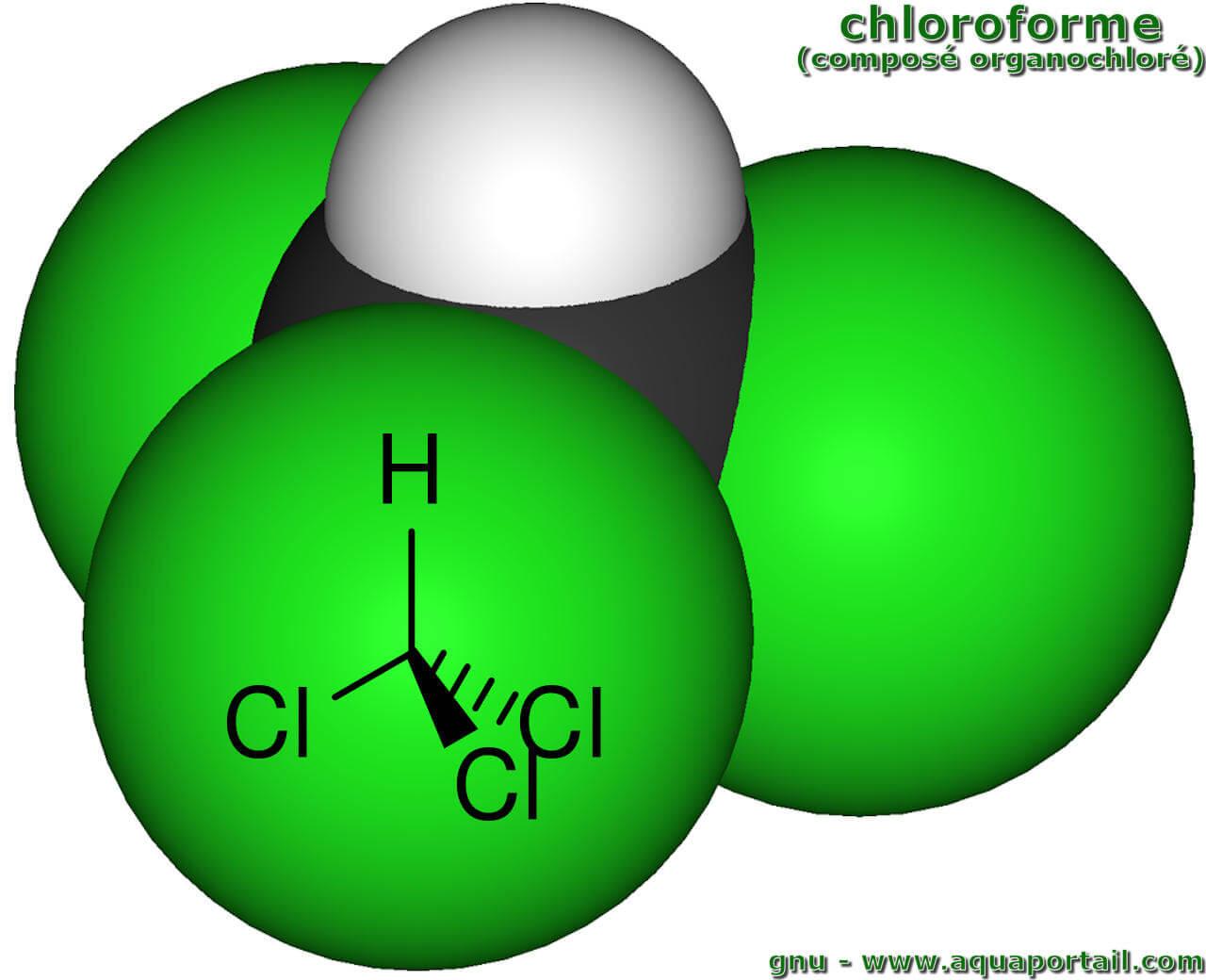
Parmi de nombreux organochlorés, le chloroforme est l'un des plus connu du grand public. Dans la chimie organochlorée, les propriétés et les réactions des composés organiques dans lesquels au moins une liaison covalente se produit entre le carbone et le chlore sont étudiées.
Explications
La grande variété structurelle des organochlorés et des propriétés physiques divergentes permettent de nombreuses applications. De nombreux dérivés chlorés sont controversés en raison des effets de ces composés sur l'environnement et la santé humaine et animale, car ils sont généralement nocifs pour les êtres vivants peuvent devenir cancérogènes. Beaucoup d'entre eux sont utilisés pour leur action insecticide ou pesticide; d'autres sont des sous-produits de l'industrie.
Les organochlorés sont des composés très utiles dans de nombreuses applications, mais certains sont extrêmement préoccupants pour l'environnement.
Basé sur un produit organique dérivé du chlore, l'utilisation a été faite dans un pesticide comme le DDT, mais aussi dans des solvants ou fongicides, le toxaphène, les PCB et dioxines, le trichlorométhane CHCl3, le tétrachlorure de carbone CCl4... La classe des chloroalcanes (alcanes avec un ou plusieurs atomes d'hydrogène substitués par le chlore) fournit des exemples courants.
L'emploi des organochlorés est réglementé car leurs effets sur la nature ne sont pas sans conséquence.
En aquarium, il faudra faire particulièrement à leur emploi (on en trouve dans des produits utilisés en cuisine) car ils peuvent être toxiques pour les poissons.
Propriétés physiques
Les atomes de substituant chlore modifient les propriétés physiques des composés organiques de différentes manières. Ils ont tendance à être plus denses que l'eau, en raison de la masse atomique élevée du chlore. Ces atomes de chlore induisent des interactions intermoléculaires plus fortes que lorsqu'ils possèdent des atomes d'hydrogène. L'effet est illustré par l'évolution des points d'ébullition : méthane (-161,6 °C), chlorure de méthyle (-24,2 °C), dichlorométhane (40 °C), chloroforme (61,2 °C), et tétrachlorure de carbone (76,72 °C).
L'augmentation des interactions intermoléculaires est attribuée à la fois aux effets des forces de van der Waals et à la polarité plus grande des liaisons.
La chloration modifie les propriétés physiques des hydrocarbures de plusieurs manières. Les composés sont généralement plus denses que l'eau en raison du poids atomique plus élevé du chlore par rapport à l'hydrogène. Les organochlorés aliphatiques sont des agents alkylants car le chlorure est un groupe partant.
Présence dans la nature
Pendant longtemps, on a supposé qu'il n'y avait pratiquement aucune source naturelle de composés organiques chlorés. Grâce à des analyses efficaces, la détection d'organohalogènes naturels tels que le Bipyrrol Q1 est devenue de plus en plus courante au cours des dernières années.
Les champignons dégradant le bois sont une source importante de composés aromatiques chlorés formés naturellement. Fait intéressant, certains champignons sont même capables de synthétiser de novo des chloroanisyles à partir du glucose.
Bien qu'ils soient plus rares que les composés organiques non halogénés, de nombreux composés organochlorés ont été isolés à partir de sources naturelles allant de la bactérie à l'homme. Les composés organiques chlorés sont présents dans presque toutes les classes de biomolécules, y compris les alcaloïdes, les terpènes, les acides aminés, les flavonoïdes, les stéroïdes et les acides gras.
Les organochlorés, y compris les dioxines, sont produits dans des environnements à haute température tels que les incendies de forêt. Des dioxines ont été trouvées dans les cendres préservées des incendies provoqués par les rayons avant la production de dioxines synthétiques. En outre, de nombreux hydrocarbures chlorés simples tels que le dichlorométhane, le chloroforme et le tétrachlorure de carbone ont été isolés à partir d'algues marines.
La majeure partie du chlorométhane présent dans l'environnement est produite naturellement par la décomposition de vestiges biologiques, de feux de forêt et de volcans.
L'épibatidine organochlorée naturelle, un alcaloïde isolé de grenouilles, exerce un puissant effet analgésique et a stimulé la recherche de nouveaux médicaments contre la douleur. Les grenouilles obtiennent l'épibatidine par le biais de leur régime alimentaire, puis la séquestrent sur leur peau. Les sources alimentaires probables sont les Coléoptères, les fourmis, les acariens et les mouches.
Parallèlement, plus de 3 800 organohalogènes d'origine naturelle sont connus. Cependant, à l'exception du chlorure de méthyle et du bipyrrole Q1 marins, les concentrations de la plupart des autres composés sont bien inférieures à celles d'origine anthropique. La grande variété de composés organiques halogénés d'origine naturelle et leur large distribution sont certainement une des raisons de la biodégradabilité (dégradabilité) des polluants anthropiques.
Classification
Les nombreux hydrocarbures chlorés connus peuvent être divisés en chloroalcanes et chloroalcènes aliphatiques et hydrocarbures chlorés aromatiques. À mesure que le degré de chloration augmente, la stabilité et la lipophilie (substance lipidique) des substances augmentent. En conséquence, l'absorption est rendue plus difficile pour la dégradation des microorganismes et l'énergie d'activation nécessaire pour décomposer les substances augmente. L'hydrophobie accrue (insolubilité dans l'eau) des substances provoque également une accumulation dans les tissus adipeux des animaux.
En raison de la grande électronégativité du chlore, de nombreux hydrocarbures chlorés ont de forts moments dipolaires, ce qui entraîne souvent des constantes diélectriques élevées.
Histoire
Les chloro-organiques sont synthétisés depuis les années 1930, par exemple par photochloration. L'introduction d'un atome de chlore dans le squelette carboné entraîne souvent une réduction de la combustibilité d'un composé organique. Les organochlorés sont donc souvent utilisés en tant que solvants organiques non inflammables, huiles hydrauliques et réfrigérants. Ils sont également utilisés comme précurseurs de synthèse ou pesticides.
Préparation
Les alcanes et les arylalcanes peuvent être traités au chlore dans des conditions de radicaux libres, à la lumière ultraviolette. Cependant, le degré de chloration est difficile à contrôler. Les chlorures d'aryle peuvent être préparés par halogénation de Friedel-Crafts en utilisant du chlore et un acide de Lewis comme catalyseur.
La réaction de l'haloforme, utilisant du chlore et de l'hydroxyde de sodium, est également capable de générer des halogénures d'alkyle à partir de méthylcétones et de composés apparentés. Le chloroforme était auparavant produit de cette manière. Voir aussi un halogénure organique et le chlorofluorocarbone.
Le chlore subit des réactions d'addition à de multiples liaisons, telles que celles des alcènes, alcynes et autres, donnant des composés di, tri ou tétrachlorés.
Les alcènes réagissent avec le chlorure d'hydrogène (HCl) pour donner des chlorures d'alkyle. Par exemple, la production industrielle de chloroéthane provient de la réaction de l'éthylène avec HCl : H2C=CH2 + HCl → CH3CH2Cl.
Les alcools secondaires et tertiaires réagissent avec le réactif de LUCAs (chlorure de zinc) dans de l'acide chlorhydrique concentré pour obtenir l'halogénure d'alkyle correspondant. Cette réaction sert donc de méthode de classification des alcools. Appelé le réactif de Lucas, ce mélange a déjà été utilisé en analyse organique qualitative pour classifier les alcools.
Les chlorures d'alkyle sont plus facilement préparés en traitant des alcools avec du chlorure de thionyle (SOCl2) ou du pentachlorure de phosphore (PCl 5), mais aussi couramment avec du chlorure de sulfuryle (SO2Cl2) et du trichlorure de phosphore (PC13). En laboratoire, le chlorure de thionyle est particulièrement pratique, car les sous-produits sont gazeux.
Réactions
Les chlorures d'alkyle sont des composants polyvalents de la chimie organique. Bien que les bromures et les iodures d'alkyle soient plus réactifs, les chlorures d'alkyle ont tendance à être moins chers et plus faciles à obtenir. Les chlorures d'alkyle sont facilement attaqués par des nucléophiles :
- Le chauffage d'halogénures d'alkyle avec de l'hydroxyde de sodium ou de l'eau donne des alcools.
- Les réactions avec les alkoxydes ou les arxides produisent des éthers lors de la synthèse des éthers de Williamson.
- La réaction avec les thiols donne des thioéthers.
- Les chlorures d'alkyle réagissent facilement avec les amines pour donner des amines substituées.
- Les chlorures d'alkyle sont remplacés par d'autres halogénures plus mous tels que l'iodure dans la réaction de Finkelstein.
- La réaction avec d'autres pseudohalogénures, tels que les azotures, les cyanures et les thiocyanates, est également possible.
- En présence d'une base forte, les chlorures d'alkyle subissent une déshydrohalogénation pour donner des alcènes ou des alcynes.
- Les chlorures d'alkyle réagissent avec le magnésium pour donner les réactifs de Grignard, transformant un composé électrophile en un composé nucléophile.
- La réaction de Wurtz couple de manière réductrice les radicaux de deux halogénures d'alkyle, tandis que l'halogénure se lie au sodium.
Voir un halogénure organique.
Applications
La plus grande application des organochlorés en chimie est la production de chlorure de vinyle. La production annuelle en 1985 était d'environ 18 millions de tonnes, passant en 2005 à plus de 32 millions de tonnes 10 presque toutes sont devenues du polychlorure de vinyle (PVC).
La plupart des hydrocarbures chlorés de faible poids moléculaire tels que le chloroforme, le dichlorométhane, le dichloroéthène et le trichloroéthane sont des solvants utiles. Ces solvants ont tendance à être relativement non polaires, ils sont donc non miscibles à l'eau et efficaces pour les applications de nettoyage, telles que le dégraissage et le nettoyage à sec. Plusieurs milliards de kilogrammes de chlorométhanes sont produits chaque année, principalement par chloration du méthane : CH4 + x Cl2 → CH4-xClx + x HCl.
Le plus important est le dichlorométhane, qui est principalement utilisé comme solvant. Le chlorométhane est un précurseur des chlorosilanes et des silicones. D'importance historique, mais à une plus petite échelle aujourd'hui, nous avons le chloroforme, utilisé principalement comme précurseur du chlorodifluorométhane (CHClF 2) et du tétrafluoroéthène utilisé dans la fabrication du téflon.
De nombreux pesticides contiennent du chlore. Quelques exemples notables sont : DDT, dicofol, heptachlore, endosulfan, chlordane, aldrine, Dieldrine, endrine, lindane, mirex et pentachlorophénol. Ceux-ci peuvent être hydrophiles ou hydrophobes en fonction de leur structure moléculaire. Un grand nombre de ces agents ont été interdits dans plusieurs pays, notamment Mirex et Aldrin.
Les biphényles polychlorés (PCB) étaient autrefois couramment utilisés comme isolants électriques et agents de transfert de chaleur. Son utilisation en général a été éliminée en raison de problèmes de santé. Les PCB ont été remplacés par des polybromodiphényléthers (PBDE), qui présentent des problèmes de toxicité et de bioaccumulation similaires.
Toxicité
Certains types de composés organochlorés ont une toxicité significative chez les plantes ou les animaux, y compris l'homme. Les dioxines sont produites lorsque des matières organiques sont brûlées en présence de chlore, et certains insecticides tels que le DDT sont des polluants organiques persistants (POP) qui présentent un danger lorsqu'ils sont rejetés dans l'environnement. Par exemple, le DDT, qui était largement utilisé pour lutter contre les insectes nuisibles au milieu du 20ème siècle, s'accumule également dans les chaînes alimentaires et cause des problèmes de reproduction (tels que l'éclaircie de la coquille de l'oeuf) chez certaines espèces d'oiseaux.
Lorsque les solvants chlorés, par exemple le tétrachlorure de carbone, ne sont pas éliminés correctement, ils s'accumulent dans les eaux souterraines. Certains composés organochlorés hautement réactifs, tels que le phosgene, ont été utilisés comme agents de guerre chimiques.
Cependant, la présence de chlore dans un composé organique ne garantit pas sa toxicité. De nombreux organochlorés sont suffisamment sûrs pour être consommés dans les aliments et les médicaments. Par exemple, les pois et les haricots contiennent des hormones naturelles végétales chlorées, l'acide 4-chloroindol-3-acétique (4-Cl-IAA); et l'édulcorant sucralose (Splenda) est largement utilisé dans les produits diététiques. En 2004, il y avait au moins 165 composés organochlorés approuvés dans le monde pour être utilisés en tant que médicaments, notamment l'antibiotique naturel vancomycine, l'antihistaminique loratadine (Claritin), l'antidépresseur sertraline (Zoloft), l'antépileptique lamotrigine (Lamictal) et le anesthésique par inhalation d'isoflurane.
Rachel Carson a introduit le sujet de la toxicité des pesticides, le DDT, dans l'opinion publique de son livre de 1962, Silent Spring. Alors que de nombreux pays ont éliminé l'utilisation de certains types de composés organochlorés, comme l'interdiction par les États-Unis. De l'utilisation du DDT, le DDT, les PCB et autres résidus organochlorés persistants sont encore présents chez l'homme et les mammifères sur toute la planète de nombreuses années après que leur production et leur utilisation aient été limitées. Dans les zones arctiques, les concentrations de mammifères marins sont particulièrement élevées. Ces produits chimiques sont concentrés chez les mammifères et se retrouvent même dans le lait maternel humain. Les mâles de ces espèces ont tendance à avoir des niveaux beaucoup plus élevés, car les femelles réduisent leur concentration lors du transfert à leur progéniture par l'allaitement.
Synonymes, antonymes
Voir tous les synonymes pour "organochloré".3 synonymes (sens proche) de "organochloré" :
- chlorocarbure
- composé organique chloré
- hydrocarbure chloré
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ORGANOCHLORÉ sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ORGANOCHLORE est dans la page 2 des mots en O du lexique du dictionnaire.
Mots en O à proximité
organismes coloniaux organismes commensaux organismes parasites organite organobromé organochloréorganogenèse organographie organoleptique organométallique organotrope
En rapport avec "organochloré"

Un composé chimioorganotrophe subira une chimiosynthèse par oxydation de substances organiques pour libérer de l'énergie, synonyme de chimiohétérotrophe.
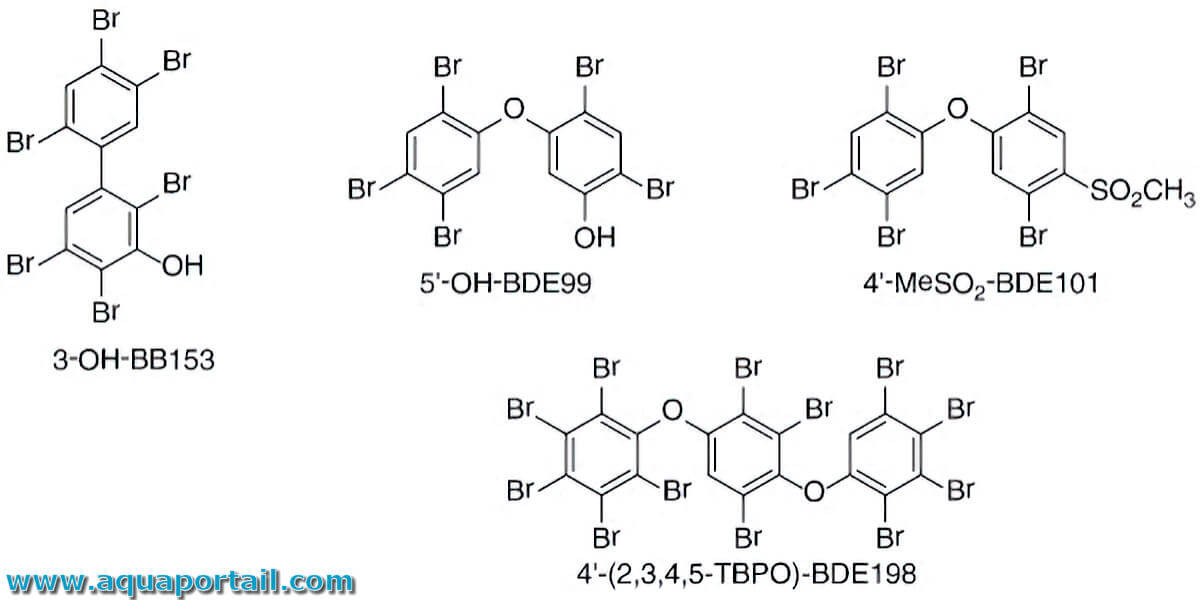
Un composé organobromé est une substance organique contenant du brome. Les composés organobromés contiennent des liaisons covalentes entre les atomes...
En biologie et embryologie, une organogenèse est une formation et un développement des organes au sein d'un être vivant.
En biologie, l'organographie, ou l'organologie, consiste en l'étude écrite des organes (tous les organes).
