Une transaminase (aminotransférase)
Une transaminase, ou une aminotransférase, est une enzyme qui catalyse un type de réaction entre un acide aminé et un acide alpha-cétonique. Les aminotransférases ou transaminases sont un groupe d'enzymes du groupe des transférases, car elles transfèrent des groupes amino d'un métabolite à un autre, généralement des acides aminés.
Une aspartate transaminase :
Une transaminase est une enzyme qui catalyse une réaction de transamination particulière. Vue d'une aspartate transaminase (aminotransférase) de la bactérie Escherichia coli avec un cofacteur de pyridoxal 5′-phosphate.
Généralités
La réaction des transaminases est librement réversible et sa constante d'équilibre est proche de l'unité. Ces enzymes sont inductibles, car leur activité peut être augmentée par l'action de diverses hormones telles que la thyroxine ou les glucocorticoïdes.
La nomenclature des transaminase ou aminotransférases est établie à partir de l'acide aminé à partir duquel ils transfèrent le groupe amino. Les numéros EC 2.6 représentent les enzymes transférases transférant des groupes contenant de l'azote.
Mécanismes de transamination
Les transaminases ont besoin d'un coenzyme appelé phosphate de pyridoxal (dérivé de la pyridoxine ou de la vitamine B6) pour exercer sa fonction; Il agit en tant que support du groupe amino entre les substrats, en alternant sa structure entre la forme aldéhyde (phosphate de pyridoxal, PLP) et la forme aminée (pyridoxamine-5-phosphate, PMP). Le PLP contient un noyau pyridine légèrement basique et un hydroxyle légèrement acide, ce qui lui permet d'être très stable car très flexible.
Le groupe le plus important dans le PLP est l'aldéhyde. Le phosphate de pyridoxal est lié de manière covalente au centre actif des transaminases par le groupe amino-epsilon d'un résidu de lysine et est transféré pendant la réaction à l'acide aminé, formant une base de Schiff, à partir de laquelle les modifications chimiques qui interviennent sont produites. conduire à une transamination. Certaines aminotransférases utilisent cependant le pyruvate comme cofacteur.
Les transaminases catalysent les réactions de transamination, importantes en particulier pour la synthèse d'acides aminés non essentiels et pour la dégradation de la plupart des acides aminés perdant leur groupe amino par transamination, à l'exception des acides aminés lysine et thréonine, pour lesquels cette réaction n'est pas nécessaire. possible Il existe une aminotransférase pour chaque acide aminé, sauf pour les deux.
Les principales aminotransférases sont hépatiques :
- L'alanine aminotransférase (ALT), ou glutamate-pyruvate transaminase (GPT), se situe principalement dans le cytosol de l'hépatocyte, d'où son surnom uniloculaire.
- L'aspartate aminotransférase (AST), ou glutamate-oxaloacétate transaminase (GOT), située principalement dans la mitochondrie et dans le cytosol, d'où son appellation d'enzyme biloculaire. Ceci est présent, en plus du foie, dans d'autres organes, tels que, par ordre d'abondance : le myocarde, le muscle squelettique, les reins, le cerveau, le pancréas, les poumons, les leucocytes et les érythrocytes.
La concentration de ces transaminases dans le plasma sanguin augmente dans diverses maladies. Parfois, le type spécifique d'aminotransférase surélevée suggère l'organe affecté par son abondance relative.
En transamination, le glutamate et l'α-cétoglutarate (α-KG), qui participent aux différentes réactions catalysées par les différentes aminotransférases, participent normalement en tant que donneur et receveur. La transamination consiste à transporter un groupe α-amino d'un α-aminoacide donneur vers le carbone en cétone d'un récepteur α-cétoacide.
Ce processus se déroule en deux étapes 5 et est catalysé par les aminotransférases spécifiques de chaque substrat :
- Dans la première étape, un acide a-aminé qui agira en tant que donneur transfère le groupe a-amino à l'enzyme transaminase, produisant l'acide a-céto correspondant et l'enzyme sera aminée.
- Dans une seconde étape, le groupe amino est transféré à l'accepteur α-cétoacide (α-cétoglutarate, pyruvate ou oxaloacétate) formant un nouvel acide aminé et régénérant l'enzyme.
La réaction d'aminotransférase intervient par un mécanisme de type ping-pong.
Rôle des aminotransférases dans le métabolisme
Les humains ingèrent de l'azote provenant des acides aminés de l'alimentation, des protéines et de l'ammoniac fixés par l'azote, comme de la bactérie de l'intestin, la glutamate déshydrogénase. La glutamine synthase convertit respectivement l'ammoniac en glutamate et en glutamine, dont les transaminases transfèrent leurs groupes amino et amido à d'autres squelettes carbonés par des réactions de transamination et de transamidation.
La réaction de transamination a lieu dans le cytosol et dans les mitochondries. Comme ils sont réversibles, les α-céto acides peuvent être utilisés pour la synthèse d'acides aminés; par exemple, si les aliments contiennent les acides α-céto qui correspondent aux squelettes carbonés des acides aminés essentiels, ces acides aminés peuvent être synthétisés par une simple transamination, catalysée par l'aminotransférase correspondante.
Le sens de la réaction est déterminé par les concentrations de produits et de réactifs dans le foie, car les métabolites sont proches de l'équilibre :
- Le GOT catalyse la réaction vers la formation d'oxaloacétate : aspartate + α-cétoglutarate ⇔ oxaloacétate + glutamate.
- Le GPT catalyse une autre réaction, vers la formation de pyruvate : alanine + α-cétoglutarate ⇔ pyruvate + glutamate.
Le TPG revêt une grande importance dans la catalyse des réactions qui transfèrent le carbone et l'azote du muscle squelettique au foie sous forme d'alanine.
Dans le muscle squelettique, le pyruvate agit comme un récepteur pour un groupe amino et est transformé en alanine, qui est transportée dans le sang vers le foie, où l'alanine aminotransférase (ALT) transfère le groupe amino à l'a-cétoglutarate. régénérant ainsi le pyruvate qui peut être incorporé dans la gluconéogenèse en tant que source de carbone; le glucose qui en résulte peut revenir au muscle.
Ce processus, appelé cycle glucose-alanine, permet l'élimination de l'azote du muscle squelettique sous forme d'urée, transformation qui existera grâce au cycle de l'urée.
Synthèse d'acides aminés non essentiels
Les acides aminés non essentiels sont ceux qui peuvent être synthétisés dans le corps sans qu'il soit nécessaire de les ingérer, assurant ainsi le fonctionnement correct de tous les organes. Ce sont : l'alanine, l'asparagine, l'aspartate, la cystéine, le glutamate, la glutamine, la glycine, la proline, la sérine et la tyrosine.
La transamination jouera un rôle important dans la synthèse des acides aminés non essentiels. L'arginine, la méthionine et la phénylalanine peuvent être synthétisées, mais pas assez dans ces acides aminés pour couvrir les fonctions de notre métabolisme, ils sont donc considérés comme essentiels.
Le glutamate est formé à partir d'ammoniac et d'α-cétoglutarate par une réaction catalysée par la glutamate déshydrogénase. L'aspartate peut être synthétisé à partir d'asparagine ou par transamination catalysée par l'aspartate aminotransférase.
L'asparagine et la glutamine sont synthétisées par l'asparagine synthétase et la glutamine synthétase, respectivement. La glutamine est produite en fixant l'azote du glutamate et l'asparagine est produite par transamination.
La liaison de l'ATP avec la méthionine forme la S-adénosylméthionine, à laquelle un groupe SH est ajouté pour former l'homocystéine, qui réagit à son tour avec la sérine donnant de la cystathionine, ce qui libère un ion ammonium et forme de la cystéine et de l'α-cétobutyrate.
La tyrosine est synthétisée à partir de phénylalanine par une réduction dépendante du NADH qui catalyse la phénylalanine hydroxylase en utilisant la bioptérine comme cofacteur. La transamination de phénylalanine donne l'acide phénylpyruvique en tant que produit, lequel est réduit en phénylacétate et en phénylactate.
L'ornithine et la proline sont dérivées du glutamate. L'ornithine est synthétisée à partir de glutamate lorsqu'il manque de l'arginine dans l'alimentation, principale source d'ornithine.
La sérine est synthétisée à partir de 3-phosphoglycérate, qui est converti en acide céto par une déshydrogénase à l'aide de NADH. La sérine peut être précurseur de la glycine par une transamination catalysée par la sérine hydroxyméthyltransférase (SHMT1 s'il s'agit de l'enzyme cytosolique ou SHMT2 s'il s'agit de l'enzyme mitochondrial) dans laquelle le groupe hydroxyméthyle est transféré de la sérine au tétrahydrofolate (THF). obtention en tant que produits de glycine et de N5, N10-méthylène-THF.
La glycine peut également être un précurseur de la sérine. La glycine joue un rôle important dans l'anabolisme des nucléotides de la purine, du glutathion, de la créatine, etc.
Les réactions de transamination sont réversibles, tandis que les réactions de transamidation nécessitent de l'ATP et sont considérées comme irréversibles. Le groupe α-amino est essentiel à la synthèse des acides aminés et dérive de l'ammonium des groupes amino du L-glutamate. Parmi ceux-ci, la glutamine, la proline et l'arginine sont synthétisées. L'acide glutamique est la principale source de groupes amino pour la transamination.
Dégradation des acides aminés
L'excès d'azote potentiellement toxique des acides aminés est éliminé de la cellule par transamination, désamination et formation d'urée et les squelettes carbonés peuvent être transformés en glucides avec incorporation à la gluconéogenèse ou conservés sous forme d'acides gras lors de l'incorporation dans la voie. synthèse des acides gras.
Selon les produits obtenus dans ce processus de dégradation pour éliminer l'azote en excès, les acides aminés peuvent être classés en acides glycogéniques, cétogènes ou glucogéniques et cétogènes. Les acides aminés glycogéniques sont donnés sous forme de produit du pyruvate ou d'intermédiaires du cycle du TCA ou du cycle de Krebs, tels que l'α-cétoglutarate ou l'oxaloacétate, précurseurs du glucose s'ils sont incorporés à la gluconéogenèse.
Les seuls acides aminés cétogènes ne sont que deux : la lysine et la leucine. Ils donnent comme produit l'acétyl-CoA ou l'acétoacétyl-CoA, à partir desquels le glucose ne peut pas être produit. Les acides aminés isoleucine, phénylalanine, thréonine, tryptophane et tyrosine peuvent donner des produits précurseurs du glucose et des acides gras; c'est pourquoi ils sont classés comme glycogéniques et cétogènes.
Les acides aminés ne sont pas utilisés comme source d'énergie principale, bien que, s'ils ne sont pas nécessaires au renouvellement des protéines, ils ne peuvent pas être stockés, mais ils peuvent être utilisés tels quels.
La désamination est la première étape de toutes les voies de dégradation des acides aminés qui ont lieu dans la matrice mitochondriale. De nombreux acides aminés sont désaminés par transamination. Les aminotransférases éliminent le groupe a-amino de l'α-acide aminé donneur sur le carbone cétonique d'un récepteur d'acide a-céto (pyruvate, oxaloacétate ou α-cétoglutarate). Si l'accepteur du groupe amino est le cétoglutarate, le glutamate sera produit sous la forme d'un nouvel acide aminé.
On effectue ensuite une désamination oxydative dans laquelle l'enzyme acide glutamique déshydrogénase élimine le groupe amino de l'acide glutamique ou du glutamate. Cette réaction nécessite NAD+ et NADP+, régénère le cétoglutarate et forme de l'ammoniac toxique pour le cerveau. L'ammoniac sera transporté vers le foie, où se déroulera le cycle de l'urée, qui transformera ce composé en urée grâce à son union avec le CO2 pour pouvoir être excrété.
Le cétoacide peut être dégradé par descente via l'acide citrique ou transformé en glucose par la gluconéogenèse ou en lipides par la lipogenèse.
Niveau de transaminases dans le sang
L'élévation des transaminases est un processus très non spécifique qui peut survenir dans presque toutes les maladies du foie et dans de nombreuses maladies extrahépatiques.
Les taux de transaminases dans le sang servent d'indicateur pour détecter d'éventuelles pathologies des fonctions du foie. AST et ALT sont présents dans le sérum à des concentrations inférieures à 30–40 UI/L mais si le foie est endommagé, la perméabilité de la membrane cellulaire augmente et ces enzymes sont libérés dans le sang en grande quantité. quantités, ce qui n'est pas toujours associé à la nécrose des hépatocytes. En fait, il y a peu de corrélation entre les dommages aux cellules du foie et le degré d'élévation des transaminases.
Pratiquement toutes les maladies du foie entraînant des lésions nécro-inflammatoires peuvent en être la cause.
Les maladies hépatiques qui entraînent des taux élevés de transaminases dans le sang comprennent l'hépatite virale, la cirrhose, la stéatose hépatique, l'hépatite auto-immune, la consommation excessive d'alcool, les kystes ou tumeurs du foie et les obstructions graves de la voie biliaire.
Dans la plupart des types de maladies du foie, l'activité de l'ALT est supérieure à celle de l'AST. L'hépatite alcoolique est une exception à cette règle, car l'alcool augmente l'activité de l'AST dans le plasma, contrairement à d'autres formes d'hépatite; la plupart des lésions hépatiques diminuent l'activité des hépatocytes des deux formes d'AST, alors que l'alcool ne diminue que l'activité cytosolique.
Chez les alcooliques, le déficit en pyridoxine est courant, ce qui réduit l'activité de l'ALT et, finalement, l'alcool induit la libération d'AST mitochondrial à partir de cellules sans lésion cellulaire visible.
L'élévation des transaminases peut être causée par une maladie coeliaque non diagnostiquée ou traitée et peut être la seule manifestation de cette maladie en l'absence de symptômes digestifs ou autres. Dans la plupart des cas, le traitement par un régime sans gluten entraîne la normalisation du taux de transaminases.
D'autres maladies non hépatiques, telles que celles liées aux processus musculaires (dystrophies, polymyosite ou traumatismes ou infarctus aigu du myocarde), peuvent être à l'origine d'une augmentation marquée de la transaminase glutamique-oxaloacétique (AST), du fait de sa présence, d'ailleurs dans le foie, dans d'autres organes.
Tests de la fonction hépatique
En médecine, le fait d'avoir des taux de ces enzymes plus élevés que la normale n'indique pas nécessairement une maladie hépatique établie. Même si tel est le cas, plusieurs types de dommages au foie peuvent produire cet effet. Ainsi, l'interprétation des niveaux élevés d'ALAT et d'AST dépend du tableau clinique en général 3 (si le patient présente systématiquement des maladies associées à la consommation d'alcool ou d'autres drogues, à la gravité des symptômes, si jaunisse hépatique...).
Pour cette raison, des tests de la fonction hépatique sont effectués. Ils incluent la phosphatase alcaline (FA), la gamma-glutamyltranspeptidase (GGT), l'albumine, la bilirubine (totale et directe) et la coagulation.
En clinique, la première étape consiste à confirmer la persistance, après 6 à 8 semaines, de l'élévation des transaminases du patient (afin de confirmer une hypertransaminasémie prolongée), car de nombreux épisodes d'augmentation du nombre de transaminases sont normalisés lors d'un second contrôle.
Si le patient consomme de l'alcool de manière habituelle ou s'il est obèse, il sera nécessaire de changer ses habitudes pendant cette période S'il consomme un traitement pharmacologique, il doit le retirer chaque fois que possible.
Si les modifications analytiques persistent dans le nouveau contrôle analytique, il est nécessaire de lancer une recherche systématique des différentes causes hépatiques. Plusieurs tests sont effectués, notamment la bilirubine, la GGT, la FA (enzymes hépatiques pouvant être utiles pour guider l'étiologie du processus, par exemple vers une pathologie colostique), la glycémie, le cholestérol et les triglycérides, la numération sanguine, le temps de la prothrombine, protéinogramme et dosage des immunoglobulines, marqueurs de l'infection virale chronique, ferritine et transferrine du fer et du plasma, ainsi que l'échographie abdominale.
Si un diagnostic n'est pas encore disponible, il sera pris en compte que des maladies non hépatiques peuvent en être la cause. Si la cause n'est pas non plus détectée, un suivi clinique et analytique sera nécessaire.
Lors de l'examen de la possibilité d'un traitement spécifique (par exemple : antiviraux), ou si la maladie hépatique chronique est considérée comme grave et qu'il est nécessaire de procéder à une greffe, le patient sera référé au spécialiste.
En rapport avec "transaminase"
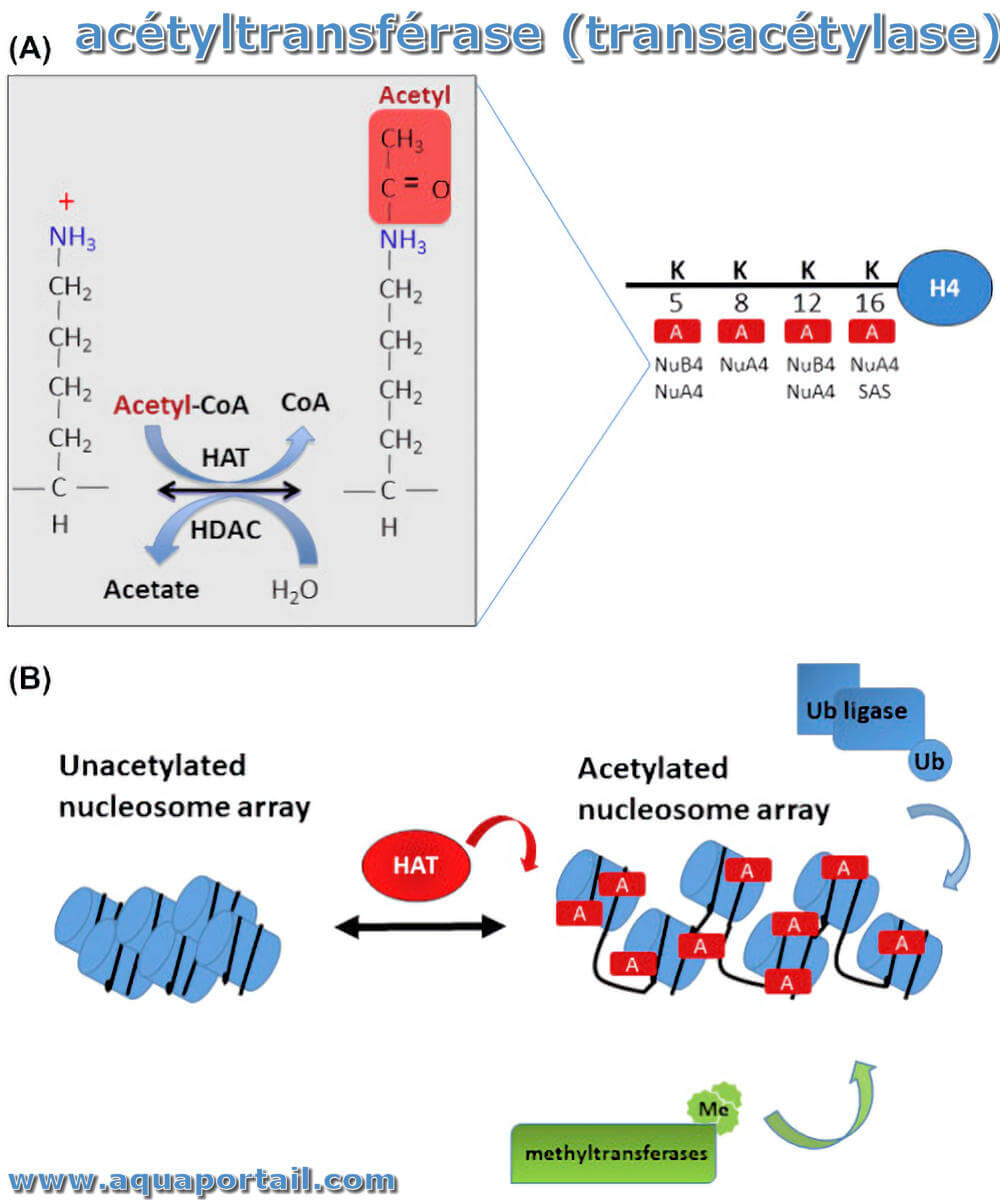
Une acétyltransférase est une enzyme qui transfère un groupe acétyle de l'acétyl CoA aux acides aminés lysine.
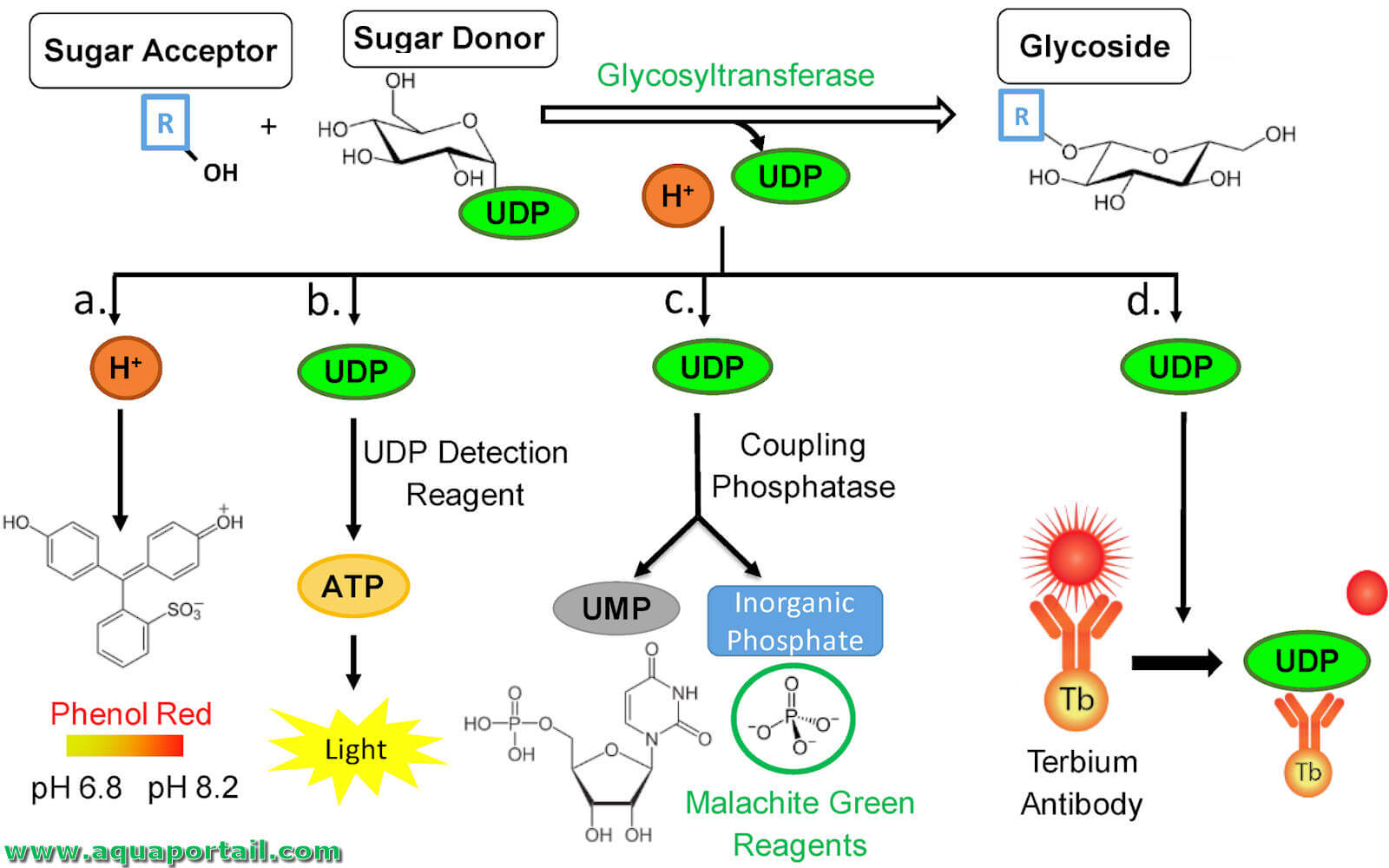
Une glycosyltransférase est une enzyme membranaire du réticulum endoplasmique, de l'appareil de Golgi et de la membrane plasmique qui catalyse la liaison d'un...
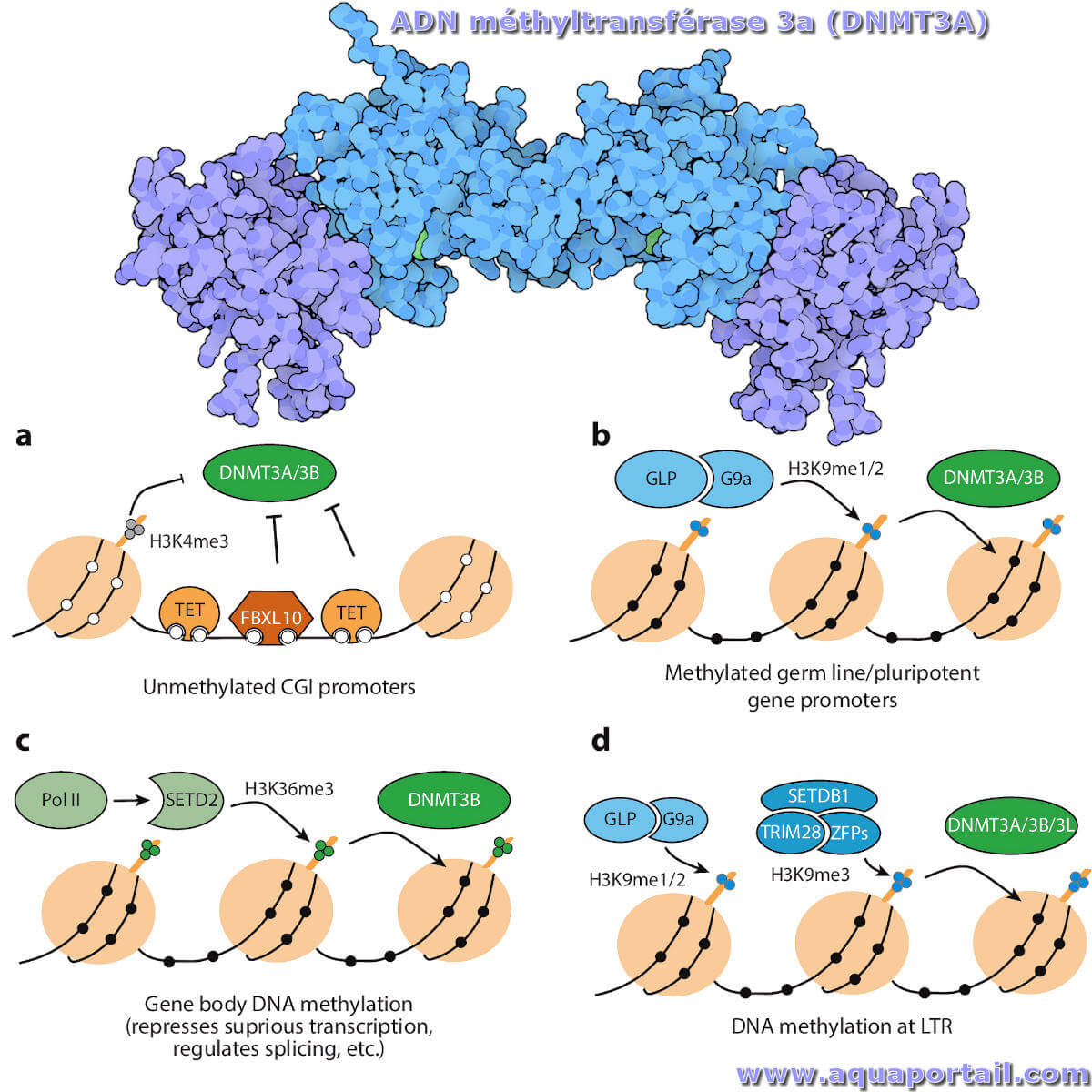
Une méthyltransférase est une enzyme qui catalyse le transfert d'un groupe méthyle du donneur de méthyle S-adénosyl-L-méthionine vers leurs substrats.
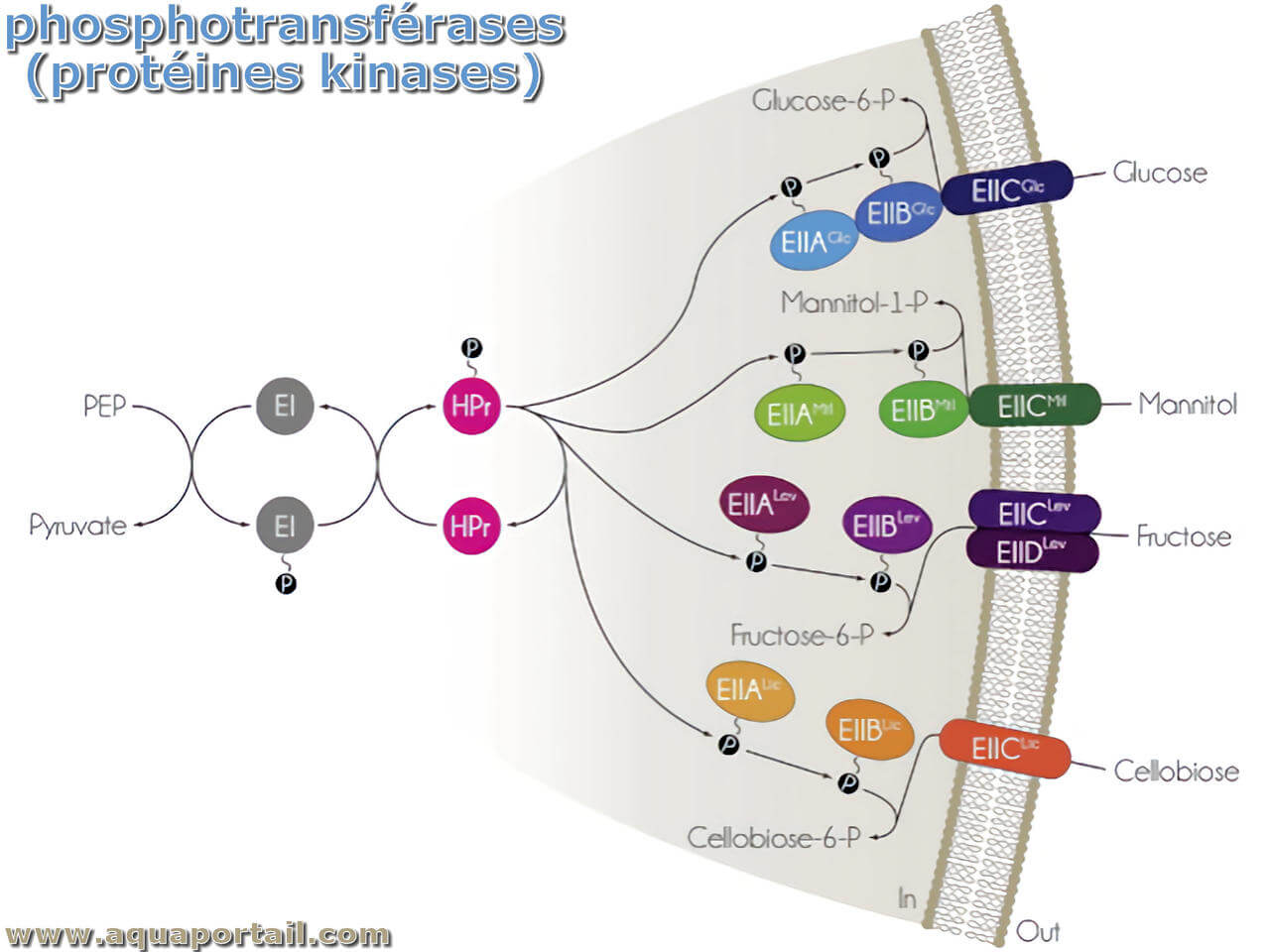
La phosphotransférase est une voie de transduction du signal impliquant un groupe phosphoryle provenant du phosphoénolpyruvate transféré au glucide transloqué...
