L'apoptose
L'apoptose est la mort cellulaire naturelle programmée d'une cellule. Les fragments résiduels sont éliminés par phagocytose. Elle est une voie de destruction ou de mort cellulaire programmée ou déclenchée par le même organisme. Afin de contrôler son développement et sa croissance, elle peut être de nature physiologique et être déclenchée par des signaux cellulaires génétiquement contrôlés.
Processus d'apoptose :
L'apoptose désigne un processus appelé mort cellulaire programmée, où la cellule se suicide, d'une manière étrange. Lorsque cela intervient, une chorégraphie de voies et de protéines cellulaires s'active pour la tuer sans trop de dégâts. Cela intervient normalement pendant le développement, par exemple lors du développement de la main de l'embryon.
Généralités
L'apoptose est une fonction très importante dans les organismes, car elle permet la destruction des cellules endommagées en évitant l'apparition de maladies telles que le cancer, conséquence d'une réplication aveugle d'une cellule endommagée.
L'apoptose est un processus qui contraste avec la nécrose - qui n'est pas vraiment une forme de mort cellulaire, mais un schéma morphologique qui intervient après la mort de tissus dans des organismes vivants - résultant de lésions aiguës des tissus. L'apoptose est ordonnée par des apoptogènes, ce qui confère généralement des avantages à l'organisme dans son ensemble au cours de son cycle de vie normal. Par exemple, la différenciation des doigts humains au cours du développement embryonnaire nécessite que les cellules des membranes intermédiaires initient un processus apoptotique permettant aux doigts de se séparer ou au renouvellement épithélial de la muqueuse intestinale.
Chez les animaux, l'apoptose est un processus naturel entraînant la mort des cellules, au cours duquel on observe une condensation du noyau et de la cellule, ce qui aboutit à son internalisation et sa digestion par une cellule voisine ou par des phagocytes. À la différence de la mort par lésion, il n'y a pas d'épanchement de cytoplasme dans l'espace extracellulaire, ce qui évite toute réaction inflammatoire.
Chez les végétaux, l'apoptose existe aussi mais suit le plus souvent une voie différente (rupture du tonoplaste).
La mort des cellules par apoptose est nécessaire pour un développement normal :
- chez le ver Caenorhabditis elegans, 959 cellules somatiques chez les hermaphrodites et 1031 chez les mâles sont formées mais une centaine meurt sans entraîner d'anomalie;
- l'apoptose aide à sculpter les membres en cours de développement (élimination de la palmure des doigts);
- l'absence d'apoptose peut entraîner l'apparition de cancers.
L'apoptose est déclenchée par l'activation de certains gènes (par exemple, le gène ICE), lorsque la cellule ne perçoit plus de signaux spécifiques de maintien en vie.
L'apoptose fait l'objet d'une attention croissante en biologie cellulaire et dans l'étude du développement des organismes, ainsi que dans la recherche sur des maladies telles que le cancer. D'ailleurs, le prix Nobel de physiologie ou de médecine de 2002 a été attribué à Sydney Brenner (Grande-Bretagne), H. Robert Horvitz (États-Unis) et John E. Sulston (GB) "pour leurs découvertes concernant la régulation génétique. développement d'organes et mort cellulaire programmée".
Une apoptose :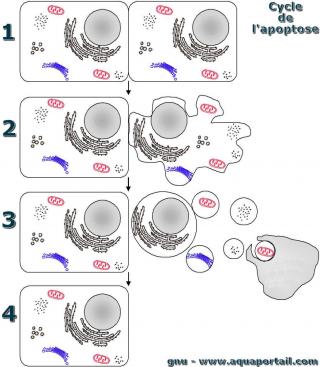
L'apoptose, schéma détailé en séquences de la mort cellulaire apoptotique programmée. "Apoptose" est un mot dérivé du latin qui signifie "tomber", comme une feuille qui tombe d'un arbre. Or, une feuille tombe d'un arbre mort.
Types
Les types de mort cellulaire programmée comprennent : l'apoptose, la pyroptose, la parthanatose et la nécroptose (nécrose). Ce qui apoptotique est en rapport avec une activité d'apoptose, par exemple dans le rôle inflammatoire des phospholipases. Parfois, un phénomène d'autolyse existe, mais cette lyse cellulaire autogène n'est pas programmée, mais déclenchée par un évènement exogène.
Apoptogène
Un inducteur apoptogène déclenche l'apoptose, lui donne naissance. Le facteur d'induction apoptogène est une flavoprotéine. La phase effectrice de l'apoptose comporte l'ouverture des pores de transition de perméabilité des mitochondries et la libération de molécules apoptogènes telle que le cytochrome C.
L'apoptose complète, en quelque sorte, la parthanatose et la nécrose, et apoptogène donne parthanogène. Le suffixe "gène" est à prendre dans le sens de "genèse".
Le facteur d'induction de l'apoptose est impliqué dans l'initiation d'une voie indépendante de l'apoptose (régulateur intrinsèque positif de l'apoptose) en provoquant la fragmentation de l'ADN et la condensation de la chromatine. Il agit également comme une oxydase NADH. Une autre fonction adaptogène est de réguler la perméabilité de la membrane mitochondriale lors de l'apoptose. Normalement, il se trouve derrière la membrane externe de la mitochondrie et est donc isolé du noyau. Cependant, lorsque la mitochondrie est endommagée, elle se déplace vers le cytosol et vers le noyau. L'inactivation des adaptogènes conduit à la résistance des cellules souches embryonnaires à la mort suite au retrait des facteurs de croissance indiquant qu'elle est impliquée dans l'apoptose.
Attention de ne pas confondre apoptogène avec adaptogène !
Fonctions apoptotiques
Une apoptose intervient dans plusieurs cas :
- Tissus endommagés ou infection : l'apoptose peut exister, par exemple, lorsqu'une cellule est endommagée et n'a aucune chance d'être réparée, ou lorsqu'elle a été infectée par un virus. La "décision" d'initier l'apoptose peut provenir de la cellule elle-même, des tissus environnants ou d'une réaction du système immunitaire.
Lorsque la capacité d'une cellule à effectuer l'apoptose est altérée (par exemple, en raison d'une mutation) ou si le début de l'apoptose a été bloqué (par un virus), la cellule endommagée peut continuer à se diviser sans autre restriction, ce qui entraîne dans une tumeur, qui peut être une tumeur cancéreuse (voir cancer).
- Régulation du système immunitaire : Certaines cellules du système immunitaire, les lymphocytes B et les lymphocytes T, peuvent développer une propension à attaquer les cellules du tissu sain de l'organisme auquel elles appartiennent. Ces cellules autoréactives sont éliminées par apoptose. Par exemple, avant leur libération dans le reste du corps, les lymphocytes T, une fois formés dans la moelle osseuse, sont soumis à des tests de réactions auto-immunes dans le thymus, organe responsable de leur maturation pour éviter les réactions d'auto-immunité.
De cette façon, environ 95 % des lymphocytes T nouvellement créés - et de ceux qui ont montré une propension à attaquer leurs propres tissus - sont détruits par apoptose.
- Développement : La mort cellulaire programmée fait partie intégrante du développement des tissus des plantes (Viridiplantae, les plantes vertes) et des animaux pluricellulaires (métazoaires) et ne provoque pas la réponse inflammatoire caractéristique de la nécrose (apoptose métazoaire avec des mécanismes et gènes du suicide cellulaire).
En d'autres termes, l'apoptose ne ressemble pas au type de réaction résultant de lésions tissulaires dues à des infections ou des accidents pathogènes. Au lieu de gonfler et d'éclater, et par conséquent de répandre son contenu, éventuellement nocif, dans les cellules de l'espace intercellulaire en cours d'apoptose, leur noyau se contracte et se fragmente souvent.
De cette manière, ils peuvent être efficacement englobés via la phagocytose et, par conséquent, leurs composants sont réutilisés par les macrophages ou par les cellules du tissu adjacent.
Les cellules meurent par apoptose pour deux raisons différentes : l'élimination des cellules en excès et celle des cellules qui représentent un danger pour l'intégrité de l'organisme.
Exemples d'élimination des cellules en excès :
- La réabsorption de la queue des têtards : dans la métamorphose du têtard au niveau de la grenouille ou la dégénérescence de la peau entre les doigts / orteils (peaux interdigitées), les cellules sont spécifiquement stimulées à l'apoptose.
- L'élimination des membranes interdigitées dans la formation des doigts chez le foetus.
- Pour atteindre le stade adulte, le nématode que le C. elegans doit perdre par apoptose.
- L'élimination de l'endomètre au début de la menstruation.
- La formation de synapses entre les neurones du cerveau nécessite l'élimination par apoptose d'une série de cellules.
- Par la mort cellulaire apoptotique des cellules du corps vitré et du cristallin de l'oeil du cristallin, la transmission de la lumière du cristallin est réalisée.
- Pour assurer une "interconnexion" correcte des structures cérébrales et des cellules nerveuses individuelles, jusqu'à la moitié de toutes les cellules nerveuses formées avant la naissance.
Exemples d'élimination de cellules représentant un danger pour l'intégrité de l'organisme :
- Les cellules infectées par des virus sont détruites par les lymphocytes T cytotoxiques.
- Cellules du système immunitaire : après la réponse immunitaire, les cellules effectrices doivent être éliminées pour les empêcher d'attaquer les composants de l'organisme. Les lymphocytes T cytotoxiques induisent l'apoptose dans chacune des différentes cellules du système immunitaire et même en elles-mêmes. Tout défaut de la machinerie apoptotique de ces cellules immunitaires est associé à des maladies auto-immunes telles que le lupus érythémateux ou la polyarthrite rhumatoïde.
- Cellules à ADN endommagé : la lésion de son génome provoque le développement d'un cancer. Les cellules répondent aux dommages de l'ADN en augmentant la production de p53, un puissant inducteur de l'apoptose. Des mutations dans p53 produisent une protéine défectueuse souvent détectée dans les cellules cancéreuses.
- Cellules cancéreuses : la radiothérapie et la chimiothérapie induisent l'apoptose dans certains types de cancer pour l'élimination des cellules dégénérées.
- homéostasie : dans un organisme adulte, la quantité de cellules constituant un organe ou un tissu doit rester constante, dans certaines limites. Les cellules sanguines et cutanées, par exemple, sont constamment renouvelées par leurs cellules progénitrices respectives. Par conséquent, cette prolifération de nouvelles cellules doit être compensée par la mort d'autres cellules.
Ce processus est appelé homéostasie, bien que certains auteurs et chercheurs tels que Steven rose et Antonio Damasio aient suggéré l'homéodynamique comme un terme plus précis et éloquent.
Mécanismes
Les processus d'apoptose peuvent être activés par :
- une induction négative : perte d'activité suppressive, absence de facteurs de croissance ou diminution des contacts avec les cellules qui l'entourent.
- une induction positive : c'est le résultat de la liaison d'un ligand à un récepteur ou de la réception de signaux contradictoires.
Les recherches scientifiques indiquent qu'il existe trois voies d'apoptose : extrinsèque, intrinsèque et perforine/granzyme.
La voie de signalisation extrinsèque est responsable du début de l'apoptose, intervient dans les interactions médiées par des récepteurs transmembranaires tels que les récepteurs de la mort, caractérisée par la présentation d'un domaine extracellulaire, riche en cystéine avec des domaines cytoplasmiques d'environ 80 acides aminés, et un second domaine de localisation cytoplasmique connue sous le nom de "domaine de la mort" responsable de l'apoptose.
Son activation conduit toujours à la mort cellulaire, on y trouve :
- Les récepteurs du facteur de nécrose tumorale (TNF) - sont connectés à des complexes tels que TRADD (domaine de la mort associé au TNFR) qui sert de plate-forme d'adaptation pour recruter des molécules de signalisation, telles que l'interaction protéine-récepteur, et facteurs de transcription (NFk B et JNK/AP-1).
Contrairement à Fas, le récepteur du TNF active rarement les processus d'apoptose, à moins que la synthèse des protéines ne soit bloquée, suggérant l'existence de facteurs cellulaires qui suppriment les stimuli apoptotiques générés par le TNF. Les modèles FasL/FasR et TNF-α/TNFR1 caractérisent le mieux les événements de la voie extrinsèque.
- Les récepteurs Fas-transmembranales des protéines qui, dans la partie intracellulaire, se lient aux FADD (facteur associé au domaine de la mort) activant les caspases 8 et 10 (groupe de protéines appartenant au groupe des cystéine protéases, caractérisées pour présenter un résidu de cystéine qui sert de médiateur) la dégradation d'autres protéines). Dans le modèle FasL/FasR, l'agglutination du ligand Fas au récepteur Fas provoque l'agglutination de la protéine adaptateur FADD. Après cela, un complexe de signalisation induite par la mort est formé et, en conséquence, la procaspase-8 est activée. Une fois que procaspasa-8 est activé, la phase d'exécution de l'apoptose commence.
Cette phase est considérée comme la voie finale de l'apoptose. Les caspases d'exécution activent les endonucléases cytoplasmiques qui dégradent les matières nucléaires et les protéases dégradent les protéines nucléaires et les cytosquelettes. Caspasas-3, caspasas-6 et caspasas-7 fonctionnent comme des caspases effectrices qui coupent plusieurs substrats, y compris les cytokératines, la PARP, la membrane plasmique du cytosquelette de la protéine alpha-fodrine, la protéine nucléaire NuMA et d'autres causant des modifications de la morphologie et de la biochimie chez cellules apoptotiques.
Ces types de récepteurs et leur ligand jouent un rôle important dans les modèles apoptotiques tels que la suppression périphérique des cellules T matures à la fin d'une réponse immunitaire, la mort de cellules cibles (cellules infectées par des virus), la destruction de cellules cancéreuses médiée par lymphocytes T cytotoxiques et par le tueur naturel, ainsi que l'élimination des cellules immunitaires réactives aux tumeurs qui expriment de manière constitutive le ligand Fas. L'apoptose induite par les récepteurs de la mort peut être inhibée par la protéine c-FLIP qui se lie à la FADD et à la caspase-8, entraînant une inefficacité.
- glutamate, thrombine et canaux ioniques voltage-dépendants : ils jouent un rôle physiologique, mais leur sur-activation peut également entraîner la mort. Les récepteurs du glutamate, un neurotransmetteur d'acide aminé, participent à plus de 80 % des synapses excitatrices du système nerveux central et sont liés aux processus entourant la mémoire et la transmission nerveuse.
Cependant, son excès de stimulation peut déclencher une mort neuronale - l'excitotoxicité - décrite dans des processus tels que l'ischémie/reperfusion, l'infarctus, la sclérose latérale amyotrophique ou la maladie de Parkinson.
Contrairement à la voie extrinsèque induite de manière extracellulaire, la voie intrinsèque est induite de manière intracellulaire. La voie intrinsèque de l'apoptose peut être déclenchée par des dommages à l'ADN, une augmentation importante de la concentration de calcium cytosolique ou un stress cellulaire, ainsi qu'une augmentation de la génération d'espèces réactives de l'oxygène dans les mitochondries.
Ceci active l'expression du gène suppresseur de tumeur p53, qui active ensuite les protéines pro-apoptotiques. puma et NOXA sont exprimés par le gène p53 et le code des deux membres de la famille Bcl2 qui régissent la perméabilisation de la membrane mitochondriale externe, Bax et Bak. L'expression de ces protéines provoque une translocation de la mitochondrie, réduisant ainsi la membrane, ce qui entraîne la libération de cytochrome C et d'Apaf-1.
Une fois que le cytochrome C se lie à Apaf-1 et à la procaspase-9, un apoptosome se forme. Cet apoptosome active alors la caspase-9. Une fois que la caspase-9 est activée, la plus grande activation d'autres caspases, telles que les caspases-3 et -7, permet la digestion de cibles essentielles affectant la viabilité cellulaire.
L'activation des seconds messagers (p53 et Bcl2) entraîne généralement le dysfonctionnement des organites cytoplasmiques, tels que les mitochondries et le réticulum endoplasmique, ou la régulation de l'activité de complexes enzymatiques tels que les kinases et les phosphatases qui à leur tour régulent la fonction d'autres protéines.
Pendant le traitement normal du signal, des augmentations transitoires de [Ca2+]i interviennent. Cependant, des augmentations aberrantes peuvent causer des dommages aux cellules et, dans certains cas, la mort. Dans ces processus, le calcium peut activer des enzymes telles que les protéases et les lipases, induisant la production de radicaux libres, en plus de réguler et d'améliorer l'expression des gènes en modulant l'activité des facteurs de transcription.
Dans des conditions physiologiques, les cellules présentent un équilibre entre la génération de radicaux libres et les systèmes antioxydants de défense. Dans certains processus de mort cellulaire, la décomposition de cet équilibre a été décrite, avec une augmentation de l'oxydation de protéines avec la formation de groupes carbonyle et une peroxydation lipidique, et l'existence d'une localisation compartimentée de dérivés carbonylés libres. lipides, protéines, glucides et acides nucléiques (2,4-dinitrophénylhydrazine).
La translocation du céramide vers la mitochondrie provoque des changements ioniques entre la matrice mitochondriale et le cytoplasme, entraînant une diminution du potentiel transmembranaire et la formation du pore de perméabilité mitochondrial transitoire, conduisant à l'apoptose. Les valeurs de céramide peuvent être augmentées à la fois par des facteurs externes (rayons UV, oxydants), par des récepteurs membranaires (FasR et TNFR) ou directement par des glucocorticoïdes.
L'augmentation des valeurs de p53 conduit à l'induction de la transcription d'autres gènes tels que p21 / WAF1 / Cip1, un inhibiteur des protéines kinases régulées par les cyclines, inhibant l'entrée de la phase S du cycle cellulaire. En conséquence, la cellule s'arrête dans la phase G1, ce qui constitue une barrière cinétique dans la réplication d'un génome potentiellement endommagé.
Si la cellule ne peut pas réparer les dommages génétiques, p53 induit la mort cellulaire par un mécanisme postulé selon lequel elle pourrait être médiée par une augmentation de la synthèse de Bax, une protéine de la famille Bcl-2 aux propriétés pro-apoptotiques. Un dysfonctionnement du gène p53 peut favoriser le développement de tumeurs en raison de la prolifération de cellules à réparation incomplète de l'ADN.
Une fois que la cellule reçoit un signal de mort, elle doit décider si elle doit survivre ou déclencher les processus de mort. Dans cette phase de décision, les mitochondries ont été placées comme organites fondamentaux.
Comme l'un des principaux événements, la perméabilité des membranes mitochondriales est altérée en raison de la formation d'un complexe multiprotéique conduisant à la libération de contenu intramitochondrial tel que le cytochrome C, le facteur induisant l'apoptose et les membres de la famille des caspases. L'altération de la chaîne de transport d'électrons, la perte de potentiel électrochimique et les modifications du cycle métabolique d'oxyde / réduction sont d'autres événements non liés à la membrane.
Une fois que la cellule a pris la décision de mourir, une série de processus biochimiques existe dans son intérieur qui conduisent à la dégradation des protéines et de la chromatine. Parmi les protéases impliquées dans les processus de mort cellulaire, on trouve les caspases, les calpaïnes, le granzyme B et le complexe protéinome appelé protéosome.
L'activation des caspases peut avoir lieu en réponse à des stimuli extracellulaires et intracellulaires. Ceux-ci hydrolysent des séquences spécifiques de tétrapeptides contenant un résidu d'aspartate.
Parmi ses substrats, on trouve : des éléments du cytosquelette (actine, fodrine, protéines Tau et caténine), des enzymes responsables de la réparation de l'ADN cellulaire (ADN) ou de la dégradation (ADNase), des facteurs de transcription (rétinoblastome, HDM2), des protéines régulatrices (protéine kinase) C, phosphatases 2A, kinases d'adhésion focale), ainsi que des membres de la famille des oncogènes Bcl-2 (Bid).
Les calpaïnes sont des protéases de la cystéine nécessitant du Ca2+ pour leur translocation vers la membrane cytoplasmique, leur autolyse rapide et leur activation. Parmi ses substrats figurent également des facteurs de transcription, des oncogènes, des protéines membranaires et cytosquelettiques. Ceux-ci sont suractivés lors de processus excitotoxiques et ischémiques et dans des pathologies telles que la maladie d'Alzheimer.
Voir aussi l'autolyse, la nécrobiose, l'immunologie.
En rapport avec "apoptose"
L'autolyse est un processus par lequel une cellule s'autodétruit. L'autolyse est une destruction (lyse autogène) de cellules ou de tissus par leurs propres...
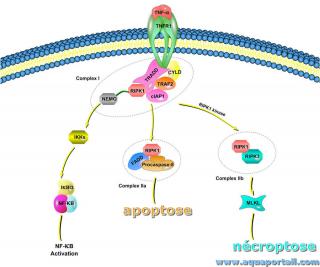
La nécroptose est une version régulée de la voie de mort cellulaire nécrotique, indépendante de la caspase.
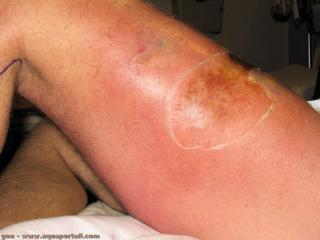
La nécrose est la dernière étape de la mort cellulaire. En biologie, la nécrose est la mort et la décomposition d'un tissu organique. Elle est une altération...
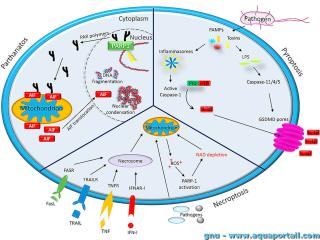
La parthanatose est une forme de mort cellulaire programmée qui est distincte des autres processus de mort cellulaire tels que la nécroptose et l'apoptose.
