Une phospholipase
Une phospholipase est une enzyme lipolytique qui hydrolyse des substrats phospholipidiques au niveau de liaisons ester des phospholipides. Les phospholipases sont très répandues dans la nature où elle jouent des rôles très divers. Ainsi, elles peuvent induire l'agression dans le venin de serpent, mais aussi la transduction du signal, la production de médiateurs lipidiques et la digestion des métabolites.
Structure et réactions de phospholipases :
Représentation schématique des sites enzymatiques de la phospholipase sur les phospholipides.
Généralités
Les phospholipases sont une famille d'enzymes modifiant les lipides qui peuvent réduire ou augmenter les niveaux de lipides bioactifs. Les lipides bioactifs provoquent des réponses de signalisation, activent des facteurs de transcription, favorisent l'activité des protéines couplées G et modulent la fluidité membranaire, qui régule la fonction cellulaire. Les phospholipases et les lipides bioactifs qu'elles produisent sont d'importants régulateurs de l'activité des cellules immunitaires, dictant à la fois l'activité pro-inflammatoire et pro-résolution.
Par exemple, au cours de l'athérosclérose, les activités pro-inflammatoires et pro-résolution régissent respectivement la progression et la régression de l'athérosclérose. Il existe une interface entre l'activité de la phospholipase, la fonction des cellules immunitaires et l'athérosclérose.
L'activité phospholipase semble plus importante dans les parasites les plus virulents. Ainsi, les phospholipases (et certaines protéines) pourraient jouer un rôle clef dans la physiopathologie, par exemple pour une maladie telle que la trypanosomiase africaine (parasitose par un trypanosome).
Il a été démontré que l'activité de la phospholipase contribue à la fois aux réponses immunitaires pro-inflammatoires et pro-résolution.
Les phospholipides, les composants qu'ils stockent, et les phospholipases sont des régulateurs dynamiques de la fonction des cellules immunitaires. Plus précisément, la production et l'élimination des lipides bioactifs contribuent à l'activation cellulaire, à la phagocytose, à la génération d'espèces réactives de l'oxygène (ROS), à la production de cytokines et à la production de prostanoïdes. L'activité de la phospholipase est évidente dans presque toutes les cellules immunitaires.
Classification des phospholipases
La classification des phospholipases selon leur action sur la molécule substrat phospholipidique est :
- Phospholipase A1 (PLA1) : coupe une chaîne d'acides gras d'un diacyle phospholipide en position sn-1;
- Phospholipase A2 (PLA2) : attaque la chaîne d'acides gras qui se trouve en position sn-2;
- Phospholipase B : peut couper les deux chaînes d'acides gras d'un diacyle phospholipide;
- Phospholipase C : coupe le groupe de tête d'un phospholipide;
- Phospholipase D : peut couper le groupe de tête polaire d'un phospholipide.
Classification des phospholipases :
Dans cette classification des phospholipases, R1 et R2 sont les deux chaînes d'acides gras, et "Polar Head" représente une partie variable du groupe de tête d'une molécule de phospholipide
Les phospholipases sont un groupe d'enzymes qui clivent les phospholipides. Chaque famille de phospholipases clive un site unique sur un phospholipide ou une famille de phospholipides unique.
La phospholipase A hydrolyse les esters d'acides gras de la position sn-1 (PLA1) ou sn-2 (PLA2) des squelettes du glycérol, générant des acides gras libres. La phospholipase C (PLC) hydrolyse la liaison glycérol de liaison glycérophosphate de la tête polaire, générant DAG et IP3. La phospholipase D (PLD) hydrolyse le groupe de tête des phospholipides, laissant le phosphatide et l'acide phosphatidique.
Phospholipase A1 (PLA1)
La phospholipase A1 est une enzyme hydrolytique, un des types de phospholipase qui catalyse le processus d'élimination (clivage, par hydrolyse) de la chaîne acyle du phospholipide en position sn-1. Lorsque la phospholipase A1 agit sur un phospholipide, il se forme du 1-lysophospholipide et un acide gras. La phospholipase A1 est un composant actif du venin de serpent hémolytique.
Les phospholipases A1 sont largement distribuées parmi les Hyménoptères, étant identifiées comme des protéines allergènes majeures dans le venin de guêpe des genres Vespula, Vespa, Dolichovespula, polistes et Polybia ainsi que la fourmi de feu Solenopsis invicta.
L'activité de la phospholipase A1 est évaluée dans un protocole analogue à l'évaluation de l'activité de la phospholipase A2. En bref, un substrat phospholipidique avec un acide gras marqué au 14C en position sn-1 est incubé avec un lysat cellulaire ou une autre source d'enzyme PLA1.
Après 30 min d'incubation à 37 °C, les acides gras hydrolysés sont extraits du mélange réactionnel (ou isolés des extraits lipidiques totaux par chromatographie sur couche mince) et l'activité enzymatique est calculée à partir de la radioactivité déterminée dans un compteur à scintillation liquide
Il existe une différence importante avec le test PLA2. Alors que le substrat avec un acide gras radiomarqué en position sn-2 est facilement acheté auprès des principaux fournisseurs de produits radiochimiques, le substrat avec un acide gras radiomarqué en position sn-1 est préparé à partir de 1[1–14C]palmitoyl-lyso-phosphatidylcholine par incubation avec des protéines microsomales de foie de bovin.
Des anticorps monoclonaux ont été préparés à partir de lapins en utilisant un peptide spécifié par les 18 acides aminés C-terminaux d'une PLA1 recombinante.
Phospholipase A2 (PLA2)
Les phospholipases A2 (PLA2) forme une superfamille qui hydrolyse les phospholipides pour produire des acides gras et des lysophospholipides, les enzymes de phospholipases A2 (sPLA2) sécrétées constituent la plus grande famille qui contient 11 isoformes chez les mammifères.
Réaction phospholipase A2 (PLA2) :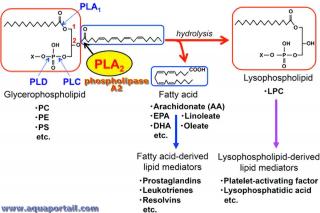
La réaction de la phospholipase A2 (PLA2) hydrolyse la position sn-2 des glycérophospholipides pour produire des acides gras (généralement insaturés) et des lysophospholipides. Les phospholipases A1, C et D (PLA1, PLC et PLD, respectivement) clivent d'autres liaisons ester dans la molécule de glycérophospholipide. Les acides gras insaturés et les lysophospholipides sont ensuite métabolisés en une variété de médiateurs lipidiques.
Les sPLA2 individuelles présentent des distributions uniques et des propriétés enzymatiques spécifiques, suggérant leurs rôles biologiques distincts. Alors que les sPLA2 sont depuis longtemps impliquées dans l'inflammation et l'athérosclérose, il est devenu évident qu'elles sont impliquées dans divers événements biologiques par le biais de processus dépendants ou indépendants des médiateurs lipidiques dans un microenvironnement donné.
Ces dernières années, de nouveaux aspects biologiques des sPLA2 ont été révélés en utilisant leurs modèles de souris transgéniques et knock-out en combinaison avec la lipidomique spectrométrique de masse pour dévoiler leurs substrats et produits cibles in vivo. Les rôles des sPLA2 sont impliqués dans les troubles métaboliques, notamment l'obésité, la stéatose hépatique, le diabète, la résistance à l'insuline et l'inflammation du tissu adipeux.
Phospholipase A2 associée aux lipoprotéines (Lp-PLA2)
La phospholipase A2 associée aux lipoprotéines (Lp-PLA2) est une protéine monomère de 45 kDa et appartient à la superfamille des phospholipases A2. Lp-PLA2 diffère des autres membres de la phospholipase A2, car elle ne nécessite pas de calcium pour son activité enzymatique, et dans sa spécificité de substrat, car elle hydrolyse préférentiellement la chaîne acyle sn-2 tronquée par oxydation des phospholipides hydrosolubles.
L'enzyme est également connue sous le nom de facteur d'activation des plaquettes acétyl-hydrolase, en raison de sa capacité à hydrolyser et à inactiver le facteur d'activation des plaquettes (PAF). Il a été initialement suggéré que la Lp-PLA2 joue un rôle athéroprotecteur en raison de son activité enzymatique d'hydrolyse des phospholipides oxydés dans les LDL et de sa fonction dans la dégradation du PAF pro-inflammatoire et induisant l'athérogenèse.
La Lp-PLA2 est codée par le gène PLA2G27, qui contient 12 exons. Le gène PLA2G27 est caractérisé par une variété de polymorphismes non synonymes qui atténuent l'activité enzymatique de Lp-PLA2 ou entraînent sa perte complète. La perte de fonction Lp-PLA2 est associée à une augmentation des maladies cardiovasculaires, suggérant un rôle athéroprotecteur pour l'enzyme. La perte d'activité Lp-PLA2 est supposée augmenter les niveaux de PAF circulant et augmenter les quantités d'oxLDL.
La Lp-PLA2 est sécrétée par une variété de globules blancs et d'autres cellules spécialisées telles que les hépatocytes et les adipocytes. Il a été constaté que la synthèse et la libération de Lp-PLA2 dans la circulation interviennent principalement pendant la maturation des monocytes en macrophages.
Chez l'homme, la Lp-PLA2 circulante est liée aux lipoprotéines, 70 à 80 % de l'enzyme étant liée à l'apolipoprotéine B sur les LDL, tandis que le reste est transporté sur les HDL.
Phospholipase cytosolique A2 (cPLA2)
La phospholipase cytosolique A2 (cPLA2) est l'une des trois catégories de phospholipase A2. Les autres phospholipases A2 sont appelées PLA2 sécrétoire et PLA2 indépendante du calcium. Les phospholipases A2 catalysent l'hydrolyse des glycérophospholipides pour produire les métabolites de l'acide arachidonique. Parmi les phospholipases, la cPLA2 est hautement sélective pour les glycérophospholipides contenant de l'acide arachidonique.
La cPLA2 est une enzyme omniprésente que l'on trouve dans la plupart des tissus et des cellules; cependant, les lymphocytes T et B matures n'ont pas de niveaux détectables de cPLA2. Il existe trois isoformes de cPLA2 : cPLA2 bêta (110 kDA), cPLA2 gamma (60 kDA) et cPLA2 alpha (85 kDA). Chaque isoforme possède deux domaines catalytiques : A et B. Le domaine catalytique A contient la séquence consensus de lipase GXSGS.
La cPLA2 inactive existe dans le cytosol; cependant, lors de la liaison du calcium au domaine C2, cPLA2 se déplace vers le réticulum endoplasmique (RE), l'appareil de Golgi et l'enveloppe nucléaire.
Un calcium intracellulaire stable supérieur à 100–125 nM provoque une translocation de cPLA2 vers le Golgi, tandis qu'un calcium intracellulaire stable supérieur à 210–280 nM provoque une translocation de cPLA2 vers le Golgi, le RE et l'enveloppe nucléaire. La localisation cellulaire de cPLA2 peut avoir des effets sur différents processus à médiation lipidique.
Par exemple, une étude avec des cellules rénales a démontré que la localisation de cPLA2 au niveau de l'appareil de Golgi peut modifier le rapport lipidique et entraîner des changements dans la structure et le trafic des protéines. Avec les niveaux de calcium intracellulaire, la phosphorylation de cPLA2 à Ser 505, Ser 515 et Ser 727 régule l'activité de cPLA2.
La protéine kinase activée par un mitogène phosphoryle les résidus sérine ci-dessus; la phosphorylation augmente l'activité enzymatique. L'activation de cPLA2 conduit à la libération d'acide arachidonique, qui peut être converti en eicosanoïdes inflammatoires dont les prostaglandines.
L'activité de la cPLA2 favorise l'activation des cellules immunitaires pro-inflammatoires par la production d'eicosanoïdes, en particulier la prostaglandine E2 (PGE2).
Phospholipase B (PLB)
La phospholipase B (lysophospholipase) est un type de phospholipase qui possède les activités des phospholipases A1 et A2, c'est-à-dire qu'elle est capable d'hydrolyser la chaîne acyle d'un phospholipide aux positions sn-1 et sn-2. En règle générale, la phospholipase B agit sur la lysolécithine (lysophosphatidylcholine), qui se forme à la suite de l'action de la phospholipase A1 sur la lécithine (phosphatidylcholine).
Phospholipase C (PLC)
La phospholipase C (PLC) est une phosphodiestérase dépendante du calcium qui régule le métabolisme des phosphoinositides. La PLC hydrolyse le phosphatidylinositol 4,5-bis-phosphate (PI(4,5)P2) pour générer les seconds messagers inositol 1,4,5-trisphosphate (IP3) et le diacylglycérol (DAG).
Il existe treize isozymes PLC chez les mammifères, qui sont classés en six classes en fonction de leur structure. Ces classes incluent les PLC β, γ, δ, ϵ, λ, et ν. Ces structures dictent en grande partie les interactions avec les récepteurs de la surface cellulaire, notamment les récepteurs couplés aux protéines G (RCPG), les protéines G, les récepteurs tyrosine kinases (RTK) et les tyrosine kinases non réceptrices.
La phospholipase C est connue pour réguler les réponses immunologiques multiples des lymphocytes T et B. La signalisation des récepteurs des cellules T entraîne l'activation de la PLC. Le clivage médié par la PLC de PI(4,5)P2 génère IP3 et DAG, qui ont tous deux un rôle important dans l'activation des cellules immunitaires. Le DAG active la protéine kinase C (PKC), entraînant l'initiation de la signalisation NFκβ pour favoriser la transcription du gène inflammatoire.
IP3 se lie au récepteur IP3, conduisant à la libération de calcium du réticulum endoplasmique. Le calcium active la calcineurine, entraînant la translocation nucléaire de NFAT pour favoriser la production d'IL-2 et la prolifération subséquente des cellules T. De plus, le déficit en PLC entraîne une réduction du développement des Treg, ce qui peut favoriser l'inflammation chronique. La PLC joue un rôle similaire dans l'activation des cellules B comme il le fait dans les cellules T en favorisant la transcription en aval médiée par NFκB et NFAT. Ceci est accompli grâce à la signalisation IP 3 et DAG.
Par rapport à celles des lymphocytes, les conséquences fonctionnelles de la signalisation médiée par la PLC dans les cellules myéloïdes sont diverses. La PLC est requise pour la différenciation des macrophages en réponse au facteur de stimulation des colonies de macrophages (MCSF). En plus de favoriser la différenciation, les macrophages activés et les cellules dendritiques nécessitent une PLC pour la production appropriée de cytokines et la migration des cellules dendritiques.
Lors de l'entrée dans le tissu, les macrophages et les cellules dendritiques engloutissent constitutivement les antigènes environnants et les présentent à la surface cellulaire. Cet engloutissement nécessite la synthèse d'acide phosphatidique (AP) et la PLC est requise pour la génération d'intermédiaires de la voie de synthèse de l'acide phosphatidique, conduisant à l'activation ultérieure de RAC et à la polymérisation de l'actine.
La phospholipase C se localise sur les phagosomes naissants pour favoriser le recrutement de la PKC, conduisant à l'absorption d'antigènes opsonisés par IgG. Il existe de nombreuses études démontrant le rôle essentiel de la PLC dans l'activation et la différenciation des cellules immunitaires.
Phospholipase D (PLD)
La phospholipase D (PLD) est une phosphodiestérase spécifique des phospholipides dans laquelle l'activité enzymatique clive la phosphorylcholine en acide phosphatidique et en choline libre. L'activité enzymatique de la PLD a des effets pléiotropes sur une variété de voies cellulaires. Les phospholipases D de mammifères sont divisées en deux isoformes classiques, PLD1 et PLD2, qui ont à la fois des fonctions redondantes et spécifiques en fonction de la distribution tissulaire.
La phospholipase D est régulée transcriptionnellement et post-traductionnellement. PLD1 et PLD2 sont activés par la présence de phosphatidylinositol 4,5-bisphosphate (PtdIns(4,5)P2). D'autres espèces lipidiques activent également la PLD, telles que les PtdIns(3,4,5)P3 et les acides gras insaturés.
Non seulement les espèces lipidiques régulent la PLD, mais les protéines qui régulent l'abondance, la localisation et l'état de phosphorylation de Ptdlns(4,5)P2 sont également impliquées dans la régulation de la PLD. Divers stimuli, tels que PDGF, EGF ou IL-1β, entraînent une augmentation de l'expression génique de la PLD via l'activation de NFκB.
La phospholipase D est modifiée post-traductionnellement par phosphorylation et palmitoylation. La phosphorylation par les GTPases, telles que les protéines de la famille ARF et Rho, active directement l'activité enzymatique de la PLD. Il a été démontré que la palmitoylation modifie la localisation de la PLD dans la cellule, des régions périnucléaires aux régions de la membrane plasmique. Cela montre la nature hautement dynamique de la phospholipase D au sein de la cellule.
Comprendre comment la phospholipase D contribue aux maladies inflammatoires chroniques, telles que l'athérosclérose, peut avoir des implications importantes dans la progression de la maladie. Dans l'ensemble, la phospholipase D est essentielle pour diverses réponses immunologiques.
Recherches sur les phospholipases
Des études importantes sur l'optimisation, la caractérisation, le rôle physiologique et le potentiel industriel des phospholipases ont été menées dans le monde entier. Certains d'entre eux ont été orientés vers des avancées biotechnologiques telles que la découverte de gènes et l'amélioration fonctionnelle par ingénierie des protéines. D'autres ont signalé les phospholipases comme facteur de virulence et principale cause d'effets physiopathologiques.
Un aperçu général sur la phospholipase est nécessaire pour l'identification de nouvelles phospholipases fiables et efficaces, qui seraient potentiellement utilisées dans de nombreuses applications industrielles et médicales.
Les phospholipases catalysent l'hydrolyse d'une ou plusieurs liaisons ester et phosphodiester des glycérophospholipides. Ils varient en site d'action sur les phospholipides qui peuvent être utilisés industriellement pour la modification/production de nouveaux phospholipides.
Les phospholipases catalytiquement actives utilisent principalement la phosphatidylcholine comme substrat principal, mais elles peuvent également montrer une spécificité avec d'autres phospholipides.
Plusieurs méthodes précises de dosage des phospholipases sont connues, mais une méthode rapide et fiable pour le criblage à haut débit reste un défi pour un approvisionnement efficace en phospholipases supérieures et leurs applications pratiques.
La principale application de la phospholipase se trouve dans des industries telles que les raffineries de pétrole, la fabrication d'aliments naturels, les produits laitiers, les cosmétiques, etc. Tous les types de phospholipases peuvent être impliqués en tant que facteur de virulence. Ils peuvent également être utilisés comme marqueurs de diagnostic pour une infection microbienne.
L'importance de la phospholipase dans la virulence est prouvée et des inhibiteurs de l'enzyme peuvent être utilisés comme candidats pour prévenir la maladie associée.
Les phospholipases sont des enzymes qui catalysent l'hydrolyse de la lécithine en glycérol et acides gras, acide phosphorique et choline.
En rapport avec "phospholipase"

Le glycérophospholipide (phosphoglycéride) est un glycéride dont deux fonctions alcool sont estérifiées par des acides gras et la troisième par un acide...
La lipase est une enzyme principalement produite par le pancréas pour aider à digérer les graisses alimentaires.

Un phospholipide désigne un lipide comportant un groupement phosphate. La majorité des phospholipides sont constitués d'une molécule de glycérol sur laquelle...

L'acide 2,3-diphosphoglycérique, anciennement appelé diphosphoglycérate (DPG), est un métabolite intermédiaire du glucose synthétisé à partir de l'acide...
