GTPase
Définition
Une GTPase est une enzyme de guanosine capable d'hydrolyser la GTP (guanosine triphosphate), en séparant le groupe phosphate terminal et en créant de la GDP (guanosine diphosphate). Une GTPase agit comme un interrupteur : il y a un état actif et un inactif. Selon l'état de l'enzyme, un signal peut ou non être donné par une cascade de protéines, typiquement les protéines G. Les GTPases sont des hydrolases de la catégorie EC 3.6.5.
La GTPase des eucaryotes :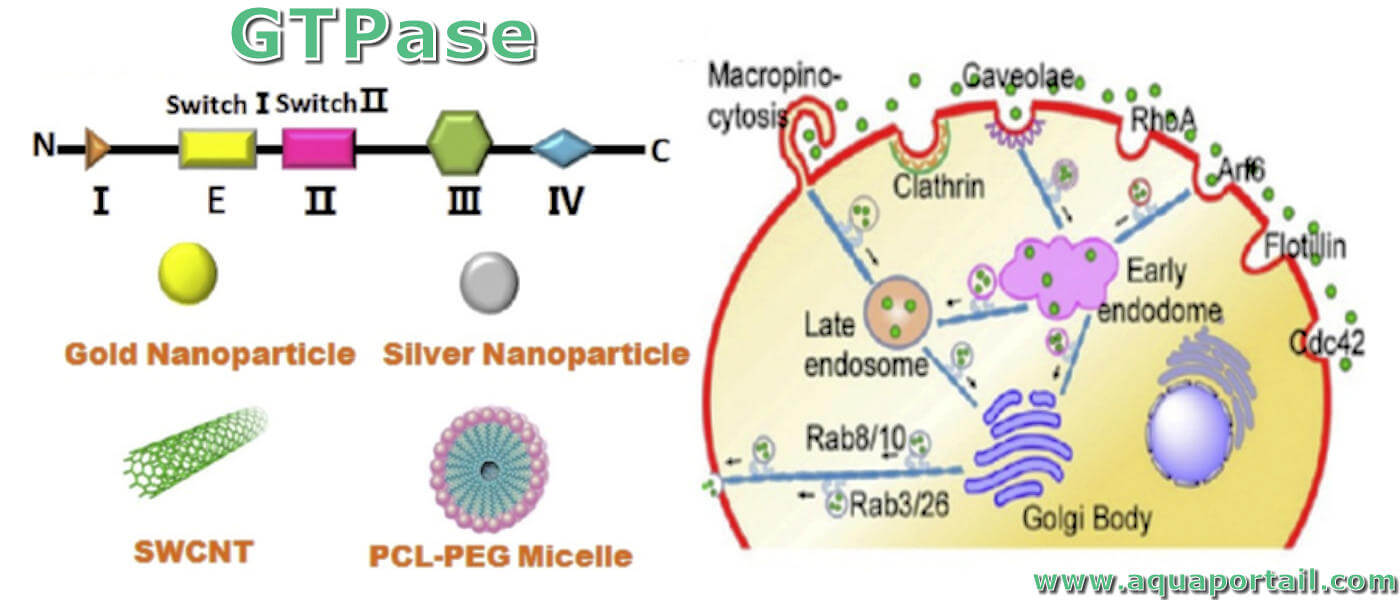
La petite GTPase est une sorte de protéine de liaison au GTP que l'on trouve couramment dans les cellules eucaryotes. Elle joue un rôle important dans la réorganisation du cytosquelette, la polarité cellulaire, la progression du cycle cellulaire, l'expression des gènes et de nombreux autres événements importants dans les cellules, tels que l'interaction avec des particules étrangères.
Explications
Les GTPases régulent une variété de processus cellulaires, y compris le trafic membranaire dans les cellules. Ces protéines agissent comme des commutateurs en alternant entre un état actif lié au GTP et un état inactif lié au GDP. Diverses protéines régulatrices modulent le taux de conversion entre ces deux états. Les facteurs d'échange de guanine-nucléotide (GEF) favorisent l'échange de GDP contre GTP, entraînant l'activation de la GTPase. D'autre part, les protéines activatrices de GTPase (GAP) favorisent l'hydrolyse de GTP en GDP, inactivant ainsi les GTPases.
Bien que les protéines G hétérotrimériques et les GTPases monomères semblent jouer un rôle dans la régulation du transport des vésicules, le rôle des GTPases monomères est mieux compris. En particulier, l'assemblage des protéines d'enveloppe est régulé par les GTPases de recrutement de manteaux, qui sont des GTPases monomères. En général, les GTPases de recrutement de manteaux sont abondantes dans le cytosol, où elles existent dans un état inactif lié au GDP. L'hydrolyse du GTP par de petites GTPases entraîne généralement leur translocation vers les membranes. Des exemples de ces GTPases de recrutement de manteaux sont les protéines du facteur ADP-ribosylation (ARF), qui régulent l'assemblage du manteau de la clathrine et du COPI au niveau des membranes de Golgi, et la protéine SarI, qui régule l'assemblage du manteau COPII au RE. Le bourgeonnement des vésicules COPI, par exemple, est déclenché par l'hydrolyse du GTP en GDP par l'ARF1 associée à la membrane. Une fois dans les membranes, ARF1-GTP recrute des coatomères préassemblées, ce qui entraîne une déformation de la membrane. La queue cytoplasmique d'une abondante protéine transmembranaire, connue sous le nom de p24, se lie à COPI via une séquence interne KK20, favorisant la formation de vésicules (Lee et al., 2004). Comme expliqué ci-dessous, les séquences KK20 représentent un motif qui joue un rôle dans les mécanismes de récupération conduisant au transport rétrograde de protéines dans la voie de sécrétion.
Une coatomère (coatome, coatomer en anglais) est un complexe protéique qui recouvre (comme un manteau) les vésicules de transport liées à la membrane. Deux types de coatomères sont connues :
- COPI (transport rétrograde du réseau trans-Golgi de réseau cis-Golgi et le reticulum endoplasmique RE);
- COPII (transport antérograde du RE vers le cis-Golgi).
Un autre ensemble de protéines régule le bourgeonnement des vésicules recouvertes de COPII par modulation de la petite activité GTPase. Avant que les vésicules recouvertes de COPII ne sortent du RE, un GEF spécifique intégré à la membrane se lie à SarI et catalyse l'échange de GDP en GDP par SarI. Un changement de conformation est induit dans SarI après cet échange GTP-GDP, conduisant SarI à exposer une queue d'acide gras normalement cachée dans le noyau SarI. L'exposition de la queue d'acide gras permet à SarI de s'insérer au niveau de la membrane du RE et de recruter des sous-unités COPII, qui à leur tour démarrent la déformation de la membrane et le processus de bourgeonnement des vésicules. L'hydrolyse du GTP par SarI et d'autres GTPases peut éventuellement inverser ce processus, bien qu'à une vitesse lente en l'absence d'activité GAP. Cela suggère que les GTPases de recrutement de manteaux pourraient réguler les aspects temporels de l'assemblage des vésicules en hydrolysant le GTP à un rythme lent mais prévisible.
Cycle GTPase
Le cycle GTPase de toutes les protéines G peut également être modifié à des fins expérimentales par GTPγS ou GDPβS. Le GTPγS est un analogue non hydrolysable du GTP avec une affinité élevée pour la sous-unité. L'activation de l'une quelconque des protéines G en présence de GTPγS conduit à l'échange de GTPγS contre GDP pour produire α-GTPγS.
Le cycle GTPase :
Schéma du mode d'activation des petites GTPases et du cycle GTPase. Facteurs d'échange de nucléotides de guanine GEF, protéines activatrices de GAP GTPase, inhibiteur de dissociation GDI GDP, facteur de dissociation GDF GDI, neurotrophines NTs, acide lysophosphatidique LPA, matrice extracellulaire E CM, molécule d'adhésion des cellules neurales NCAM.
La protéine G est ainsi activée pendant des périodes prolongées car le cycle de la GTPase est bloqué et le reste jusqu'à ce que GDP échange avec GTPγS. Une réponse similaire est obtenue par addition de fluorure d'aluminium. Le fluorure forme un complexe avec des traces d'Al3+ et se lie au α-GDP. La fraction fluorure d'aluminium simule le phosphate du GTP de sorte que, comme le GTPγS, α-GDP-AlF3 active de manière persistante la protéine G. (Coleman et al., 1994; Sondek et al., 1994). En revanche, GDPβS peut échanger avec GDP, laissant la protéine G à l'état inactif. GDPβS a une affinité plus élevée que GDP pour la protéine G et, par conséquent, le cycle GTPase est ralenti et passe plus de temps avec une protéine G inactive.
Les GTPases agissent comme des minuteurs pour assurer la fidélité de la synthèse des protéines. Le facteur d'élongation Tu (EF-Tu) a deux domaines accessoires articulés au noyau GTPase. GTP EF-Tu se lie et délivre des aminoacyl-ARNt (ARN de transfert) au site A d'un ribosome. Si l'anticodon ARNt correspond au codon ARN messager (ARNm) au site A, il reste lié suffisamment longtemps pour que le GTP soit hydrolysé. Cela libère EF-Tu du ribosome et permet d'ajouter le bon acide aminé à la chaîne polypeptidique en croissance. Le facteur accessoire EF-Ts est le facteur d'échange du PIB pour ce système.
GTPase et dynamine
En tant que membre de la famille GTPase, la dynamine a l'activité enzymatique pour hydrolyser le GTP en GDP et en phosphate inorganique. L'activité de la dynamine GTPase peut être stimulée par un certain nombre d'effecteurs fonctionnellement divers, y compris les microtubules (MT), les protéines oligomères contenant le domaine SH3 (par exemple, grb2) et les phospholipides acides, dont chacun favorise l'auto-assemblage de la dynamine.
Contrairement à la plupart des autres GTPases, cependant, la dynamine présente également une activité GTPase endogène élevée (∼2/min) et une affinité relativement faible pour le substrat (10–100 M). Une caractéristique des activités GTPase intrinsèques et stimulées de la dynamine est qu'elles sont coopératives (c'est-à-dire que l'activité GTPase spécifique de la dynamine augmente avec sa concentration lorsqu'elle est dosée dans des conditions à faible teneur en sel qui favorisent l'auto-assemblage). De nombreuses mutations au niveau d'acides aminés spécifiques ont aidé à délimiter des résidus importants dans la dynamine-1 nécessaires à la liaison et à l'hydrolyse du GTP et à l'auto-assemblage.
Synonymes, antonymes
Voir tous les synonymes pour "GTPase".1 synonyme (sens proche) de "gTPase" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à GTPASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot GTPASE est dans la page 3 des mots en G du lexique du dictionnaire.
Mots en G à proximité
groupe sanguin groupe sanguin de Bombay groupement prosthétique groupes frères GRP GTPaseguanaco guanidine guanine guano guanophore
En rapport avec "GTPase"
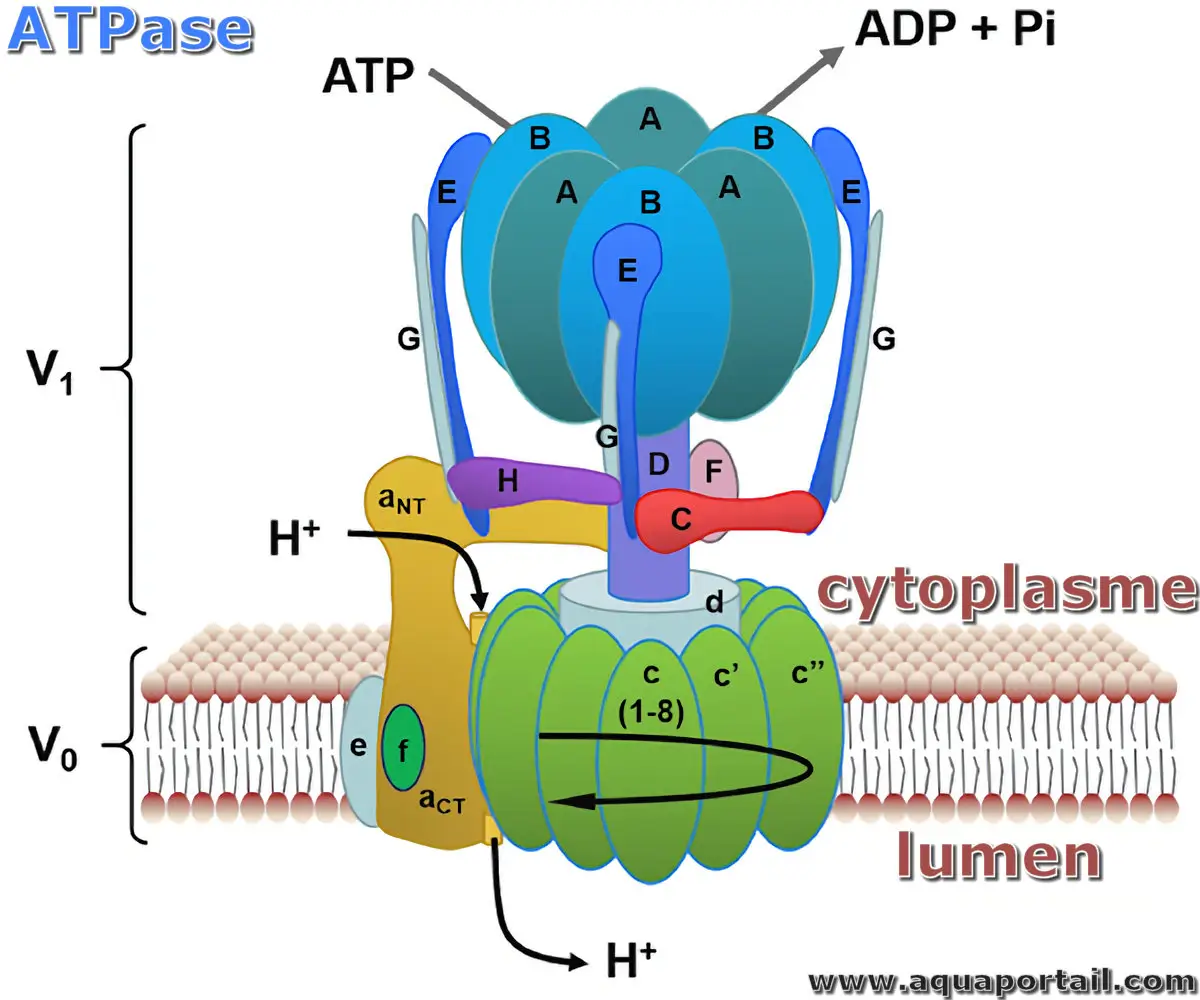
Les ATPases sont un groupe d'enzymes qui synthétisent ou hydrolysent l'ATP. Un gradient de protons à travers les membranes mitochondriales est le moteur...
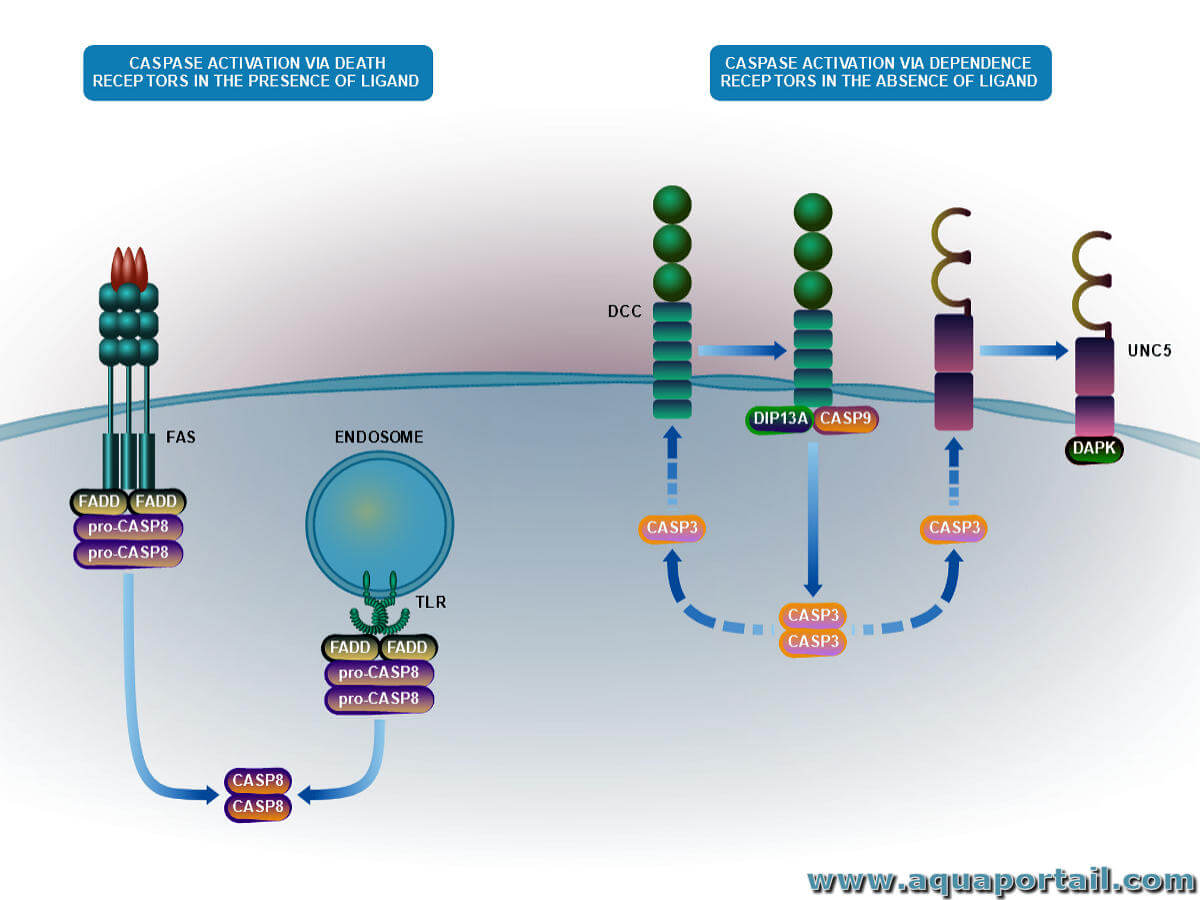
Une caspase est une protéase à cystéine. Les caspases clivent des protéines telles que la cytokine pro-IL-1β qui est ensuite sécrétée du cytoplasme cellulaire...

La lipase est une enzyme essentielle à la dégradation des graisses et des huiles en molécules plus petites, comme les acides gras et le glycérol, facilitant...

Une lipoprotéine lipase (LPL, EC 3. 1.1. 34) est une enzyme qui hydrolyse les lipoprotéines de très basse densité et les triglycérides des chylomicrons...
