Cyclooxygénase
Définition
La cyclooxygénase COX, ou prostaglandine-endopéroxyde synthase, est une enzyme qui catalyse l'oxydation de l'acide arachidonique en prostaglandines dans l'organisme. Cette enzyme peut agir comme une dioxygénase ou une peroxydase. Elle se lie à un groupe hémique pour chaque sous-unité homodimère. C'est une protéine membranaire périphérique située dans la membrane des microsomes et dans le réticulum endoplasmique. Elle est inhibée par les anti-inflammatoires non stéroïdiens tels que l'aspirine.
Un dimère de cyclooxygénase 2 :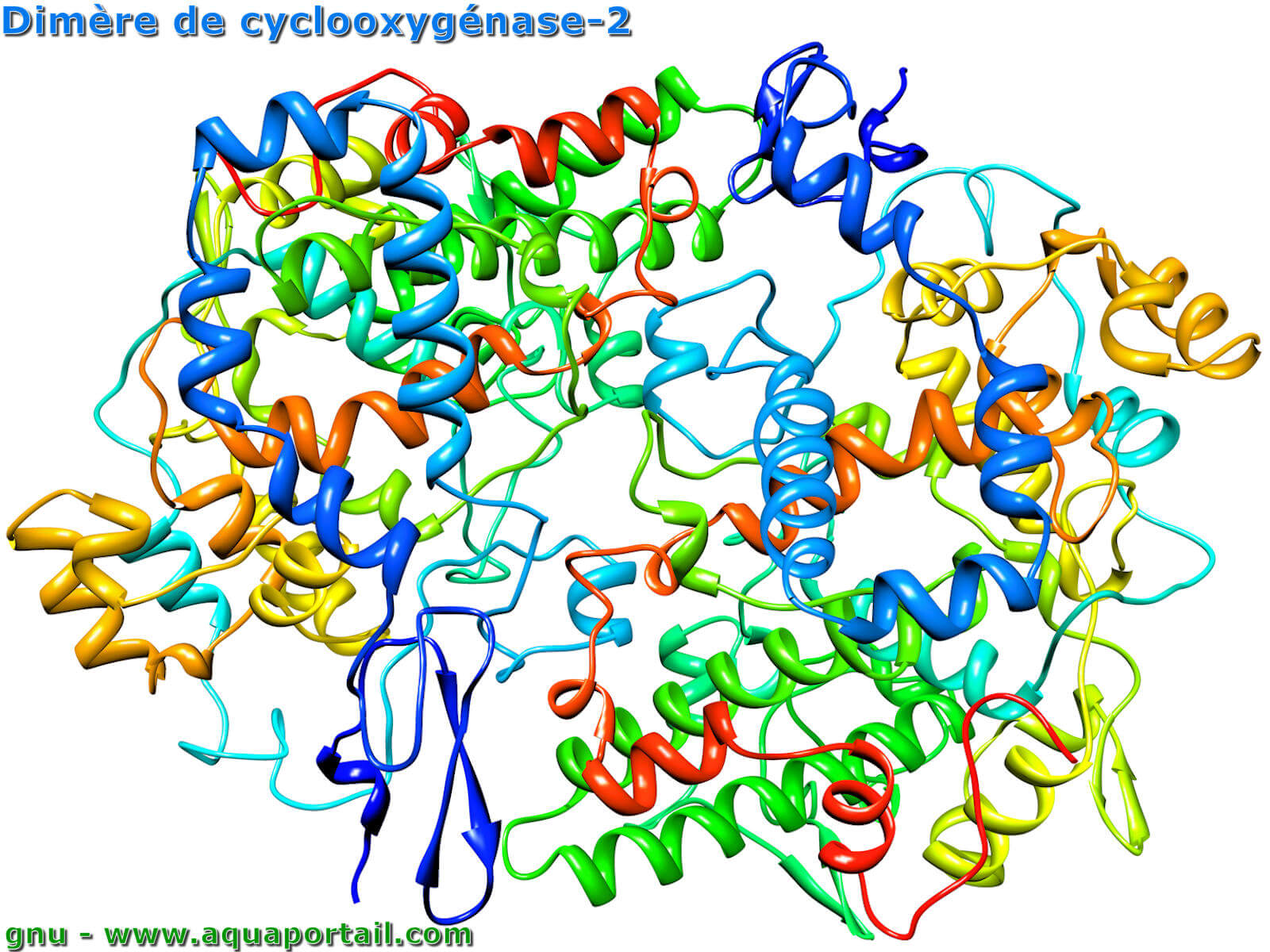
Ce dimère de cyclooxygénase-2 de souris est une prostaglandine H2 synthase.
Explications
Les cyclooxygénases COX sont les enzymes essentielles au début de la synthèse des prostaglandines à partir de l'acide arachidonique, de l'acide dihomogammalinolénique (DGLA) ou de l'acide eicosapentaénoïque (EPA). Comme cette première étape est limitante, les COX ont une fonction centrale dans la régulation du processus inflammatoire.
Voir aussi une monooxygénase et une lipoxygénase. L'acide gallique a un rôle d'inhibiteur de la cyclooxygénase 2.
Les cyclo-oxygénases sont situées à l'intérieur du réticulum endoplasmique, de l'enveloppe nucléaire et de l'appareil de Golgi et adhèrent à l'intérieur des membranes de ces compartiments cellulaires. Elles interviennent dans les cellules d'animaux depuis le début du développement des invertébrés, par ex. B. déjà dans les cellules du corail, mais pas dans les organismes unicellulaires, les plantes ou les insectes. Cependant, des enzymes apparentées de la grande famille des oxygénases inductibles par un agent pathogène (PIOX) sont présentes ici.
Très tôt dans l'évolution des cyclooxygénases, il existe deux isoenzymes qui ont la cyclooxygénase-1 (COX-1) et la cyclooxygénase-2 (COX-2), qui diffèrent par leur locus génique, ont une structure légèrement différente, existent dans différents types de cellules, sont régulées différemment, montrent une spécificité de substrat différente, pharmacologiquement différent influencé.
Modification de la structure
Les cyclooxygénases sont des protéines globulaires d'environ 600 acides aminés. Ils ont une masse moléculaire de 67 à 72 kDa, ont une séquence d'acides aminés égale à 65 % et ont des sites actifs presque identiques. Ils se combinent pour former deux dimères. Avec une région hydrophobe, ils flottent sur / à l'intérieur des membranes microsomales du réticulum endoplasmique. Cette région de liaison à la membrane forme une ouverture étroite, également hydrophobe, dans un canal se terminant en aveugle vers le site actif ayant une activité cyclooxygénase. Ce canal est plus étroit dans la cyclooxygénase-1 que dans la cyclooxygénase-2 (remplacé à la position 523 de l'isoleucine dans la valine).
Dans la partie interne du canal se trouve (en position 385) une tyrosine qui est activée en un radical tyrosyle avant que les cyclooxygénases puissent effectuer leur réaction proprement dite. Cela se fait au moyen de l'activité peroxydase des cyclooxygénases, qui se situe dans un autre site actif (du côté de l'enzyme opposé à la membrane du réticulum endoplasmique). Ici, initialement avec l'aide d'intervenir dans les oxydants du réticulum endoplasmique sur Fe3+ lié à l'hème à un radical ferryl-oxo-porphyrine (Fe4+=O•), qui soustrait ensuite un électron de la tyrosine OH au centre du Cyclooxygenaseaktivität et sous forme de radicaux actifs, tyrosyl-O•.
Fonction
Les cyclooxygénases catalysent la conversion de l'acide arachidonique en prostaglandine H2, ainsi que le DGLA et l'EPA en précurseurs correspondants de PG1 et de PG3. Cela intervient en deux étapes dans deux centres de réaction différents de l'enzyme :
- La première étape de réaction a lieu dans le centre catalytique décrit ci-dessus avec une activité cyclooxygénase. Un cycle de fermeture entre les atomes de carbone C8 et C12 est obtenu et deux atomes d'oxygène sont insérés en C9 et C11, qui forment alors une liaison covalente l'un avec l'autre, de sorte qu'un pont peroxyde se forme dans la prostaglandine G2, La prostaglandine G2 résultante diffuse hors du canal.
- La deuxième étape réactionnelle est catalysée par le centre réactionnel à activité peroxydase : ici, la prostaglandine H2 est formée à partir de la prostaglandine G2.
Les prostaglandines H2 résultantes sont ensuite partiellement synthétisées par isomérisation spontanée, en utilisant en partie différentes synthases ou oxydases, les différentes autres prostaglandines.
Cependant, les cyclo-oxygénases sont l'étape déterminante de la vitesse de formation des prostaglandines et occupent donc une position centrale dans la régulation du processus inflammatoire. Ils ont une demi-vie de 1 à 2 minutes lorsqu'ils sont exposés à l'acide arachidonique à une concentration permettant une utilisation maximale de l'enzyme.
Sous-types, isoensymes
Il existe deux sous-formes de cyclooxygénases, décrites en détail. Ils se sont séparés tôt dans l'évolution des invertébrés par duplication de gènes et ont depuis suivi leurs propres voies d'évolution. Ils partagent 65 % des séquences d'acides aminés, catalysent la même réaction enzymatique, mais sont distribués et régulés différemment dans l'organisme. Une différence importante entre la cyclooxygénase-1 et la cyclooxygénase-2 réside dans l'échange en position 523 de l'isoleucine contre la valine, ce qui rend le site actif de la cyclooxygénase-2 légèrement plus grand et peut également oxyder certains substrats plus volumineux en plus de l'acide arachidonique. Cela est possible, par exemple, pour les endocannabinoïdes tels que, par exemple, l'anandamide. Une autre différence est la régulation multiple de la transcription de la cyclooxygénase-2, qui est principalement induite par des processus inflammatoires et d'autres conditions d'activation cellulaire.
En 2002, un variant d'épissage de la cyclooxygénase-1 a été décrit sous le nom de COX-3. Le même gène, PTSG1, exprime un intron de moins. Il en résulte que le chien omet 93 paires de bases en une cyclooxygénase à activité enzymatique de moins de 31 acides aminés. Cependant, par mutation de décalage de trame, l'intron non exprimé mesure 94 paires de bases chez la souris et l'homme, ce qui entraîne une structure protéique complètement différente, ne possédant pas d'activité cyclooxygénase. Outre ces deux formes, neuf autres variantes d'épissure sont décrites.
Inhibiteurs de la COX
Les cyclooxygénases ont des inhibiteurs, surtout des anti-inflammatoires non stéroïdiens (AINS) :
- Étant donné que la voie de la lipoxygénase contient plus d'acide arachidonique lors de l'inhibition de la cyclooxygénase, ce qui entraîne la formation de leucotriènes anti-inflammatoires et renforçant l'anaphylaxie, les inhibiteurs de la cyclooxygénase peuvent induire une crise d'asthme.
- L'acide acétylsalicylique (aspirine) entraîne une transacétylation de la sérine en position 530 dans le centre catalytique de la cyclooxygénase, ce qui rend l'enzyme inopérable jusqu'à sa reconstitution. La cyclooxygénase-1 est 10 à 100 fois plus sensible que la cyclooxygénase-2.
- Les AINS compétitifs sont en concurrence pour le site de liaison de l'acide arachidonique au centre de la cyclooxygénase. L'ibuprofène se lie très rapidement et est rapidement lavé à nouveau. Le diclofénac ou l'indométacine ont un comportement de liaison plus lent.
- Les inhibiteurs sélectifs de la COX-2 inhibent principalement l'activité de la cyclooxygénase-2.
- Les substances analgésiques et/ou antipyrétiques telles que l'acétaminophène ou le métamizole sont des médicaments importants contre la douleur et la fièvre sans propriétés anti-inflammatoires. Le mécanisme et les conditions de leur inhibition plutôt faible des cyclooxygénases sont encore inexplorés.
Traitement des maladies inflammatoires
Les anti-inflammatoires non stéroïdiens sont actuellement utilisés en tant que médicaments de première intention pour le traitement de l'arthrose, des rhumatismes, du lupus érythémateux systémique (SLE) et d'autres maladies inflammatoires. Le traitement est principalement palliatif et ne modifie pas l'évolution de la maladie. Les AINS inhibent l'inflammation et réduisent la douleur.
Cyclooxygénases dans l'arthrite
La COX-1 et la COX-2 sont détectées à la fois dans le liquide synovial et dans la membrane synoviale de patients arthritiques au niveau des protéines et de l'ARNm11,13. Dans les deux cas, les cellules responsables sont des cellules mononucléées mono-phagocytaires. La contribution de chacune de ces deux isoformes à la synthèse des prostaglandines n'est pas encore connue avec précision. Il existe des données indiquant que la production de PG peut dépendre presque exclusivement de COX-2, même en présence de COX-1. Dans les systèmes murins in vitro, la synthèse de PG dépend du couplage entre phospholipases et cyclooxygénases.
Par exemple, un traitement avec des mitogènes de fibroblastes entraîne une augmentation de la libération de PG. Si l'expression de la COX-2 est bloquée, PG n'existe pas, même en présence de COX-1. Ceci, chez l'homme, expliquerait comment des inhibiteurs sélectifs de la COX-2 pourraient inhiber la synthèse articulaire de PG (douleur et inflammation), même en présence de grandes quantités de COX-1 dans la membrane synoviale et les cellules du liquide synovial.
Cyclooxygénases et tractus gastro-intestinal
La PGE2 réduit la production d'acide gastrique et provoque une vasodilatation de la muqueuse. En outre, il augmente la sécrétion de mucus, de suc gastrique et de bicarbonate duodénal. Chez l'homme, la plupart des prostaglandines à effet protecteur de la muqueuse gastrique sont synthétisées par la COX-1. Cependant, dans les cancers du côlon humain, la COX-2 est exprimée en grande quantité.
Cyclooxygénases rénales
es prostaglandines sont produites dans différentes régions anatomiques du rein. Sa suppression par le blocage de la COX-1 pourrait être le mécanisme le plus important de la néphrotoxicité produite par les AINS.
Par exemple, les prostaglandines PGI2, PGE2 et PGD2 diminuent la résistance vasculaire en dilatant les vaisseaux médullaires et en augmentant la perfusion rénale. Cela provoque la redistribution du flux sanguin du cortex rénal vers les néphrons de la région juxtamedullary. L'inhibition de ces prostaglandines a tendance à diminuer la perfusion rénale totale et à redistribuer le flux sanguin dans le cortex. Dans les situations extrêmes, cela se termine par une vasoconstriction rénale aiguë et une ischémie rachidienne pouvant entraîner une insuffisance rénale aiguë. De plus, la PGE2 a un effet diurétique et natriurétique, d'où la rétention d'hydrosaline que les AINS produisent. La PGE2 et la PGI2 maintiennent la filtration glomérulaire.
La synthèse rénale des prostaglandines est un mécanisme physiologique pour contrer la diminution de la perfusion rénale. La réduction du débit sanguin intervient dans des situations de contraction volumétrique. Dans ces circonstances, les PG génèrent une vasodilatation compensatoire du système vasculaire rénal qui neutralise l'effet de la stimulation de l'axe rénine-angiotensine-aldostérone. Le maintien des fonctions rénales chez les patients présentant une insuffisance cardiaque, une cirrhose ou une insuffisance rénale dépend de l'action vasodilatatrice des prostaglandines. La PGE2 et la prostacycline directement impliquées dans cet effet vasodilatateur sont synthétisées par la voie de la COX-1. Dans les situations de privation de solution saline, l'expression de COX-2 a été observée dans la macula dense rénale.
Synonymes, antonymes
Voir tous les synonymes pour "cyclooxygénase".2 synonymes (sens proche) de "cyclooxygénase" :
- COX
- prostaglandine-endopéroxyde synthase
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à CYCLOOXYGÉNASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CYCLOOXYGENASE est dans la page 9 des mots en C du lexique du dictionnaire.
Mots en C à proximité
cyclodextrine cyclogenèse cycloïde cyclomorphose cyclone cyclooxygénasecyclopeptide cyclopoïde cyclops cyclorrhaphe cyclose
En rapport avec "cyclooxygénase"
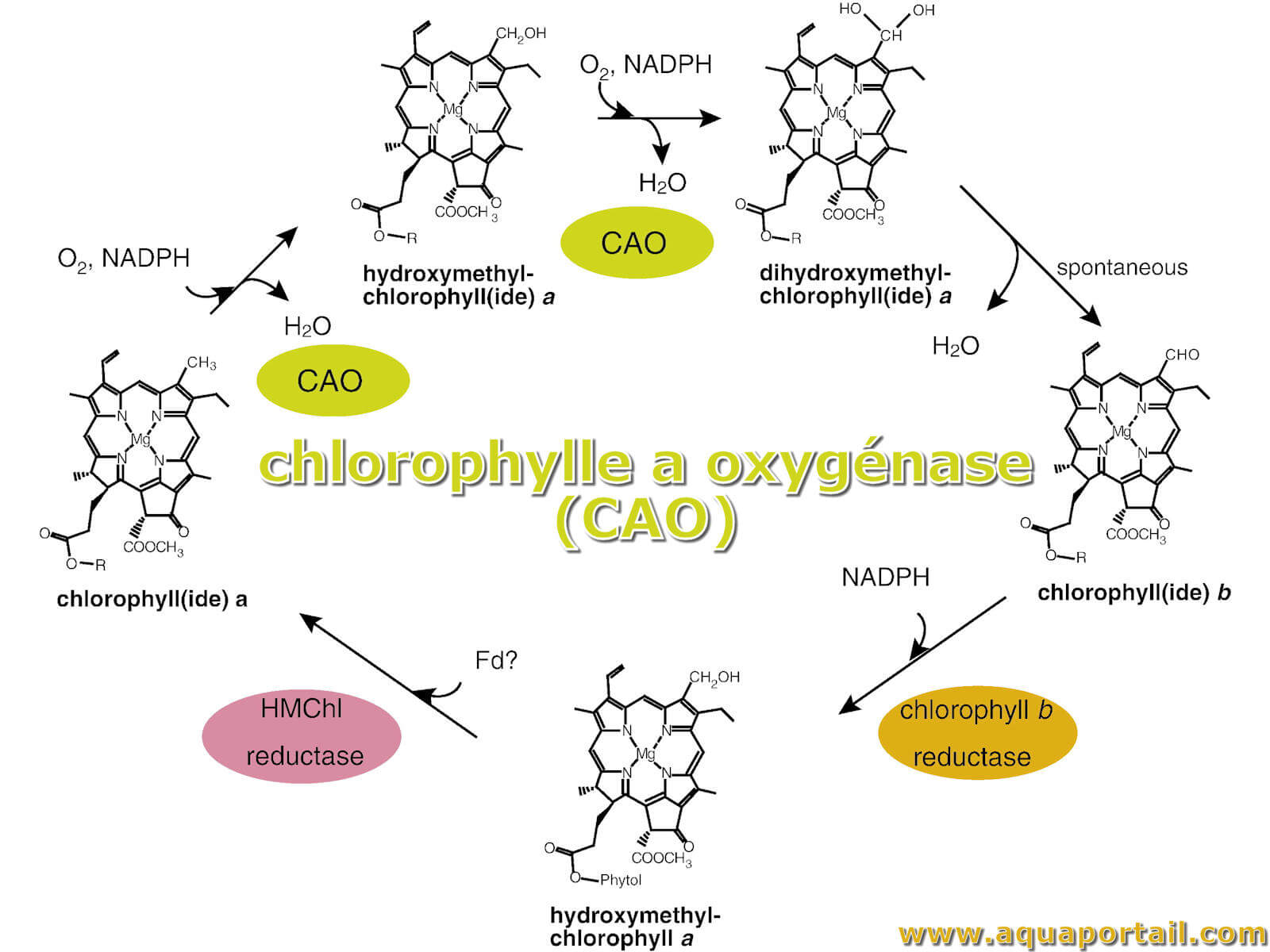
La chlorophylle a oxygénase (CAO) est une enzyme qui catalyse la synthèse de la chlorophylle b à partir de la chlorophylle a.
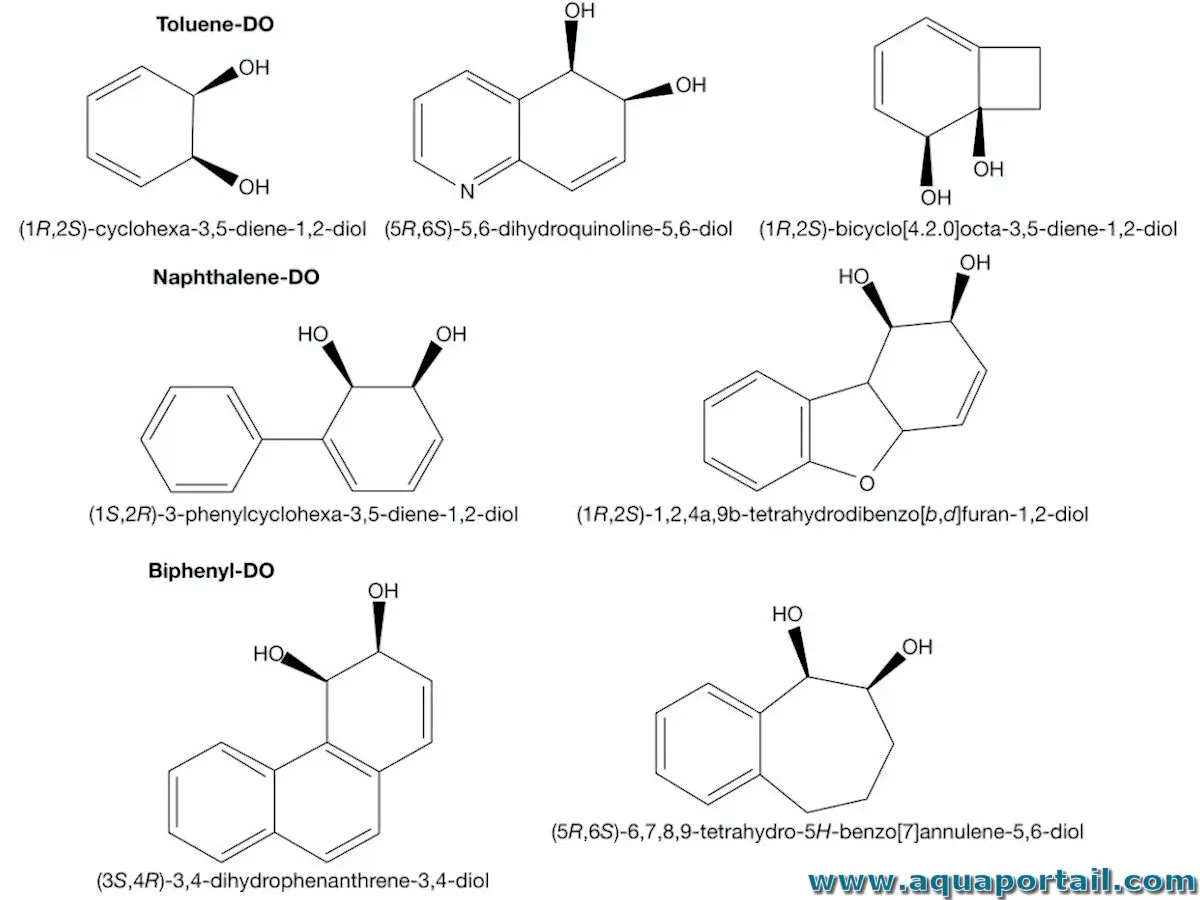
Les dioxygénases sont un groupe d'enzymes qui catalysent l'incorporation de deux atomes d'oxygène moléculaire dans les substrats.

Une lipoxygénase est une enzyme qui oxyde les acides gras polyinsaturés ou alcènes avec deux atomes d'oxygène en eicosanoïdes.
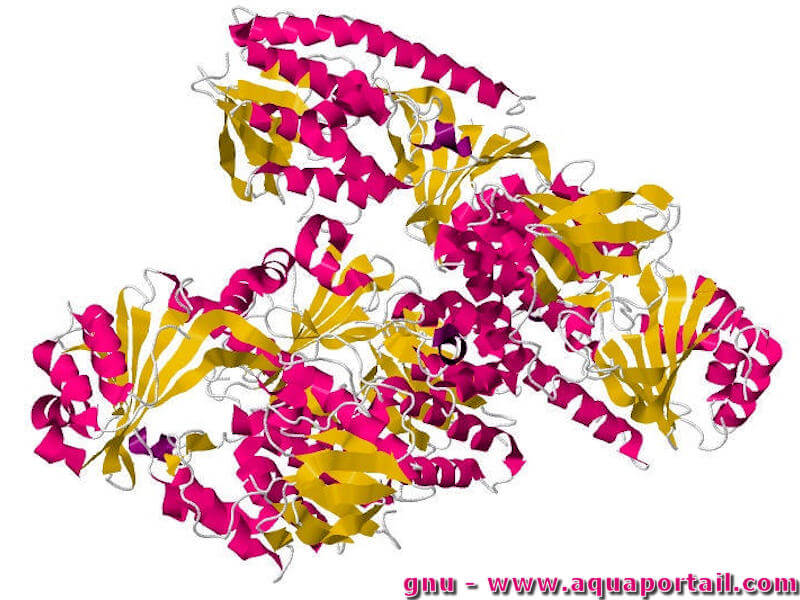
Une monooxygénase est une enzyme qui favorise la catalyse des atomes d'oxygène. Les mono-oxygénases sont des enzymes qui incorporent un groupe hydroxyle dans...
