La phénylalanine
La phénylalanine (Phe) est un acide aminé α-aromatique chiral, avec une chaîne latérale hydrophobe, qui se présente sous sa forme L. On la trouve dans des protéines telles que la L-phénylalanine, qui est l'un des 10 acides aminés essentiels pour l'Homme. La phénylalanine est également présente dans de nombreux agents psychoactifs.
Une molécule de phénylalanine :
Le nom IUPAC de la phénylalanine est l'acide 2-amino-3-phénylpropanoïque. Sa formule moléculaire est C9H11NO2. Sa masse molaire vaut 165,19 g/mol. Son point de fusion est à 556 K (283 ℃).
Généralités
La L-phénylalanine, en tant que composant protéique, un acide aminé, est pour l'homme un protéinogène essentiel (impliqué dans la synthèse des protéines). La phénylalanine est structurellement dérivée de l'alanine et est amphiphile.
La forme D (R-phénylalanine) n'est pas métabolisable et ne peut être préparée que de manière synthétique.
Lorsque "phénylalanine" ne contient pas d'autre suffixe de nom (préfixe), il est indiqué dans la suite du texte et dans la littérature scientifique, il s'agit toujours de L-phénylalanine.
L'homophénylalanine, en tant que motif structural des médicaments, sert en particulier dans des inhibiteurs de l'ECA de la 2ème génération.
Biochimie
La chaîne latérale caractéristique de cet acide aminé contient un cycle benzénique et constitue donc l'un des acides aminés aromatiques. Son utilisation excessive produit des effets laxatifs, ainsi que de la tyrosine et du tryptophane.
La L-phénylalanine peut être transformée en tyrosine par une réaction catalysée par l'enzyme phénylalanine hydroxylase. La L-phénylalanine est également le précurseur des catécholamines telles que la L-DOPA (L-3,4-dihydroxyphénylalanine), la norépinéphrine et l'épinéphrine, à travers une étape de formation de la tyrosine.
Par ailleurs, la L-phénylalanine est présente dans la structure de neuropeptides tels que la somatostatine, la vasopressine, la mélanotropine, l'enképhaline, l'hormone corticotrope (ACTH), l'angiotensine, la substance P et la cholécystokinine.
La phénylalanine utilise les mêmes canaux de transport que le tryptophane pour traverser la barrière hémato-encéphalique. En quantités excessives, les suppléments peuvent nuire à la production de sérotonine et d'autres acides aminés aromatiques, ainsi qu'à la production d'oxyde nitrique, en raison de la consommation excessive des cofacteurs associés, le fer ou la tétrahydrobioptérine.
Les enzymes correspondants à la fabrication de ces composés ce sont ceux de la famille des acides aminés aromatiques hydroxylases et oxyde nitrique synthases.
Biosynthèse
La L-phénylalanine est synthétisée chez les plantes via la voie de l'acide shikimique (voie du shikimate). La voie de l'acide cinnamique permet aux flavonoïdes d'être biosynthétisés à partir de L-phénylalanine.
Par hydroxylation dans le corps humain de la L-phénylalanine implique l'acide aminé protéinogène L-tyrosine.
Sources et occurrences
La phénylalanine se trouve principalement dans les aliments riches en protéines et en peptides; les deux d'origine animale tels que la viande rouge, le poisson, les oeufs et les produits laitiers; comme d'origine végétale tels que les asperges, les pois chiches, les lentilles, les arachides, le soja et les bonbons. On le trouve également dans de nombreux médicaments psychotropes couramment utilisés. La phénylalanine, en raison de son cycle aromatique, n'est pas un édulcorant en soi, doit être liée à l'acide aspartique à cette fin.
Étant donné qu'il s'agit d'un acide aminé essentiel pour le corps humain, il doit être ingéré en quantité suffisante avec les aliments.
La phénylalanine fait partie de la composition de l'aspartame, un édulcorant artificiel présent dans les aliments diététiques et est très courante dans les boissons rafraîchissantes. L'utilisation de phénylalanine par les femmes enceintes ou les patients phénylcétonuriques n'est pas recommandée.
En raison de la phénylcétonurie, les produits contenant de l'aspartame portent normalement une mise en garde sur l'étiquette concernant la présence de phénylalanine. Il a été constaté que la phénylalanine possède la capacité unique de bloquer certaines enzymes, les enképhalinases du système nerveux central, qui sont normalement responsables de la dégradation des hormones naturelles analogues à la morphine.
Ces hormones sont appelées endorphines et enképhalines et agissent comme de puissants analgésiques endogènes. La phénylalanine est efficace dans le traitement de la douleur au bas du dos, des crampes menstruelles, des migraines, des douleurs musculaires, de la polyarthrite rhumatoïde et de l'arthrose. Il est également utilisé dans les traitements antidépresseurs.
La phrase "contient une source de phénylalanine" imprimée sur certains emballages de produits alimentaires fait référence à la présence de l'édulcorant aspartame, à partir duquel la phénylalanine est libérée au cours du processus de digestion. Cela est important pour les personnes qui doivent se conformer à un régime pauvre en phénylalanine en raison d'un trouble métabolique, la phénylcétonurie (PCU).
Propriétés
La phénylalanine est présente principalement sous forme de "sel interne" ou de zwitterion, dont la formation peut être expliquée par le fait que le proton du groupe carboxy migre vers la paire d'électrons de l'atome d'azote du groupe amino.
Dans le champ électrique, le zwitterion ne migre pas car il est non chargé dans son ensemble. À proprement parler, c'est le cas au point isoélectrique (à un certain pH) où la phénylalanine a également sa plus faible solubilité dans l'eau. Le point isoélectrique de la phénylalanine est de 5,48.
La L-phénylalanine libre a un goût amer, le seuil de détection étant de 5 à 7 mmol/L. En revanche, la D-phénylalanine libre a un goût sucré, le seuil de détection est de 1 à 3 mmol/L.
Médecine
Pour les humains, la L- phénylalanine est un acide aminé essentiel qui joue un rôle important dans le métabolisme de l'azote. Dans le foie, la L- phénylalanine peut être convertie en L - tyrosine, si elle est présente. Celle-ci est catalysée par la phénylalanine hydroxylase, une monooxygénase. L'agent réducteur ici est la saproptérine.
Cependant, si la quantité de L- phénylalanine est insuffisante, la tyrosine doit également être ingérée avec de la nourriture. Ce mécanisme ne fonctionnant plus en situation de stress important, la L - tyrosine doit être absorbée dans de tels cas. La dose quotidienne normale devrait être de 14 mg / kg de poids corporel (un adulte). Il est fondamentalement suffisamment couvert par la nourriture (voir aussi ci-dessus). Une consommation excessive peut rendre la phénylalanine laxative.
La L- phénylalanine est impliquée dans la synthèse de l'épinéphrine, de la noradrénaline, de la L- dopa, du PEA et de la mélanine. L'acide aminé L-phénylalanine sert de matériau de départ pour de nombreuses autres substances, par exemple. B. pour la dopamine messager.
Des mélanges racémiques de D- et L-phénylalanine (DLPA) sont utilisés comme analgésiques ou dans la dépression. Ils ont un effet améliorant l'humeur. L'effet analgésique présumé de la DL-phénylalanine peut s'expliquer par le blocage possible de la dégradation enképhaline de la D- phénylalanine par l'enzyme carboxypeptidase A.
C'est l'un des rares exemples d'effets métaboliques des énantiomères D. La phénylcétonurie (PCU) est un trouble métabolique génétique. La L-phénylalanine n'est pas complètement dégradée dans le corps. Les patients ne tolèrent qu'une fraction de l'apport habituel d'aliments contenant de la phénylalanine. Cela concerne avant tout les protéines naturelles, mais aussi les substances synthétiques, comme édulcorant aspartame.
Les personnes souffrant de PCU sont dépourvues de l'enzyme phénylalanine hydroxylase. Il convertit la L-phénylalanine en L-tyrosine chez l'homme en bonne santé. Si l'enzyme manque, la concentration de L-phénylalanine dans le sang atteint un niveau élevé. Cela a un effet défavorable sur la maturation et la fonction du cerveau. De plus, les processus inflammatoires peuvent affaiblir l'activité de l'enzyme et conduire à une hyperphénylalaninémie modérée.
Pathologies
La phénylcétonurie, maladie génétique, est due au manque d'enzyme phénylalanine hydroxylase ou dihydroptérine réductase (DPHR). Cette carence entraîne la dégradation de la phénylalanine par une voie métabolique alternative en phénylpyruvate, un neurotoxique qui affecte sévèrement le cerveau pendant la croissance et le développement.
Les effets de l'accumulation de cette cause neurotoxique sont l'oligophrénie phénylpyruvique, caractérisée par un quotient intellectuel d'environ 50. Elle influence également grandement le métabolisme. Une déficience dans le métabolisme de la phénylalanine peut provoquer une alcaptonurie, une maladie héréditaire qui provoque une urine noircie et des calculs rénaux fréquents.
Utilisation industrielle
L'édulcorant artificiel aspartame est un ester de L–aspartyl-L-phénylalanylméthyle, c'est-à-dire un ester méthylique d'un dipeptide d'acide L–aspartique et de L-phénylalanine. Le natéglinide est fabriqué à partir de D- phénylalanine. Pour la synthèse du médicament, l'Alacepril L- phénylalanine est utilisé comme produit de départ. Dans la synthèse stéréosélective, la L- ou D-phénylalanine et ses dérivés sont importants en tant que matériaux de départ et catalyseurs énantiosélectifs.
Histoire
La L-phénylalanine a été isolée des légumineuses en 1879 et synthétisée en 1882. En 1882, Erlenmeyer et Lipp le synthétisèrent pour la première fois à partir de phénylacétaldéhyde, de cyanure d'hydrogène et d'ammoniac.
En 1961, Heinrich Matthaei et Marshall Warren Nirenberg ont été les premiers à utiliser l'expérience poly-U pour identifier celle de l'acide aminé phénylalanine; le triplet de base attribué est UUU. Ils ont montré qu'en utilisant un ARNm pour insérer plusieurs uracils répétés dans le génome de la bactérie E. coli, ils pouvaient causer la les bactéries ont produit un polypeptide constitué uniquement d'acides aminés phénylalanines répétés.
Cette découverte a permis d'établir la nature de la relation de codage qui relie les informations stockées dans l'acide nucléique génomique à l'expression de la protéine dans la cellule vivante.
En rapport avec "phénylalanine"

L'alanine (acide amino-2-propanoïque) est un nutriment, un acide aminé non essentiel entrant dans la composition des protéines des êtres vivants.

Le cycle de l'alanine est un synonyme propre du cycle de Felig, du cycle de Cahill ou encore du cycle de Cori.
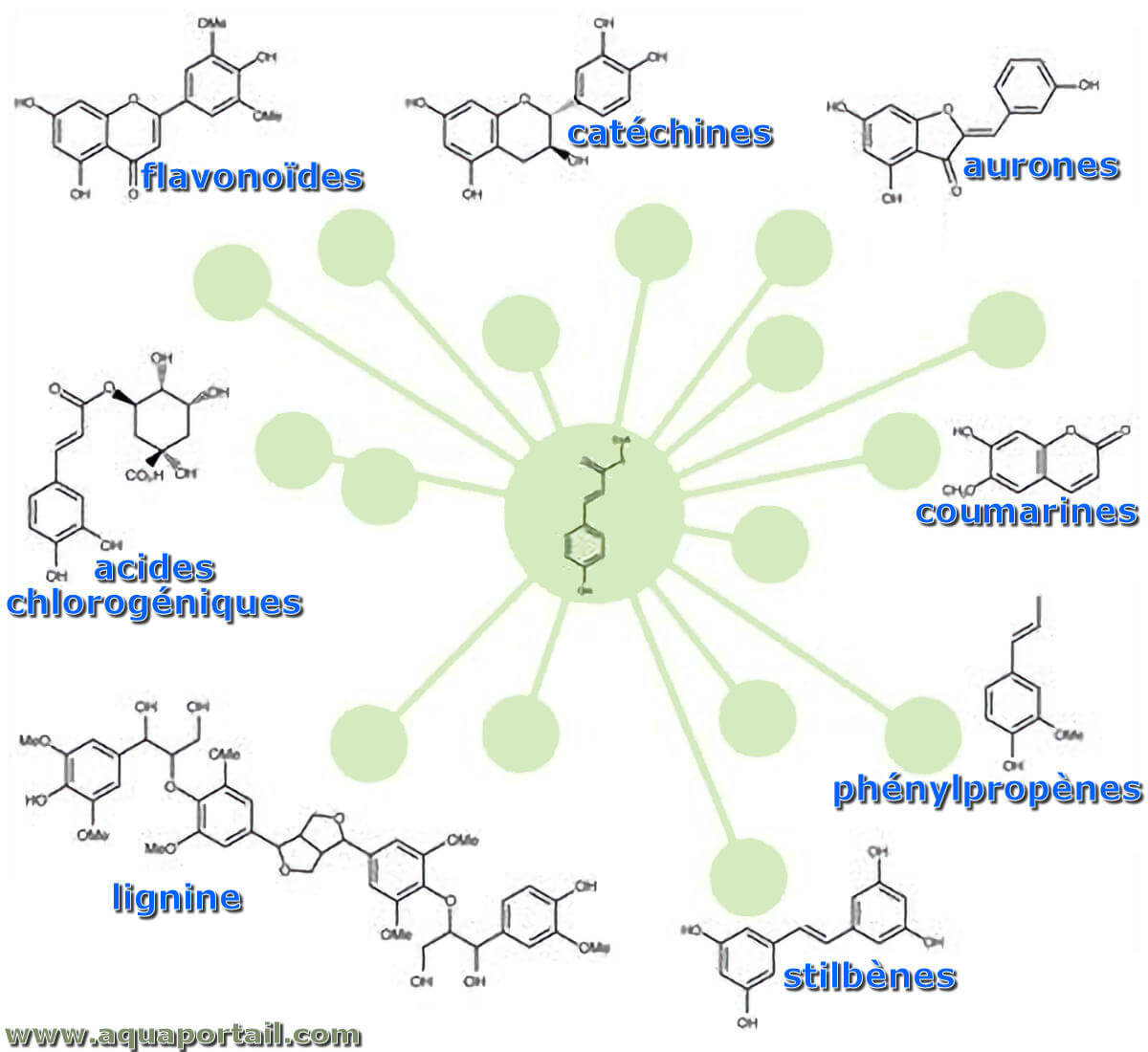
Les phénylpropanoïdes sont une famille de composés aromatiques dérivés de l'acide phénylpyruvique.

Le phényléthanol est un alcool primaire, membre des benzènes, qui est de l'éthanol substitué par un groupe phényle en position 1 (1-phényléthanol)...
