La synthèse de protéines
La biosynthèse des protéines est la formation de nouvelles protéines dans les cellules par transcription d'ADN en ARN messager. Les protéines sont construites à partir d'acides aminés. La synthèse des protéines est le processus central d'expression génique pour tous les êtres vivants dont l'information génétique fournit le type de protéine.
La biosynthèse des protéines dans une cellule eucayote :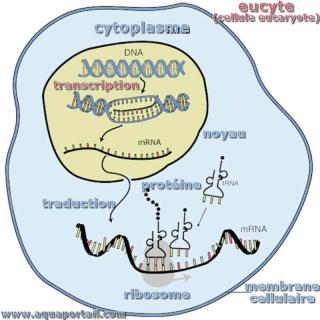
Schéma simplifié de la biosynthèse des protéines dans un eucyte (la cellule eucaryote).
Généralités
La synthèse réelle d'une protéine à partir de ses éléments constitutifs, les acides aminés protéinogéniques, a lieu au niveau des ribosomes et est également appelée traduction, puisque la séquence de bases d'un ARN messager (ARNm) est traduite en séquence d'acides aminés d'un peptide. Ceci est effectué en assignant de manière continue l'anticodon d'un ARN de transfert (ARNt) à chaque codon de l'ARNm et en liant leur acide aminé transporté individuellement à celui qui est voisin (liaison peptidique), de façon à obtenir une chaîne avec une séquence caractéristique d'acides aminés. Ce polypeptide peut se déployer dans le milieu environnant en une structure de forme tridimensionnelle structurée, la protéine native. Il est souvent modifié par des scissions, des conversions et des annexes après modification post-traduction.
Alors que dans les cellules procaryotes, les procytes (ou protocytes), l'ADN en forme d'anneau est librement présent dans le cytosol et que la synthèse de la protéine ribosomale a lieu presque immédiatement et promptement sur la matrice d'ARNm qui vient d'être transcrite, les conditions dans les cellules eucaryotes (eucytes) sont plus compliquées. Pour le génome, qui est réparti sur plusieurs chromosomes, le noyau de la cellule a son propre compartiment, dans le caryoplasme, dont la transcription a lieu. La copie d'ARN primaire (hnARN) est d'abord stabilisée, retravaillée et préparée pour l'exportation nucléaire avant de traverser un pore nucléaire sous forme d'ARNm et d'entrer dans le cytoplasme, qui contient les sous-unités des ribosomes. Cette division spatiale et le chemin du processus en plusieurs étapes permettent donc des moyens supplémentaires de modifier de manière post-transcriptionnelle un ARN (hn) et ainsi de réguler l'expression génique ou d'exclure certains matrices d'ARN de la biosynthèse de protéines (silençage génique).
Certains types de bactéries, d'archées et de champignons peuvent utiliser la synthèse protéique ribosomale pour construire des protéines spéciales permettant la synthèse peptidique non ribosomale sous la forme d'un complexe multi-enzymatique.
Transcription
Dans la première étape de la biosynthèse des protéines dans une cellule, des parties de gènes de l'ADN double brin sont récupérées, lues et transcrites en molécules d'ARN simple brin. Dans ce processus, les nucléobases des blocs de construction d'ARN (uracile, cytosine, guanine, adénine) sont associées de manière complémentaire à la séquence actuelle des bases nucléiques de l'ADN (adénine, guanine, cytosine, thymine). Dans le greffon d'ARN alors lié au brin, le ribose remplace le désoxyribose et l'uracile au lieu de la thymine. L'information génétique étant contenue dans la séquence de bases, un codogène de l'ADN est transcrit en un codon de l'acide ribonucléique messager ou messager, appelé ARNm en abrégé.
Pour la transcription d'un gène, entre autres facteurs, une ARN polymérase est nécessaire en tant qu'enzyme qui catalyse la construction en cours du polymère d'ARN en fonction de la matrice d'ADN. Les ribonucléosides triphosphates (UTP, CTP, GTP et ATP), qui sont affectés à la matrice en tant que paires de bases, sont liés ensemble pour former le polynucléotide d'un ARN, chaque fois avec le clivage de deux groupes phosphates des triphosphates. Il peut exister différents types d'ARN polymérase pour la transcription de gènes codant pour des protéines au moyen d'un ARNm et pour les autres gènes, par exemple pour la formation d'un ARNr ou d'un ARNt.
Chez les eucaryotes, la transcription a lieu dans le noyau; par conséquent, l'ARNm doit être exporté du noyau vers le cytosol puisque la traduction y est effectuée. En revanche, les procaryotes n'ont pas de compartiment central, la transcription y est effectuée en plus de la traduction dans le cytoplasme.
Modification post-transcriptionnelle
Une modification post-transcriptionnelle a lieu selon :
- épissure : dans le cas des eucaryotes, à la suite de la transcription pure, les introns non-codants contenus dans le pré-ARNm obtenu doivent être excisés de manière à ne conserver que les exons requis. Ce processus s'appelle l'épissage. Les séquences de consensus servent à reconnaître les introns. Lors de l'épissage, différents snRNP se lient dans la région des introns et des jonctions exon-intron. Celles-ci conduisent à la formation de coupures de spliceosomes des liaisons phosphodiester et donc à l'excision des introns. Dans le même temps, les exons sont ligaturés. L'épissage intervient également dans l'ARNr et l'ARNt.
- capsulage : pendant ce temps, le plafonnement a lieu, où la stabilité de l'ARN est accrue. Dans ce cas, une structure dite 5′-cap est attachée, dans laquelle l'extrémité 5′ du pré-ARNm en synthèse est convertie en une structure appelée "cap" et l'ARNm avant digestion par les 5′-exonucléases et Protège les phosphatases.
- polyadénylation : en polyadénylation, les queues poly (A) sont attachées à l'extrémité 3 'nouvellement formée de l'ARN (jusqu'à 250 nucléotides de long). Cette queue poly (A) facilite l'exportation d'ARNm dans le cytoplasme et protège également l'extrémité 3 'de la dégradation enzymatique.
- édition de l'ARN : dans l'édition d'ARN, les nucléobases simples ou multiples de la molécule d'ARN sont modifiées (modifiées), insérées (insérées) ou excisées (supprimées) après la transcription. Par exemple, la modification sur l'ARNm peut produire un nouveau codon d'arrêt en amont du premier; la traduction est alors interrompue ici et l'isoforme plus courte d'une protéine se forme. La modification de l'ARN n'intervient que dans certains organismes, cellules ou organites cellulaires et est souvent limitée à des séquences nucléotidiques particulières.
Traduction ou biosynthèse de protéines
La traduction est la traduction de la séquence de bases de l'ARNm dans la séquence d'acides aminés de la protéine qui intervient au niveau des ribosomes. Dans l'ARNm, trois bases consécutives, un triplet de bases, forment dans le cadre de lecture ouvert un codon codant pour un acide aminé (voir code génétique). Sur le ribosome, les codons sont traduits selon leur séquence en acides aminés et ceux-ci sont liés de manière séquentielle pour former un polypeptide.
Pour former une liaison peptidique entre deux acides aminés, ils doivent être rapprochés dans l'espace. Cela nécessite la surface d'une grande structure supramoléculaire. Cette tâche est remplie par les ribosomes, composés d'une petite et d'une grande sous-unité, qui forment deux sites de liaison adjacents : le site A et le site P.
Puisqu'il n'y a pas de relation structurelle entre un codon et l'acide aminé correspondant, il est nécessaire de disposer d'une pièce intermédiaire qui lie l'acide aminé d'une part et reconnaît le codon correspondant de l'ARNm d'autre part. Cette fonction de médiation est réalisée par transfert de molécules d'acide ribonucléique, de divers ARNt, en tant que transporteurs d'acides aminés avec région de reconnaissance. Ils ont deux sites de liaison exposés distincts : le site de liaison des acides aminés et l'anticodon. Les sites de liaison aux acides aminés des ARNt sont spécifiquement chargés avec l'acide aminé approprié par l'intermédiaire des aminoacyl-ARNt synthétases. L'ARNt reconnaît à l'anticodon le codon complémentaire de l'ARNm et se lie spécifiquement à celui-ci.
Le processus de traduction en tant que tel peut être subdivisé en trois phases : la phase initiale, la phase d'élongation et enfin la fin :
- phase initiale : Lorsqu'un ARNm préalablement synthétisé atteint un ribosome, la petite sous-unité du ribosome se déplace le long de l'ARNm jusqu'à rencontrer le codon de départ AUG. L'ARNt de méthionine correspondant à l'anticodon UAC se lie au codon (complexe d'initiation).
- phase d'élongation : par clivage du GTP, la grande sous-unité du ribosome s'annule également et l'élongation commence. L'ARNt de la méthionine est situé à la phase d'initiation sur le site de liaison P, de sorte que dans le site de liaison A, l'ARNt suivant peut se fixer. Une peptidyl transférase lie la méthionine du premier ARNt à l'acide aminé de l'ARNt suivant; cette formation d'un dipeptide a lieu dans le site de liaison A. Enfin, les unités ribosomiques avancent par un triplet de base. L'ARNt avec le dipeptide est maintenant sur le site de liaison P, d'où il a déplacé le tout premier ARNt, maintenant non chargé, et sur le site de liaison A libre, il est possible de rattacher le prochain ARNt, l'anticodon complémentaire du triplet de base du brin d'ARNm convient.
- résiliation : si un ribosome se déplaçant le long de l'ARNm frappe l'un des trois codons d'arrêt, la traduction s'arrête pour le moment car il n'y a pas de molécules d'ARNt appropriées codées pour un acide aminé (suppression). Ils sont remplacés par des facteurs dits de terminaison ou de libération (RF), qui se lient au site A et modifient la spécificité de la peptidyltransférase vis-à-vis du substrat pour activer une molécule d'eau au lieu d'un ARNt-AA. Son attaque nucléophile sur la liaison entre la chaîne peptidique et l'ARNt conduit finalement à la libération de la protéine synthétisée et à la séparation de l'ARNm du ribosome.
Modification co- et post-traductionnelle
Les chaînes polypeptidiques de certaines protéines sont déjà modifiées (par co-traduction) par des enzymes spéciales lors de la traduction, mais dans la plupart des cas, les protéines sont modifiées après la traduction (après la traduction). Alors que les chaperons influencent le processus de formation du repliement des protéines, qui dépend également de l'association de complexes protéiques, une cellule offre également une multitude de possibilités pour modifier spécifiquement la structure d'une protéine, créant ainsi fonctionnellement d'autres espèces protéiques et modifiant le protéome par modification.
Ces modifications comprennent le clivage d'acides aminés mono- terminaux ou même des séquences peptidiques plus longues dans des protéines précurseurs, l'introduction de liaisons supplémentaires, par exemple des ponts disulfure entre des résidus de cystéine ou des groupes fonctionnels tels que des hydroxylations d'acides aminés (proline en 4-hydroxyproline par la prolyl 4-hydroxylase, lysine en hydroxylysine par la lysyl hydroxylase), ainsi que des oxydations (par exemple, réticulation covalente par des résidus de lysine par la lysyl hydroxylase), Des carboxylations ou des decarboxylations et beaucoup plus. Par exemple, les glycosylations produisent des glycoprotéines, des acylations et des prénylations lipoprotéines.
Les différentes étapes des modifications sont catalysées par des enzymes particulières dont la présence est souvent limitée à des organites, des cellules ou des tissus spécifiques. De plus, la séquence des étapes de modification ou leur évolution dans le temps peuvent varier, en fonction du milieu cellulaire, de la phase de développement ou des conditions environnementales. Par exemple, la molécule de collagène subit une série de modifications post-traductionnelles, dont certaines ont lieu dans l'espace extracellulaire.
Ciblage et transport de protéines
Comme de nombreuses protéines ne ciblent pas le cytosol, mais l'espace extracellulaire, la membrane cellulaire, les organites tels que les chloroplastes, les mitochondries, les peroxysomes, le noyau cellulaire ou le réticulum endoplasmique, la cellule dispose de mécanismes différents pour transférer les protéines. Ces protéines contiennent généralement une séquence signal N- ou C-terminale, qui peut être construite de manière très différente en fonction du mécanisme cible.
Dans certains cas, il n'y a pas de séquence signal terminale, mais des signaux internes de la chaîne peptidique, qui déterminent la destination de la protéine :
- Les protéines ciblant le réticulum endoplasmique (RE) portent une séquence N-terminale spécifique qui est reconnue par un complexe protéine-ARN, la particule de reconnaissance du signal (SRP). Le complexe SRP-peptide-ribosome est ensuite recruté dans le réticulum endoplasmique où il est reconnu et lié. La traduction se poursuit à travers la membrane. Les ribosomes attachés donnent l'impression d'un "RE brut". Voir transport de protéines co-traductionnel. Le contrôle de la qualité de la protéine nouvellement synthétisée a lieu dans le réticulum endoplasmique.
- Les protéines qui doivent être délivrées aux chloroplastes ont une séquence signal N-terminale, qui est généralement phosphorylée tôt. Les protéines Hsp70, 14–3–3 et Toc64 peuvent en outre jouer un rôle dans la reconnaissance et la redirection par interaction avec le précurseur de protéine. À son arrivée à la surface du chloroplaste, le complexe précurseur de protéines est reconnu par les structures de récepteurs du translocateur Translocon Outer Chloroplast Membrane (COT). Sous hydrolyse du GTP, la protéine est ensuite importée dans l'espace intermembranaire ou directement dans le stroma par l'intermédiaire du translocateur (TIC) de la membrane interne du chloroplaste. Pour l'importation dans la membrane ou dans la lumière des thylakoïdes, on utilise au moins quatre voies, appelées dépendantes de la sec, dépendantes de la SRP, dépendantes du pH delta/de Tat ou spontanées.
- Pour les mitochondries, les cellules de levure et les cellules animales ont jusqu'à présent été décrites comme trois voies d'importation différentes :
- La voie d'importation de pré-séquence, dont les protéines portent une hélice alpha amphiphile N- terminale. Ces protéines sont principalement responsables de la matrice, de la membrane interne ou de l'espace intermembranaire.
- La voie d'importation des protéines vecteurs pour les protéines de la membrane interne portant divers signaux internes.
- La voie d'importation des protéines de l'enveloppe externe, qui est utilisée pour intégrer des protéines avec des motifs bêta-Fass. Ici aussi, il y a des signaux internes à la séquence.
En plus des séquences signal décrites ci-dessus, la glycosylation permet un ciblage en vue d'une incorporation dans la membrane cellulaire ou d'une exocytose. Les deux voies mènent généralement aux vésicules de Golgi.
En rapport avec "biosynthèse des protéines"

La biosynthèse est un phénomène dans lequel des composés chimiques complexes, tels que des protéines et des acides nucléiques, sont produits à partir...

L'expression génique (ou génétique) est le processus par lequel les informations codées par les acides nucléiques sont transformées dans les protéines...

Une protéine est un nutriment, une grosse molécule organique composée d'une chaîne de plus de 100 acides aminés avec du carbone, de l'hydrogène, de l'oxygène...

En biologie, la transcription est un processus de synthèse de l'ARN complémentaire à partir d'une matrice d'ADN.
