Pore nucléaire
Définition
Un pore nucléaire est un grand complexe de protéines qui traversent la membrane ou enveloppe du noyau, l'enveloppe nucléaire, qui est une double membrane entourant le noyau et le nucléole de la cellule, présente chez la plupart des eucaryotes. Il est encore appelé un nucléopore.
Les pores nucléaires dans l'enveloppe du noyau :
Les pores nucléaires (NPC, ou complexe de pore nucléaire en anglais) sont des complexes protéiques dans l'enveloppe nucléaire des noyaux des cellules eucaryotes. L'enveloppe nucléaire est constituée d'une double membrane. Les pores nucléaires traversent les deux membranes, agissant ainsi comme des portes et permettant le transport de certaines molécules dans et hors du noyau.
Explications
Il y a environ 3 000 à 4 000 complexes de pores nucléaires (NPC) dans l'enveloppe nucléaire d'une cellule de vertébré, mais leur nombre varie en fonction du nombre de transcrits dans la cellule. Les protéines qui composent les complexes de pores nucléaires sont connues sous le nom de nucléoporines. Près de la moitié des nucléoporines contiennent généralement une structure tertiaire alpha-solénoïde ou bêta-hélicoïdale, ou dans certains cas, des domaines protéiques distincts. L'autre moitié montre des caractéristiques structurelles typiques des protéines "nativement dépliées", par exemple, ce sont des protéines très flexibles qui n'ont pas de structure secondaire ordonnée. Ces protéines désordonnées sont les nucléoporines FG, nommées d'après leur séquence d'acides aminés contenant plusieurs répétitions du peptide phénylalanine-glycine.
Les pores nucléaires permettent le transport de molécules hydrosolubles à travers l'enveloppe nucléaire. Ce transport comprend le mouvement de l'ARN et des ribosomes du noyau vers le cytoplasme, et le mouvement des protéines (telles que les ADN polymérases et feuilles), des glucides, des molécules de signal et des lipides vers le noyau. Il est à noter que le complexe de pores nucléaires (CPN ou NPC en anglais) peut conduire activement 1 000 translocations par complexe par seconde. Bien que les petites molécules passent à travers la simple diffusion à travers les pores, les molécules plus grandes peuvent être reconnues par des séquences signal spécifiques et ensuite se propager à l'aide de nucléoporines vers ou depuis le noyau. C'est ce qu'on appelle le cycle RAN. Chacune des huit sous-unités protéiques qui entourent le vrai pore (l'anneau externe) projette une protéine radio-formée dans le canal poreux. Le centre du pore semble souvent avoir une structure similaire à un bouchon. On ne sait pas encore si cela correspond à un bouchon réel ou s'il est simplement piégé pendant le transport.
Transport à travers le complexe de pores nucléaires
Les petites particules (moins de 50 kDa) sont capables de traverser le complexe des pores nucléaires par diffusion passive. Des particules plus grosses peuvent également traverser le grand diamètre du pore, mais à des taux presque négligeables. Un passage efficace à travers le complexe nécessite plusieurs facteurs protéiques. La simplicité du transport à travers les pores nucléaires est facilitée par des récepteurs dans les domaines FG appelés karyophérines (une caryophérine), qui sont nécessaires pour le transport nucléo-cytoplasmique de molécules de plus de 40 kDa. En l'absence de ces récepteurs, en abrégé Kaps, les domaines FG imposent une barrière physique qui empêche le passage des macromolécules à travers le pore nucléaire. Les karyophérines, qui peuvent agir comme des importines ou des exportines, font partie de la super famille des importateurs qui partagent dans leur intégralité une structure tridimensionnelle similaire.
Trois modèles ont été suggérés pour expliquer les mécanismes de translocation :
Importation de protéines solubles
Toute particule portant un signal de localisation nucléaire (NLS) sera dirigée par un transport rapide et efficace à travers le pore. De nombreux signaux de localisation nucléaire sont connus, contenant généralement une séquence d'acides aminés conservée avec des résidus basiques tels que PKKKRKV. Tout matériel ayant un signal de localisation nucléaire sera transporté par les importines vers le noyau.
Le schéma classique pour l'importation de particules avec un signal de localisation nucléaire commence d'abord par l'a-importine joignant la séquence du signal de localisation nucléaire, et agit comme un pont pour lier la ß-importine. Ensuite, le complexe charge-ß-importine-α-importine est dirigé vers le pore nucléaire et diffuse à travers celui-ci. Une fois que le complexe est dans le noyau, RanGTP se lie à l'import et le déplace du complexe. Ensuite, la protéine de susceptibilité à l'apoptose cellulaire (CAS), une exportine liée au RanGTP dans le noyau, sépare l'a-importine de la charge. La protéine signal de localisation nucléaire est ainsi libre dans le nucléoplasme. Les complexes ßimportin-RanGTP et αimportin-CAS-RanGTP diffusent dans le cytoplasme où les GTP sont hydrolyses en GDP, ce qui conduit à la libération de ß-importine et α-importine qui est de nouveau disponible pour une nouvelle importation de protéines signal de localisation nucléaire.
Bien que la charge passe à travers le pore avec l'aide de protéines chaperons, la translocation à travers le pore ne dépend pas en soi de l'énergie. Cependant, le cycle d'importation complet nécessite l'hydrolyse de 2 GTP et est donc dépendant de l'énergie et doit être considéré comme un transport actif. Le cycle d'importation fonctionne grâce au gradient de RanGTP noyau cytoplasmique. Ce gradient provient de la localisation nucléaire exclusive des RANGEF, protéines qui transforment le GDP en GTP dans les molécules Ran. Par conséquent, il y a une forte concentration de RanGTP dans le noyau par rapport au cytoplasme.
Exportation de protéines
Certaines molécules nucléaires doivent être exportées du noyau vers le cytoplasme, comme les sous-unités ribosomales et les ARN messagers. Par conséquent, il existe un mécanisme d'exportation similaire à celui de l'importation.
Dans le schéma d'exportation classique, des protéines avec une séquence d'exportation nucléaire (NES) peuvent être liées dans le noyau pour former un complexe hétérotrimérique avec un exportin et un RanGTP (par exemple l'export dans CRM1). Le complexe peut diffuser dans le cytoplasme où le GTP est hydrolysé et la protéine de séquence d'exportation nucléaire est libérée. Le complexe CRM1-RanGDP diffuse vers le coeur où le PIB est changé en GTP par les RanGEF. Ce processus dépend également de l'énergie puisqu'il consomme du GTP. L'exportation avec CRM1 peut être inhibée par la leptomycine C.
Synonymes, antonymes
Voir tous les synonymes pour "pore nucléaire".1 synonyme (sens proche) de "pore nucléaire" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PORE NUCLÉAIRE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression PORE NUCLEAIRE est dans la page 7 des mots en P du lexique du dictionnaire.
Mots en P à proximité
population génétiquement pure population halieutique population monosexe population moyennepopulation témoinpore nucléaireporicide porifère porine porocyte porogamie
En rapport avec "pore nucléaire"

L'enveloppe nucléaire des cellules eucaryotes est une membrane double qui fournit la structure au noyau avec l'ADN et le sépare du cytoplasme.
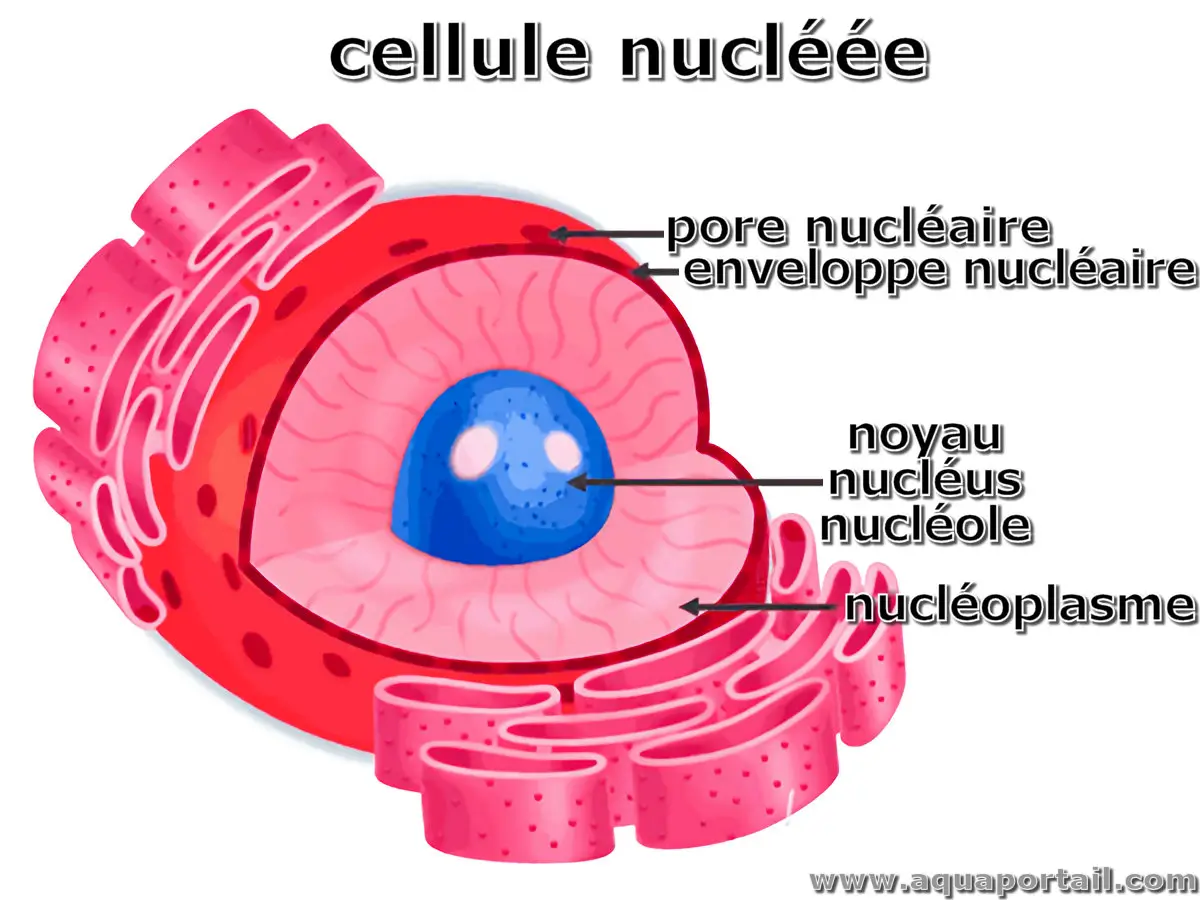
Ce qui est nucléé possède un ou plusieurs noyaux, des nucléus. En biologie, des cellules sont uninucléées quand elles ont un seul noyau, ou plurinucléées avec...

Le nucléoplasme, centroplasme ou caryoplasme, est une zone, souvent centrale, du cytoplasme des procaryotes, contenant le génome (cette zone est parfois nommée...
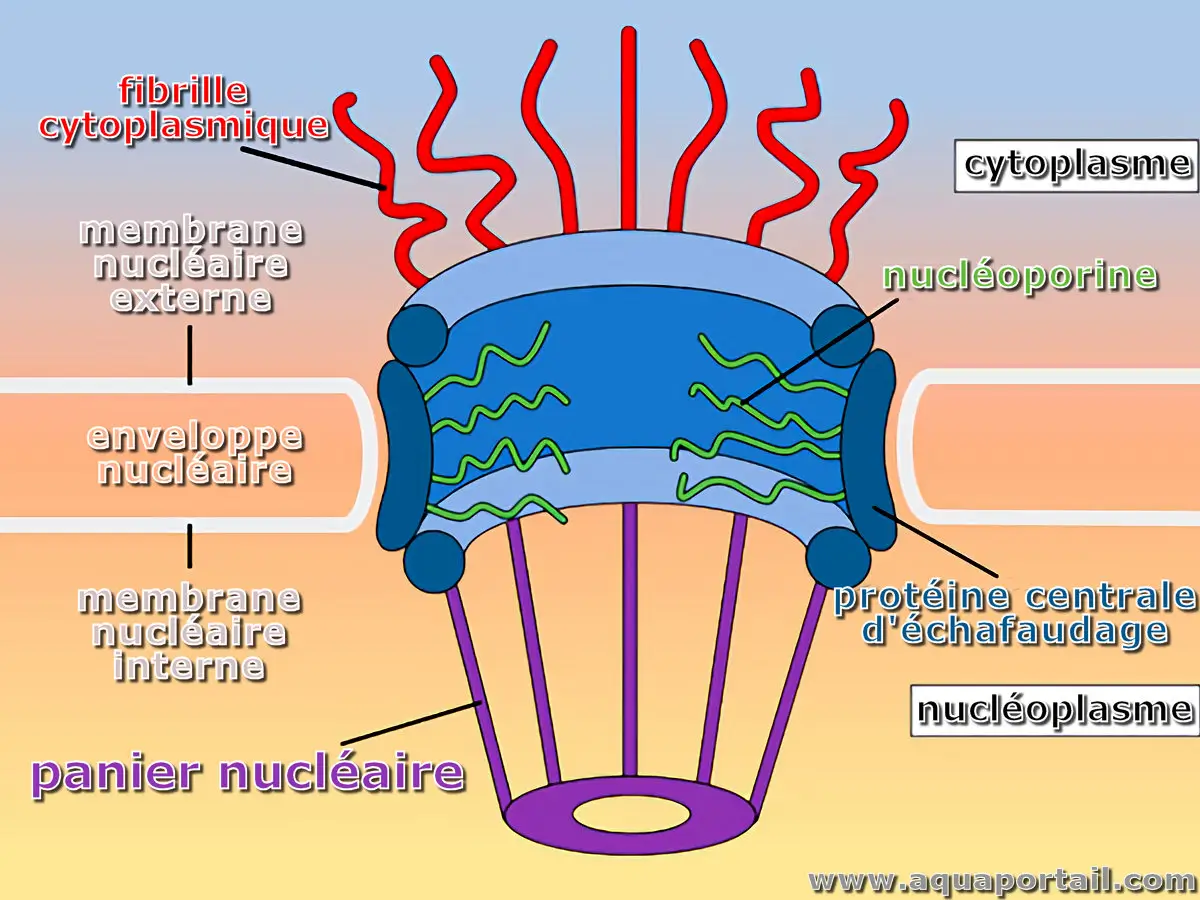
Un nucléopore identifie chacun des pores de l'enveloppe nucléaire offrant passage aux molécules qui doivent transiter entre le nucléoplasme et le cytoplasme...
