Glycoprotéine
Définition
Une glycoprotéine est une hétéroprotéine comportant une partie peptidique liée de façon covalente à une partie glucidique avec du carbone. Les glycoprotéines sont des molécules composées d'une protéine liée à un ou plusieurs hydrates de carbone, simples ou composés.
Des sucres dans les glycoprotéines :
Les glycoprotéines (ou glucoprotéines) ont des sucres dont voici les formules structurales. La reconnaissance structurelle et cellulaire se distingue parmi d'autres fonctions lorsqu'elles sont présentes à la surface des membranes plasmiques (glycocalyx).
Explications
Une glycoprotéine est une protéine intégrée à une ou plusieurs chaînes glucidiques, également appelées oligosaccharides, liées de manière covalente par un processus appelé glycosylation. Ces molécules sont indispensables à de nombreuses fonctions biologiques, telles que la reconnaissance cellulaire, l'immunité, la signalisation et le maintien de la structure tissulaire. Les glycoprotéines sont présentes dans tout l'organisme, notamment dans les membranes cellulaires, le mucus, les hormones et les enzymes, et jouent un rôle essentiel dans des processus tels que la détermination des groupes sanguins et les infections virales.
Des glycoprotéines spécifiques intégrées aux membranes des globules rouges définissent le groupe sanguin d'un individu.
D'abréviation "gp", une glycoprotéine est un composé résultant de l'association d'une protéine et d'un groupement prosthétique glucidique. La plupart des protéines membranaires et solubles (excepté les protéines cytosoliques) sont glycosylées.
Le terme glycoprotéine est généralement utilisé pour désigner une molécule de dimensions spécifiques, habituellement composée d'un ou plusieurs oligosaccharides liés de manière covalente à des chaînes latérales spécifiques de polypeptides; elle est alors parfois appelée un glycopeptide. Elles ont tendance à avoir un pourcentage plus élevé de protéines que d'hydrates de carbone.
Les termes protéoglycane et peptidoglycane désignent des agrégats massifs formés par des hydrates de carbone et des protéines ou des septième peptides, pour lesquels le mot molécule n'a pas de signification précise. Les particules de protéoglycane ont un pourcentage plus élevé de glucides que les protéines.
Voir aussi une mucoprotéine et le collagène.
Les informations structurelles des hormones glycoprotéiques ont d'abord été obtenues à partir de la gonadotrophine chorionique humaine (hCG). De nombreuses hormones et enzymes biologiquement actives sont des glycoprotéines, ce qui souligne leur rôle multifonctionnel dans l'organisme.
Caractéristiques
Les glycoprotéines existent dans tous les types d'organismes, bien qu'elles prévalent surtout dans les fluides et dans les cellules des animaux, dans lesquels ils ont de nombreuses fonctions. Elles sont très répandus dans les membranes cellulaires ou en association en tant que composants de la couverture de surface. Par exemple, voir l'extensine de la paroi cellulaire des végétaux.
Fonction
Les glycoprotéines servent de marqueurs distincts à la surface des cellules, facilitant leur identification et leurs interactions. Ces molécules sont des composants clés du système immunitaire, permettant aux globules blancs de détecter et de réagir aux molécules étrangères.
Plusieurs hormones sont les glycoprotéines, les anticorps, diverses enzymes, les protéines réceptrices, les protéines d'adhésion cellulaire, les facteurs de croissance, les protéines de reconnaissance cellulaire, les protéines conférant les caractéristiques des groupes sanguins, les protéines conférant une stabilité structurelle aux assemblages plurimoléculaires, etc.
Il est logique de se demander quelle serait la raison de la présence du glucide. Une proposition est que la fixation des sucres à une protéine est le marqueur chimique avec lequel les protéines destinées à être utilisées à l'extérieur de la cellule ou dans le réseau membranaire de la cellule sont identifiées. Ainsi, les protéines qui seront conservées et utilisées dans le cytoplasme de la cellule ne sont pas glycosylées.
Structure
La base d'une glycoprotéine est la molécule protéique elle-même. De courtes chaînes glucidiques ramifiées (oligosaccharides) sont attachées à la structure protéique.
Le processus enzymatique de glycosylation lie les chaînes glucidiques au noyau protéique.
En tant que groupe, les glycoprotéines manifestent de grandes différences dans leur teneur en hydrates de carbone, qui va de moins de 1 % à 80 % du poids total. Ceux qui ont plus de 4 % de glucides sont parfois appelés mucoprotéines parce qu'ils ont une viscosité élevée. La liaison covalente avec le peptide est réalisée par une liaison glycosidique avec la chaîne latérale des résidus sérine, thréonine ou asparagine.
Les groupes oligosaccharidiques liés au groupe -OH de la sérine et de la thréonine sont appelés 'O-linked', tandis que ceux fixés au groupe amide -NH2 de l'asparagine sont appelés 'N-linked'. Le nombre de groupes d'oligosaccharides par molécule de protéine est variable, mais tous les groupes de la molécule sont habituellement identiques.
Les sucres les plus courants dans ces oligosaccharides sont le D-galactose, le D-glucose, le D-mannose, le L-fucose, la N–cétyl-D-glucosamine, etc.
Reconnaissance cellulaire
Les groupes sanguins dépendent du type de glycoprotéine que contient la membrane érythrocytaire; le groupe A a comme oligosaccharide une chaîne de N–cétylgalactosamine, alors que le groupe B a une chaîne galactose, et par conséquent, le groupe AB présente les deux types de glycoprotéines et le groupe 0 en manque à la fois.
Pour déterminer le groupe sanguin, on utilise des antisérums, qui contiennent des anticorps qui reconnaissent un certain type de glycoprotéine (l'antisérum A reconnaît la glycoprotéine A). La connaissance du groupe sanguin est importante pour effectuer des transfusions et éviter la formation de caillots qui provoquent des infarctus cérébraux et des thromboses mortels.
Les glycoprotéines aident les cellules à se lier entre elles, ce qui est essentiel à la formation et à l'intégrité des tissus. Elles contribuent à la stabilisation des protéines et à l'amélioration de la résilience et de la durabilité des tissus. En tant que composants du mucus, les glycoprotéines protègent les organes en piégeant les contaminants et en réduisant les frottements.
Elles participent à la communication intercellulaire et aux voies impliquées dans la signalisation cellulaire. Toutefois, les virus exploitent les glycoprotéines pour adhérer aux cellules hôtes et les envahir.
Synonymes, antonymes
Voir tous les synonymes pour "glycoprotéine".4 synonymes (sens proche) de "glycoprotéine" :
- glucoprotéine
- glycopeptide
- mucoprotéine
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à GLYCOPROTÉINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot GLYCOPROTEINE est dans la page 3 des mots en G du lexique du dictionnaire.
Mots en G à proximité
glycolipide glycolyse glycopeptide glycophorineglycophyte glycoprotéineglycoprotéique glycosaminoglycane glycosidase glycoside glycosylation
En rapport avec "glycoprotéine"

Une hétéroprotéine, au contraire d'une holoprotéine, est une molécule constituée d'une protéine (apoprotéine) et d'une partie non protéique appelée groupement...

Une apolipoprotéine est une protéine qui contient et transporte des lipides dans le sang. Elle est une hétéroprotéine amphipathique avec un groupe...
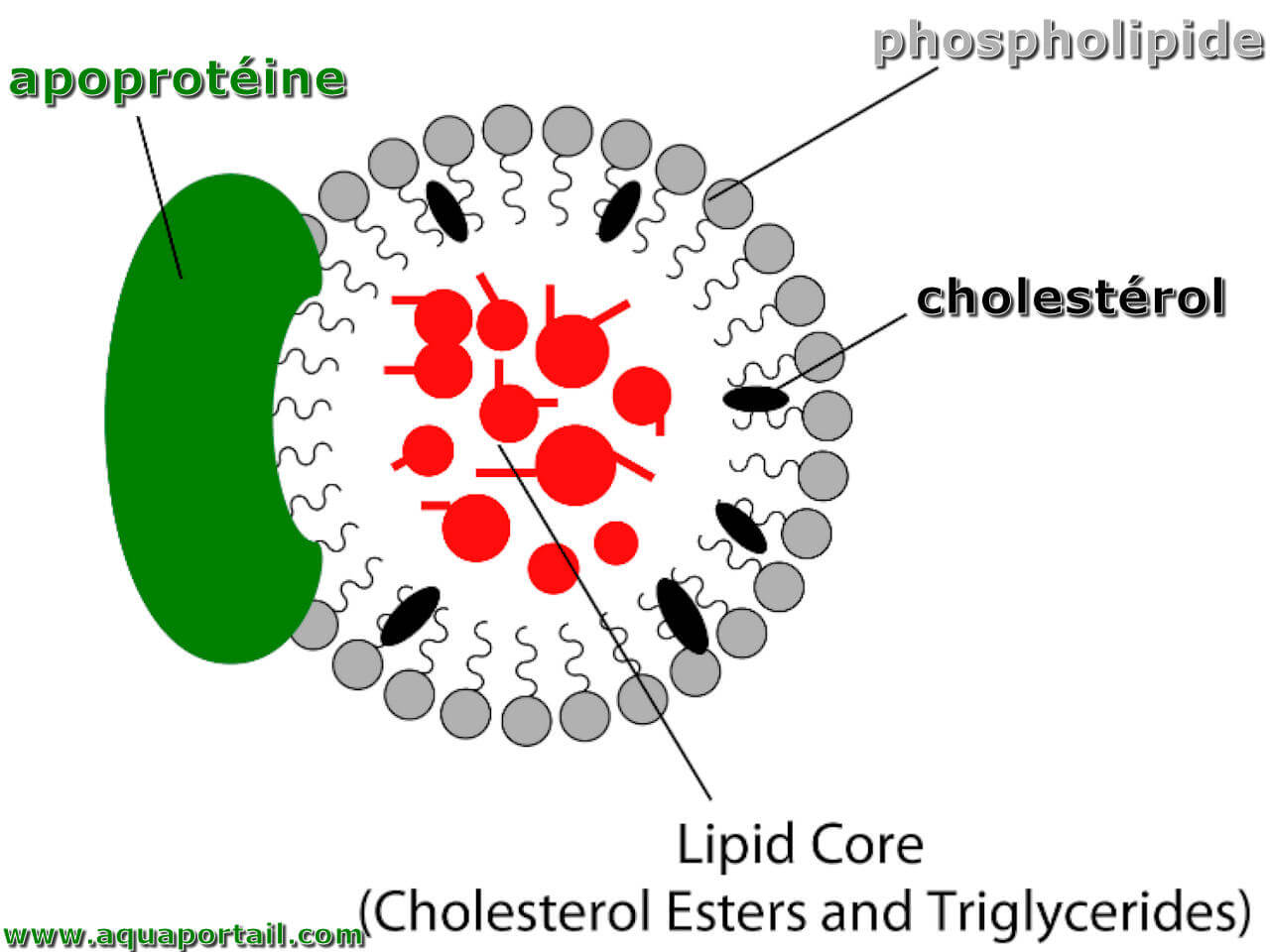
Une apoprotéine est une partie protéique d'une hétéroprotéine, associée au groupement prosthétique pour former la protéine fonctionnelle.

Une chromoprotéine est une hétéroprotéine dont le groupement prosthétique lui confère une couleur donnée.
