Sesquiterpène
Définition
Un sesquiterpène est un terpène de formule C15H24 constitué de trois unités isoprènes C5H8. Les sesquiterpènes constituent le deuxième groupe le plus important de composés actifs dans les huiles essentielles de plantes.
La cyclisation des sesquiterpènes :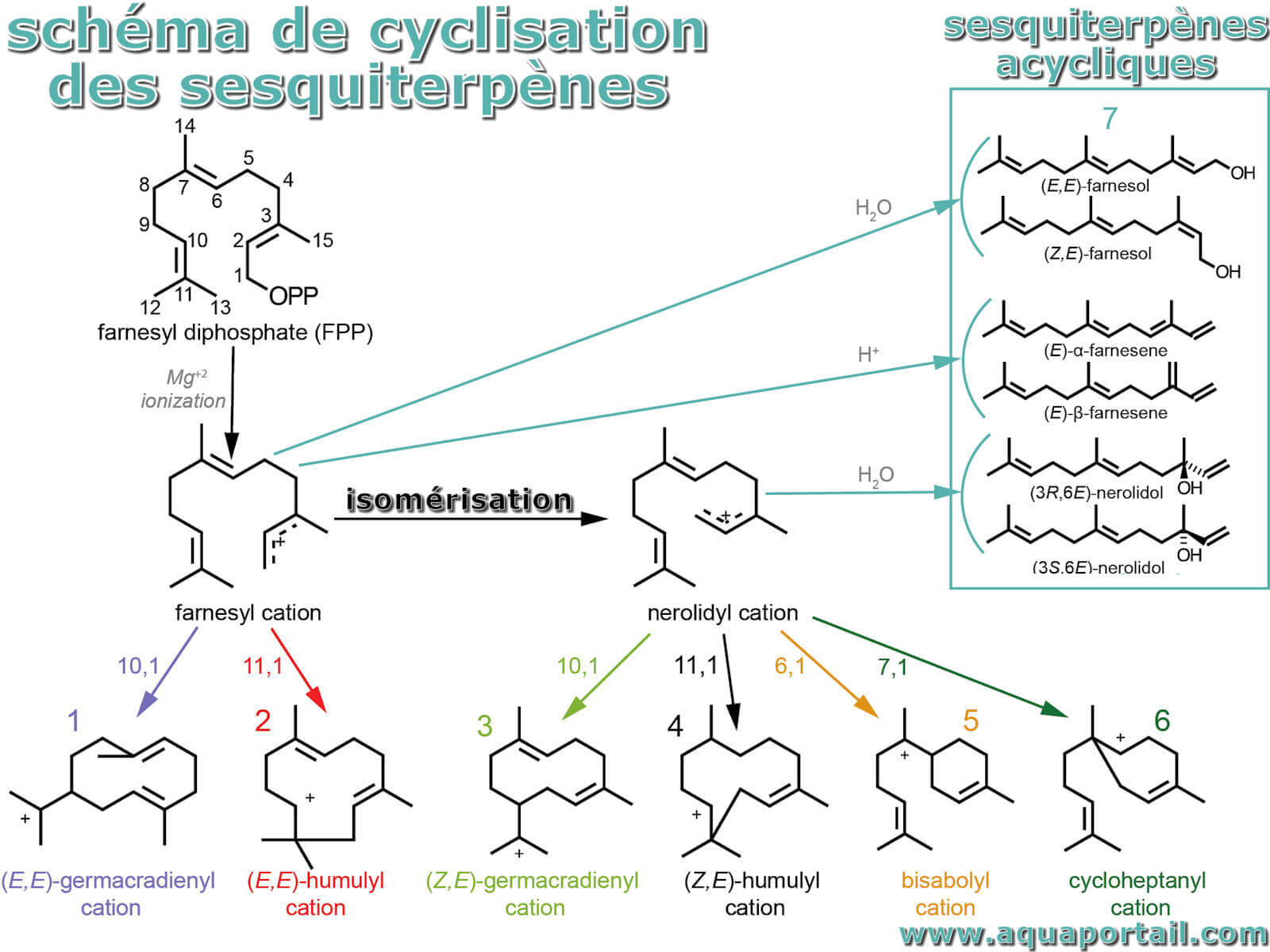
Les synthases sesquiterpéniques (STS) dans les plantes catalysent la formation d'une vaste gamme de sesquiterpènes, des composés chimiques en C15 fabriqués à partir d'unités d'isoprène en C5. La cascade de réaction d'un STS est initiée par l'élimination à médiation métallique de l'anion diphosphate dans le substrat FPP, conduisant à la formation d'un cation transoïde (2ème, 6ème)-farnésyle (cation farnésyle) qui, en raison de sa structure contrainte, peut subissent une cyclisation uniquement au niveau de sa double liaison C10-C11 conduisant aux cations 1 ou 2
Explications
Les sesquiterpènes sont une sous-classe de terpènes qui ont été décrits pour afficher une large gamme d'activités biologiques et pharmaceutiques qui incluent des effets sur le système nerveux central, des actions antimicrobiennes et antitumorales.
Les sesquiterpènes, comme tant d'autres classes de terpènes et d'autres produits naturels, ont suscité un intérêt considérable en raison des rôles qu'ils jouent dans les systèmes biologiques et de leur utilité pour les usages humains. Cependant, l'une des caractéristiques qui distinguent les sesquiterpènes de la plupart des autres familles de produits naturels est les milliers de composés sesquiterpènes différents qui ont été identifiés.
Les sesquiterpènes sont moins volatils que les terpènes, ont un plus grand potentiel de diversité stéréochimique et ont des odeurs plus fortes. Voir le farnésène.
Comme les monoterpènes, de nombreux sesquiterpènes sont présents dans les huiles essentielles. En outre, de nombreux sesquiterpènes agissent en tant que phytoalexines, composés antibiotiques produits par les plantes en réponse à l'apparition de microbes, et en tant qu'inhibiteurs alimentaires des herbivores opportunistes. L'hormone végétale appelée acide abscissique est structurellement un sesquiterpène, son précurseur à 15 carbones, la xanthosine, n'est pas synthétisée directement à partir de 3 unités d'isoprène mais est produite par le clivage asymétrique d'un caroténoïde à 40 unités.
La source de cette diversité se présente de deux manières. Le premier est la diversité structurelle qui apparaît dans l'assemblage des squelettes à 15 carbones constituant l'épine dorsale de tous les sesquiterpènes. La deuxième source de diversité est due à la superposition de groupes fonctionnels et de substituants sur les échafaudages structuraux de manière régiospécifique et stéréospécifique distincte.
La complexité structurelle des sesquiterpènes est facilement illustrée par ce qui semble initialement être une structure simple. Le capsidiol, un sesquiterpénoïde de type érémophilane isolé pour la première fois du poivre, Capsicum annum, contient deux substituants hydroxyle. D'où le nom trivial de capsidiol. Cependant, il est plus important de noter la complexité inhérente à cette structure. Pour un composé à 15 carbones ou C15, le capsidiol contient cinq centres chiraux et trois substituants différents (groupes hydroxyle, méthyle et isopropényle) disposés précisément (régio- et stéréospécifiquement) autour d'un échafaudage bicyclique. Ce que nous avons l'intention de suggérer dans ce chapitre, c'est que si nous pouvons vraiment comprendre les mécanismes responsables de la biosynthèse de molécules comme le capsidiol, alors nous devrions être capables de modifier ces enzymes afin qu'elles produisent, par exemple, la stéréochimie inversée du substituant méthyle C14, ou modifier le positionnement régiochimique ou stéréochimique de l'hydroxyle en C1, créant ainsi de nouvelles molécules, qui peuvent avoir des avantages pour les organismes qui les produisent ainsi que des applications artificielles.
Diversité
Les sesquiterpènes font partie des familles de produits naturels les plus répandues, les plus étudiées et les mieux comprises, du point de vue de la chimie, de la biochimie et de l'origine biologique. Plus de 300 squelettes carbonés sesquiterpéniques distincts ont été identifiés à ce jour, et des milliers de dérivés naturels oxydés ou autrement modifiés ont été isolés à partir de sources marines, terrestres et microbiennes.
Ces métabolites présentent un large éventail de propriétés physiologiques, notamment des activités antibiotiques, antitumorales, antivirales, cytotoxiques, immunosuppressives, phytotoxiques, antifongiques, antiappétantes pour les insectes et hormonales. De nombreux hydrocarbures sesquiterpènes, alcools et métabolites dérivés trouvés dans les huiles essentielles végétales sont également très appréciés pour leurs caractéristiques d'odeur et de saveur souhaitables.
Il est remarquable que toutes ces substances soient dérivées d'un seul précurseur acyclique, le farnésyl diphosphate (FDP) ou le farnésyl-pyrophosphate (FPP).
Biosynthèse
La biosynthèse des sesquiterpènes a fait l'objet d'une revue détaillée publiée en 1981 couvrant toutes les expériences importantes d'incorporation de précurseurs classiques qui avaient été menées jusqu'à cette époque.2 Depuis lors, le développement majeur a été l'isolement de nombreuses synthases sesquiterpéniques, leur purification et caractérisation ultérieures, et le clonage, le séquençage et l'expression éventuels de leurs gènes structuraux correspondants.
Une revue de 1985 a décrit des méthodes d'isolement et de dosage des synthases sesquiterpènes et monoterpènes et une revue de 1990 a détaillé ce que l'on savait alors sur les mécanismes de formation enzymatique des sesquiterpènes.
En 1995, la génétique de la biosynthèse des antibiotiques isoprénoïdes a également été revue. Au milieu des années 1980, une théorie stéréochimique détaillée des cyclisations des sesquiterpènes a été articulée. La biosynthèse des terpènes a également été revue régulièrement. Cette revue porte principalement sur la littérature depuis 1980.
Sesquiterpènes hétérocycliques
Les sesquiterpènes hétérocycliques constituent une grande classe de sesquiterpènes naturels, avec plus de 500 représentants. L'examen actuel fournit une étude complète des sesquiterpènes hétérotricycliques non halogénés (NH-HTSQT) qui ont été isolés de la zone marine.
Les enregistrements (1968–2015) ont considérés les terpénoïdes hétérotricycliques, dérivés de sesquiterpènes monocycliques ou bicycliques, par une fermeture de cycle de lactones, époxydes, furanes, éthers. Un total de 164 composés et 137 références sont enregistrés pour les systèmes fusionnés dérivés du cadinane, de l'érémophilane, du drimane, du nardosinane, de la microcionine, de la furodysine et des sesquiterpénoïdes apparentés collectés dans la première partie de cette revue complète. Ces métabolites secondaires sont organisés en sections selon des familles structurales de composés.
La caractérisation structurale, la biogenèse et l'activité biologique ont été proposés. Comparés aux sesquiterpènes carbocycliques non halogénés, les NH-HTS présentent souvent des activités biologiques et pharmacologiques différentes. Ils ont entre autres des propriétés antiappétantes, anti-infectieuses, immunosuppressives et cytotoxiques.
Cyclase sesquiterpénique
Les cyclases sesquiterpéniques catalysent la conversion du FPP (farnésyl pyrophosphate) en une variété de terpénoïdes C15. À ce jour, plus de 200 structures différentes ont été isolées à partir de diverses sources. Le FPP est le substrat des cyclases sesquiterpéniques et la cyclisation peut intervenir au niveau de la double liaison proximale C-6 – C-7 ou distale C-10 – C-11. La cyclisation au niveau de la double liaison distale génère une structure macrocyclique qui s'adaptera à la stéréochimie de la double liaison C-2 – C-3 dans le FPP sans avoir besoin d'une activité isomérase couplée.
Cependant, comme les monoterpènes cyclases, la cyclisation vers la double liaison proximale ne peut intervenir qu'après que la sesquiterpène cyclase catalyse l'isomérisation du FPP en son isomère allylique nérolidyl diphosphate (NPP). Une attaque électrophile des cations allyliques résultants de FPP au niveau de la double liaison distale (voies a et b) ou NPP au niveau de la double liaison centrale (voies c et d), est suivie de cyclisations et de réarrangements supplémentaires, et finalement d'une extinction avec perte d'un proton ou capture par un nucléophile, donne naissance à la grande variété de sesquiterpènes.
Synthase sesquiterpénique
Les synthases sesquiterpéniques nécessitent généralement l'ion métallique divalent Mg2+ comme cofacteur, avec une activité maximale allant de 0,01 à 100 mM. D'autres ions métalliques tels que Mn2+, Ni2+ et Co2+ peuvent se substituer à Mg2+ et affecter la spécificité et la cinétique du produit, bien que Mg2+ soit généralement accepté comme cofacteur physiologique.
Il a été démontré que d'autres métaux tels que K+ affectent profondément l'efficacité catalytique de certaines synthases sesquiterpéniques. Comme point de départ, des dosages peuvent être effectués à l'aide de 20 mM Mg2+ et, si désiré, les concentrations optimales d'ions Mg2+ peuvent être déterminées en établissant le kcat apparent à différentes concentrations d'ions métalliques (de 10 μM à 20 mM). Une analyse cinétique plus rigoureuse dans des conditions alternatives peut être justifiée pour mesurer les paramètres cinétiques et les constantes de liaison au métal.
Activité antivirale (grippe)
Des sesquiterpènes spécifiques des rhizomes de Curcuma wenyujin possèdent une efficacité antivirale selon des preuves récentes en référence au contrôle de la grippe. Cette pandémie récurrente a été traitée ou prévenue avec des analgésiques, des vaccins annuels, des antibiotiques éventuels dans les cas graves et d'autres recommandations cliniques de base. Les antiviraux, une famille de médicaments en croissance rapide, sont également présents dans de nombreuses espèces végétales dont Curcuma wenyujin est un ajout récent en ce qui concerne les composés individuels.
Cette découverte a été inspirée par l'utilisation traditionnelle chinoise d'Ezhu contre les maladies pulmonaires éventuellement causées par les virus de la grippe. Les anciens médecins ignoraient que les microbes et les virus existaient, bien sûr, mais connaissaient bien les symptômes. Parmi une série de sesquiterpènes de rhizome connus et nouveaux, les composés 190–192 ont montré la meilleure perspective in vitro contre le virus de la grippe A/H1N1 (Guangdong, 2006) qui a suscité une alerte mondiale en 2009–2010 : IC50 = 9,2, 6,8 et 12,8 μM, respectivement, soit 2,4, 1,8 et 3,4 μg/mL. La cytotoxicité contre les cellules rénales de chien (cellules MDCK, Madin-Darby canine Kidney) normales n'était que modérée.
D'autres développements sur l'expansion à d'autres virus et le mécanisme biochimique impliqué sont attendus dans un proche avenir.
Agents antiparasitaires
Les sesquiterpènes sont des agents antimicrobiens représentés par les artémisinines, l'artéméther, la dihydroartémisinine, l'artééther et l'artésunate. Ces agents réagissent avec le fragment hème, causant des dommages des radicaux libres aux membranes des parasites. Les artémisinines sont les plus actifs des composés antipaludiques disponibles et produisent une réduction fractionnée de la biomasse parasitaire d'environ 104 par cycle asexué.
Les artémisinines sont efficaces contre les formes à petits anneaux, ainsi que contre les schizontes en maturation des deux plasmodium vivax et Plasmodium falciparum, qui sont des stades moins sensibles aux quinoléines ou à la quinine. Les formes annulaires de stade précoce sont immédiatement éliminées (dans les 6 à 12 heures) après exposition aux artémisinines. Les dérivés d'artémisinine présentent également l'avantage de réduire le portage des gamétocytes et donc la transmission. Ces agents sont très efficaces lorsqu'ils sont utilisés en association avec la méfloquine, l'halofantrine ou la luméfantrine dans le traitement du paludisme grave, y compris celui causé par Plasmodium falciparum. Les traitements combinés à base d'artémisinine sont désormais considérés comme la meilleure thérapie pour le paludisme à falciparum, combinant des composés non apparentés avec différentes cibles moléculaires (et donc différents mécanismes potentiels de résistance), retardant l'émergence de résistances. La résistance aux artémisinines a été associée à des modifications d'un seul acide aminé dans le domaine kelch de la protéine K13, entraînant des altérations du développement cellulaire et de la protéostase. L'efficacité apparente de l'association méfloquine-artésunate dans le traitement d'une infection helminthique telle que la schistosomiase est intéressante.
Coumarine
La coumarine sesquiterpénique est un petit groupe dans une famille de produits naturels à base de plantes. Il a été isolé de Ferula (Apiaceae), Daucus (Apiaceae), Heptaptera (Apiaceae), Dorema (Apiaceae), Artemisia (Asteraceae), Achillea (Asteraceae), Tanacetum (Asteraceae), Anthemis (Asteraceae), Brocchia (Asteraceae), Euphorbia (Euphorbiaceae), Jatropha (Euphorbiaceae) et Aegle (Rutaceae). En particulier, la coumarine sesquiterpène est la composition bioactive caractéristique des herbes du genre Ferula. Environ 181 coumarines sesquiterpéniques ont été signalées au cours des 35 dernières années, parmi lesquelles 135 ont été identifiées du genre Ferula.
Sa structure est généralement composée d'un fragment sesquiterpène et d'un cadre coumarinique. L'unité de coumarine est constituée d'umbelliférone (7-hydroxycoumarine), de scopolétine (7-hydroxy-6-méthoxycoumarine) ou d'isofraxidine (7-hydroxy-6,8-diméthoxycoumarine), tandis que le fragment sesquiterpène se présente sous forme de sesquiterpènes acycliques ou de sesquiterpènes cycliques. Et la première classification de la coumarine sesquiterpène a été établie sur la base de la connexion différente (C-C ou C-O) entre les unités sesquiterpène et coumarine incorporées dans la structure moléculaire de base. Et la deuxième classification est effectuée par la différence de structure des fractions coumarines.
Jusqu'à présent, diverses bioactivités et effets pharmacologiques des coumarines sesquiterpéniques ont été rapportés, notamment antitumoraux, anti-inflammatoires, antibactériens, antivirus, antiparasitaires et antiulcéreux.
Synonymes, antonymes
Voir tous les synonymes pour "sesquiterpène".1 synonyme (sens proche) de "sesquiterpène" :
3 antonymes (sens contraire) :
Les mots ou les expressions apparentés à SESQUITERPÈNE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot SESQUITERPENE est dans la page 2 des mots en S du lexique du dictionnaire.
Mots en S à proximité
sérum sanguin sérumalbumine serval service écosystémique sésamoïde sesquiterpènesesquiterpénique sesquizygote sessile seston seta
En rapport avec "sesquiterpène"
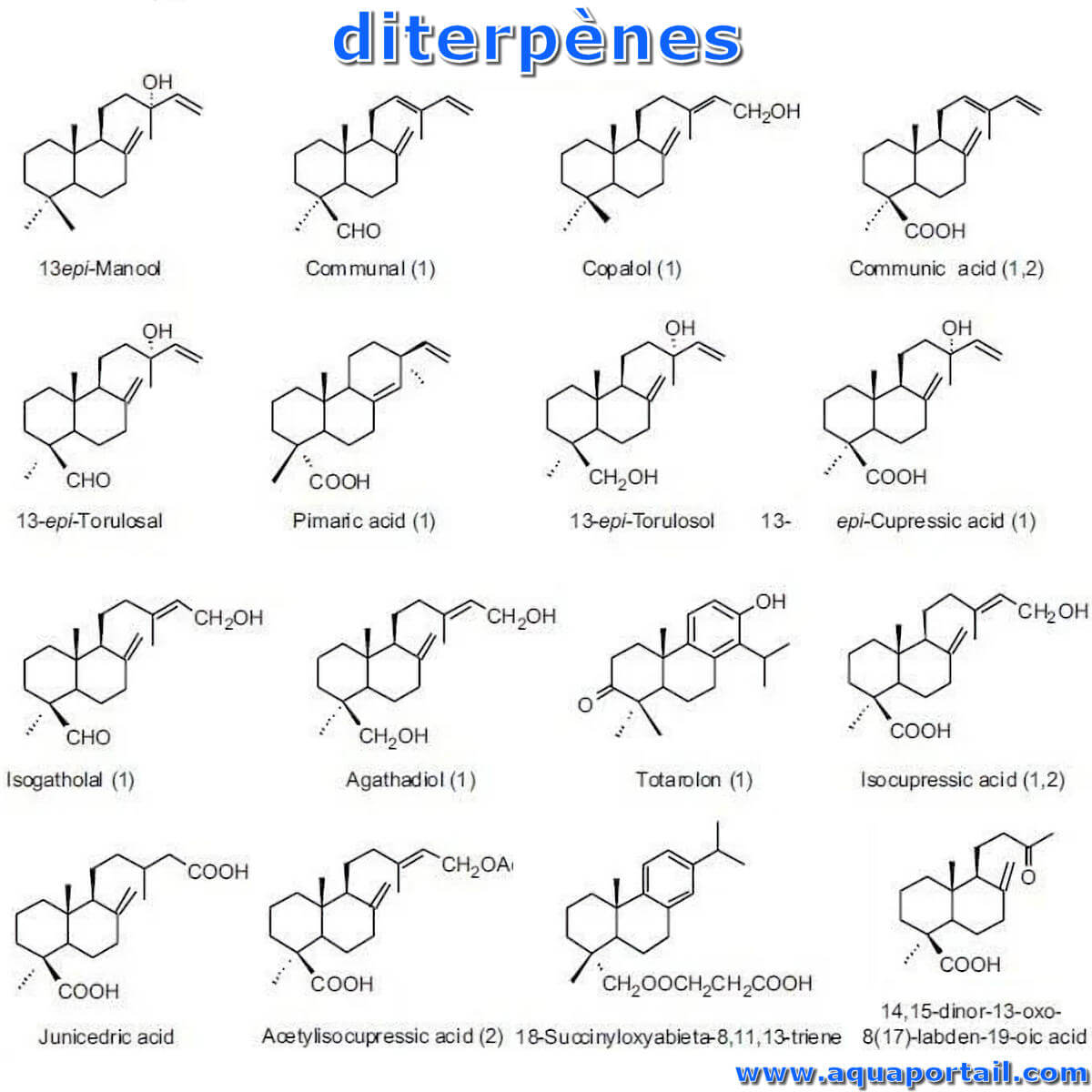
Le diterpène est un terpène composé de quatre groupes isoprène et a un point d'ébullition plus élevé.
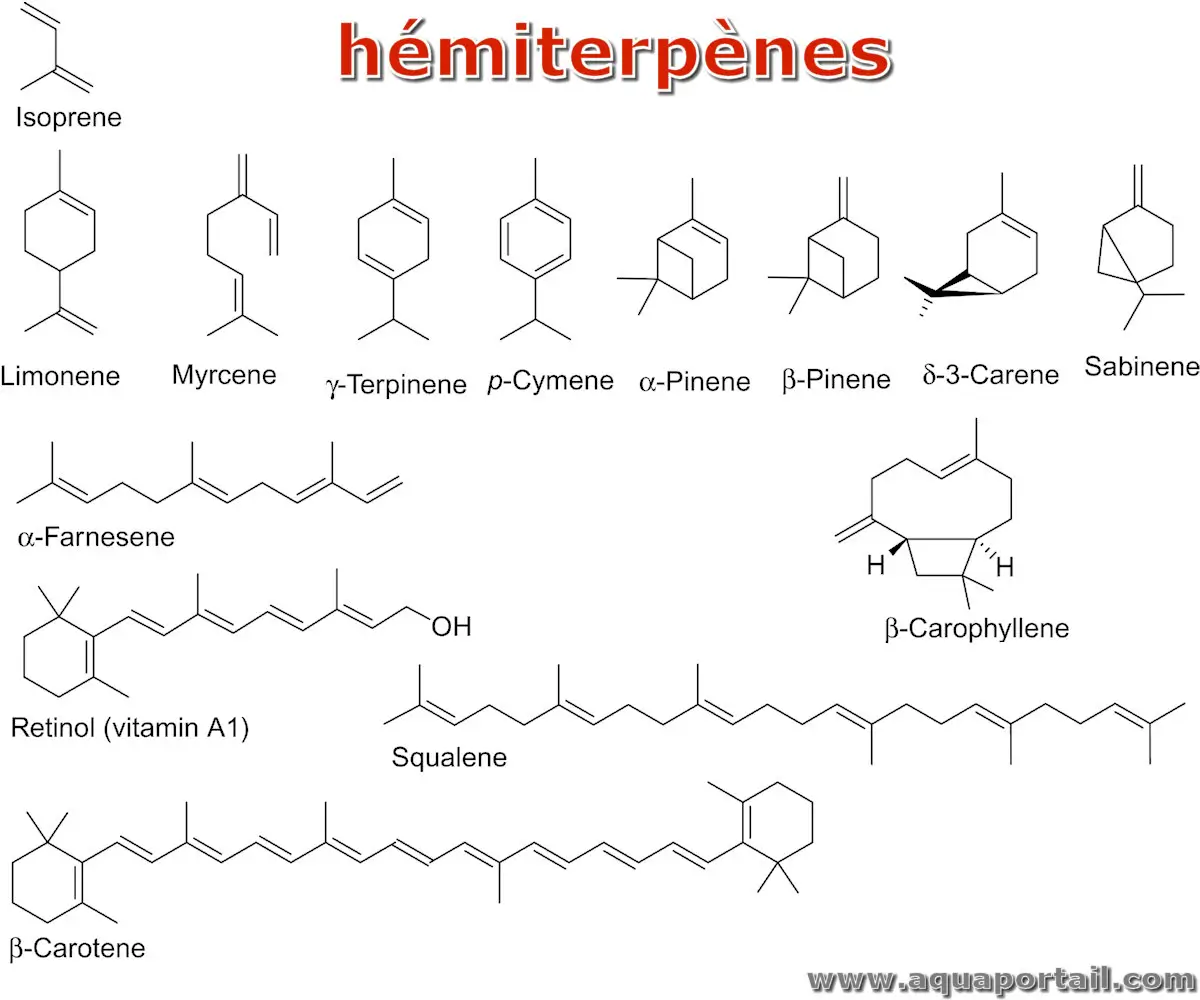
Un hémiterpène est le terpène le plus simple et moins d'une centaine de composés sont connus.
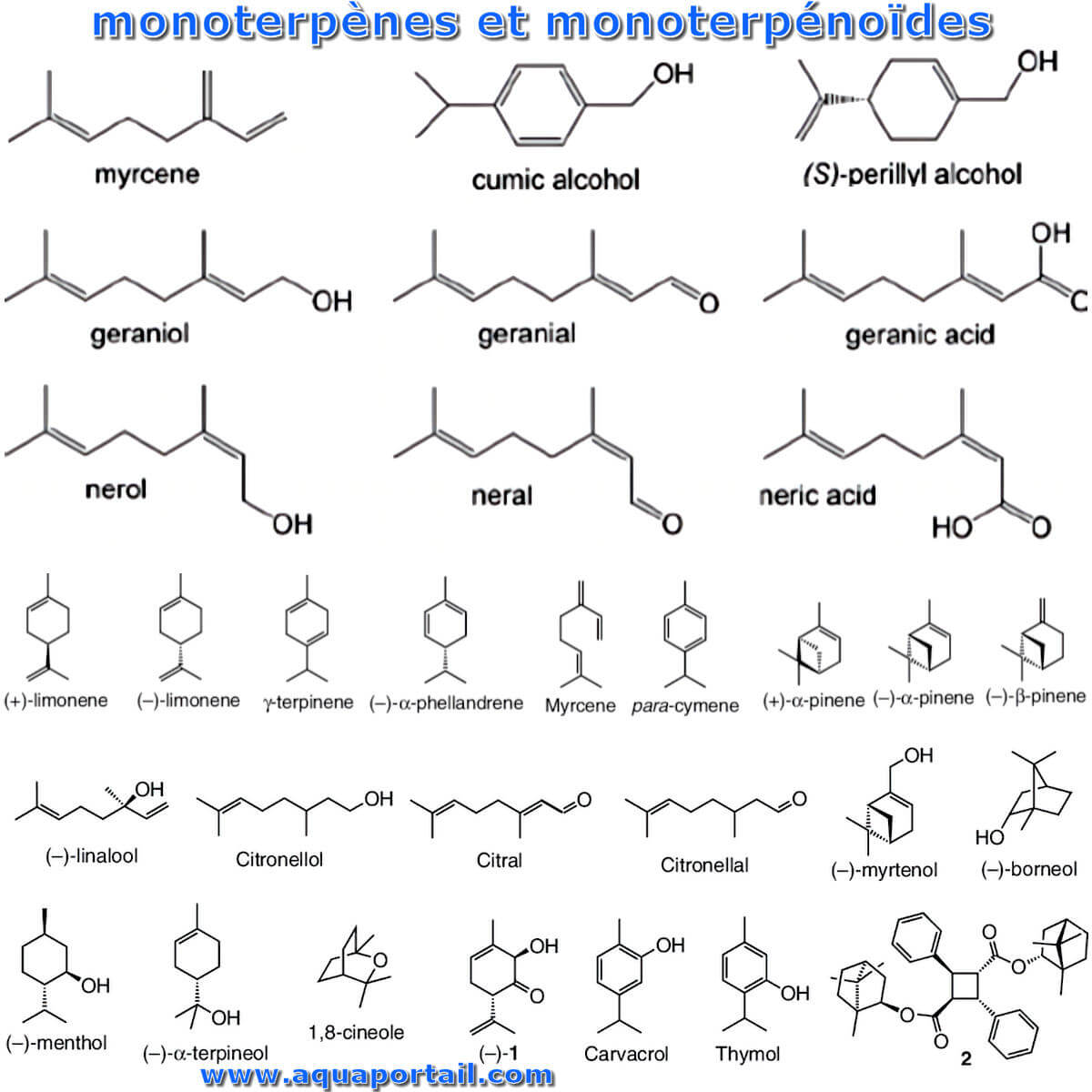
Le monoterpène (C₁₀H16) est un terpène comme un dimère d'isoprène. Il peut être divisé en composés acycliques, monocycliques, bicycliques et tricycliques.
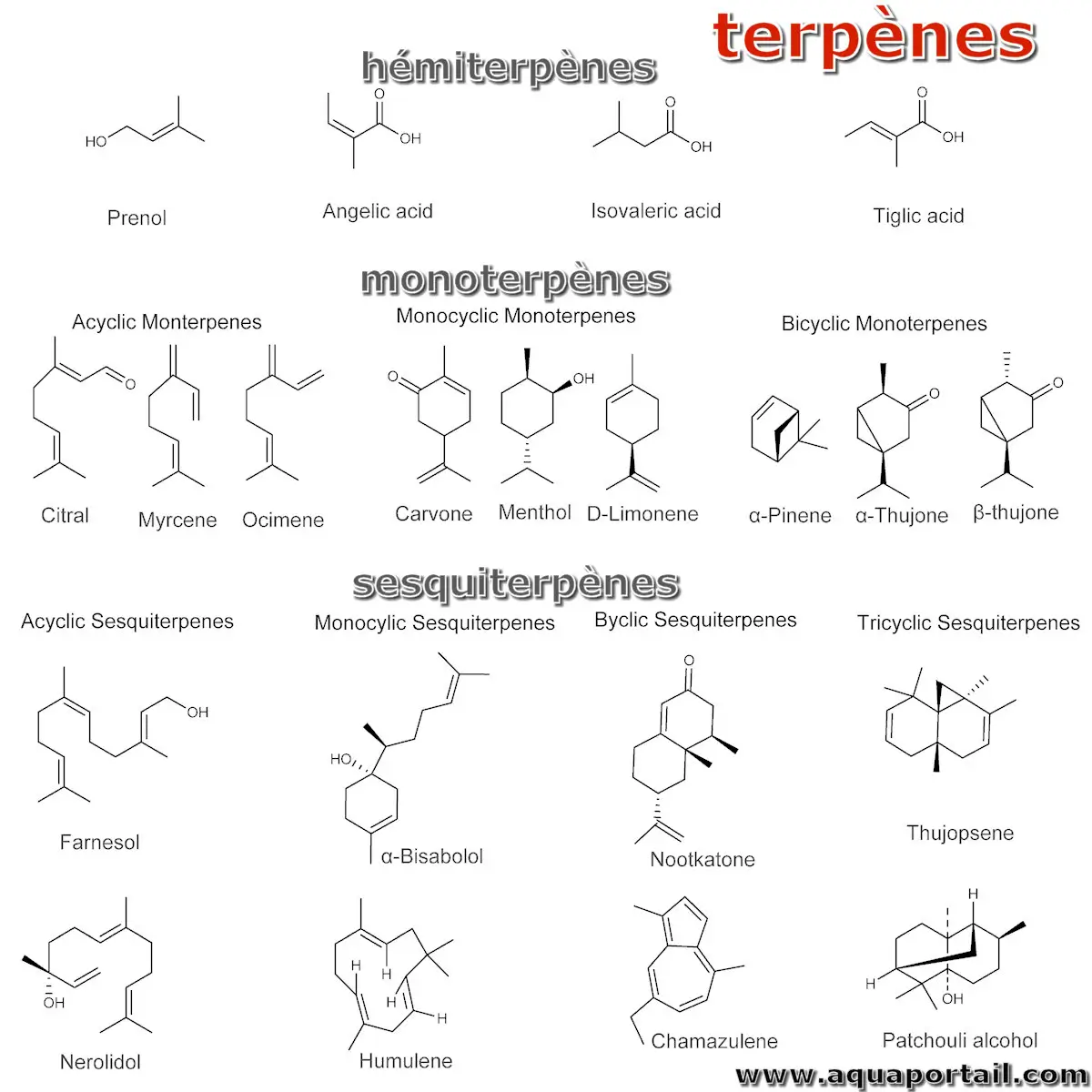
Un terpène est une substance chimique à forte odeur présente dans certaines plantes, notamment les conifères.
