L'eau de mer
L'eau de mer est l'eau salée des milieux marins et océaniques. Elle est une solution saline dont la concentration des sels minéraux dissous avoisine 35 parties pour mille (35 g/L) en moyenne. Sa principale substance chimique est le chlorure de sodium (le sel de cuisine), mais 79 autres éléments la compose.
L'eau de mer de la Méditerranée :
L'eau de mer a une densité de surface moyenne est de 1,025 g/mL, étant plus dense que l'eau douce et l'eau pure. La densité augmente jusque 1,035 g/mL (ou kg/L) à quelques mètres de profondeur.
Généralités
Une eau de mer distingue précisément des eaux marines côtières ou situées plus au large dans la mer ou l'océan, dans laquelle la salinité est maximale, avec une valeur d'environ 35 parties pour mille, et elle n'a pas subit de fluctuations journalières et saisonnières importantes. Les eaux côtières sont de l'eau de mer.
La teneur en sel supérieure abaisse son point de congélation, de sorte que l'eau de mer devient de la glace à -2 °C, et même -2,6 °C en Antarctique. L'océan contient 97,25 % du total de l'eau terrestre qui forme l'hydrosphère.
Dans un kilogramme d'eau de mer, il y a en moyenne 35 grammes de composés dissous, appelés sels inorganiques.
L'eau salée définit une eau à la salinité imprécise. En aquarium ou en aquaculture marine, l'eau de mer est reconstitué artificiellement : c'est une eau de mer artificielle, éventuellement enrichie. Une eau de mer enrichie contient plus, proportionnellement, certains éléments. C'est le cas en aquarium récifal en raison de la consommation, parfois rapide, des coraux durs en calcium, magnésium et carbonates.
L'eau de mer est une solution de H2O contenant de nombreuses substances très différentes. Jusqu'à 2/3 des éléments chimiques naturels sont présents dans l'eau de mer, mais la plupart seulement à l'état de traces. Six éléments, tous les ions, représentent plus de 99 % de la composition du soluté.
Les différences de salinité entre les masses d'eau sont combinées avec la température pour produire des différences de densité, qui sont à leur tour responsables de la convection de la circulation océanique : c'est la circulation thermohaline.
L'eau de mer n'a pas de salinité uniforme dans le monde entier. L'eau la moins salée de la planète est le golfe de Finlande dans la mer Baltique. La mer avec la salinité la plus élevée est la mer Morte au Moyen-Orient, où la chaleur augmente le taux d'évaporation à la surface et il y a peu d'écoulement fluvial.
L'eau de mer a une conductivité électrique élevée; c'est l'abondance d'ions dissous qui contribue à la polarité de l'eau salée. L'eau de mer est légèrement alcaline, et la valeur du pH se situe entre 7,5 et 8,4 et varie avec la température; si elle augmente, il diminue et le pH a tendance à aller vers l'acidité; La salinité varie en fonction de la pression ou de la profondeur et de l'activité vitale des organismes marins.
Origine des eaux de mer
Les théories scientifiques sur les origines de l'eau de mer ont commencé avec Edmond Halley en 1715, qui a proposé que le sel et d'autres minéraux soient emportés dans la mer par les rivières des continents. Ceux-ci provenaient du lavage continu des minéraux terrestres à travers la pluie. Une fois dans l'océan, ces sels étaient de plus en plus concentrés dans les océans à travers le cycle hydrologique. Halley a également réalisé que les lacs qui n'avaient pas de débouché vers la mer (comme la mer Morte ou la mer Caspienne) avaient des concentrations élevées en sel. Halley a appelé le processus "l'attrition continentale".
La théorie de Halley était partiellement correcte. Pour cela, il faut ajouter le sodium sur le fond de l'océan quand il a été formé. La présence de l'autre ion salin, le chlore semble provenir des fuites gazeuses de l'intérieur de la Terre et s'échapper par des éruptions hydrothermales ou volcaniques. La théorie communément acceptée est que la salinité est restée stable pendant la vie de la Terre, et que les ions de sel maintiennent un cycle continu qui les fait pénétrer et être expulsés à l'intérieur de la Terre. De cette façon, les sels réagissent avec les basaltes du fond marin qui, une fois avalés par le processus de subduction, sont à nouveau expulsés par les courants hydrothermaux et les volcans. De nos jours, les modèles sont remis en question, et il existe plusieurs publications qui traitent de la possibilité que les océans archaïques soient beaucoup plus salins qu'actuellement.
Composition de l'eau de mer
L'eau de mer est une solution dans l'eau H2O de nombreuses substances dissoutes différentes. Jusqu'à 2/3 des éléments chimiques naturels sont présents dans l'eau de mer, bien que la plupart ne trace que. Six composants, tous des ions, représentent plus de 99 % de la composition du soluté.
Les chlorures en sont à plus de 55 % à l'origine, avec le chlorure de sodium NaCl (sel de cuisine), mais elle contient aussi des sulfates, des bicarbonates, des bromures et du fluor parmi les anions, et parmi les cations, du sodium (plus de 30 %), du magnésium, du calcium, du potassium, du strontium, et l'acide borique comme molécule non dissociée.
Composition de l'eau de mer par éléments :
La composition de l'eau de mer naturelle contient 80 éléments chimiques différents de la table périodique.
Salinité
L'étude de la composition est simplifiée par le fait que les proportions des composants sont toujours à peu près les mêmes, bien que la concentration de tous les composants soit énormément variable. Nous nous référons à cette concentration totale en tant que salinité, qui est habituellement exprimée en millier (‰). Grâce à l'universalité de sa composition, la salinité est généralement estimée à partir de la mesure d'un seul paramètre, comme la conductivité électrique, l'indice de réfraction ou la concentration de l'un de ses composants, généralement l'ion chlorure Cl-.
La salinité montre des variations lorsque des bassins, des latitudes différentes ou des profondeurs différentes sont comparées. Favorise une salinité plus élevée, l'évaporation plus intense typique des latitudes tropicales, surtout en surface, et une salinité plus faible la proximité de l'embouchure des grandes rivières et des fortes précipitations.
Voir comment calculer la salinité et densité d'une eau de mer.
De toutes les mers ouvertes, la Mer Rouge a la salinité la plus élevée (40‰), délimitée par des régions arides. La mer Baltique est celle qui a la plus faible salinité (6 ‰ dans les eaux de surface du golfe de Botnie), en raison de sa faible profondeur, du climat froid et de l'amplitude des bassins versants qui, avec sa topographie presque fermée, beaucoup d'échanges avec l'océan Mondial. La salinité est très variable dans les lacs et les mers fermées qui occupent les bassins endoréiques, avec seulement 12 ‰ dans la mer Caspienne et jusqu'à 330 ‰ dans les couches superficielles de la mer Morte. Le principal facteur dont dépend la salinité des mers intérieures est l'existence du drainage, avec un ou plusieurs exutoires pour ceux qui débordent, ou bien, au contraire, l'évaporation est le seul moyen de compenser les apports. Ainsi, le lac Victoria, d'origine tectonique similaire à celle de la mer Morte, est un lac d'eau douce ainsi que la principale source du puissant fleuve Nil.
| Mer ou Océan | Salinité S |
|---|---|
| Mer Rouge | 40 |
| côte est-africaine | 32–35 |
| Ceylan | 30–34 |
| Singapour | 30–32 |
| Mer des Caraïbes | 35 |
| Floride | 34–35 |
| Philippines | 30–34 |
| Mer de java | 32 |
Les différences de salinité entre les masses d'eau sont combinées à celles de la température pour produire des différences de densité, qui sont à leur tour responsables de la convection sur laquelle repose la circulation océanique à grande échelle, la circulation dite thermohaline.
La salinité dans l'océan Mondial est variable. Elle peut varier selon deux caractéristiques :
- La salinité des eaux océaniques de surface dépend de la relation entre le bilan d'évaporation et les précipitations. En haute mer, les maxima de salinité se trouvent dans les régions des alizés, où l'évaporation est maximale, dépassant les précipitations. Ce modèle est généralement observé au centre des spins subtropicaux. Les mers semi-fermées, telles que la mer Méditerranée et la mer Rouge, ont également une salinité de surface maximale. C'est parce qu'ils sont des bassins entourés de grandes masses continentales, où les processus de mélange de l'eau avec les océans adjacents sont restreints. Ainsi, les taux d'évaporation élevés rendent les eaux de surface de ces mers semi-fermées plus salées.
La répartition des salinités dans le monde :

La salinité des eaux de surface de l'océan Mondial varie de 31 à 39 ‰. Il n'est pas tenu compte de la répartition verticale, seule la répartition "horizontale" est prise en compte.Les saisons de l'année finissent aussi par influencer la salinité de surface de l'océan dans certaines régions de la planète, comme cela arrive aux pôles. Au cours de l'été, les calottes polaires fondent et laissent moins de solution saline dans les eaux de surface des océans Arctique et Sud. D'autres facteurs influençant la salinité à la surface de l'océan sont les problèmes pluviométriques qui modifient le débit des rivières qui se jettent dans l'océan, réduisant ainsi la salinité de la surface locale. Cet effet est le plus souvent observé dans les zones sous l'influence de grandes rivières.
Dans l'océan global, les minimums de salinité sont trouvés dans les régions polaires en raison de la fonte de la glace en été. Dans ces régions, la salinité à la surface de l'océan peut être aussi faible que 33. On observe également des variations de salinité à la surface des deux plus grands océans de la planète. En termes de valeurs moyennes, l'océan Atlantique Nord est le plus salé (35,5), suivi des océans Atlantique Sud et Pacifique Sud (35,2). La salinité moyenne de l'océan Pacifique Nord est de 34,2.
- En plus de varier sur la surface de différentes régions de la planète, la salinité varie également avec la profondeur. Lorsque cette variation survient brusquement, le nom halocline est prononcé, ce qui est une variation prononcée (augmentation ou diminution) de la salinité avec la profondeur. Dans les eaux profondes (en dessous de 1 000 m), la salinité devient relativement uniforme à travers les océans.
Dans les mers de l'Antarctique et de l'Arctique, les processus de fonte et de congélation saisonniers provoquent une variation nette de la salinité de la colonne d'eau. En hiver, le gel de la surface de l'océan rend l'eau souterraine plus saline, car les sels sont expulsés du réticulum cristallin lors de la formation de la glace de mer. En été, la fonte des zones continentales et / ou marines dilue l'eau plus superficielle de l'océan, entraînant une diminution de la salinité. Les couches d'eau plus profondes restent avec une salinité plus élevée, révélant un profil de salinité croissant avec une profondeur croissante.
En haute mer, les eaux de surface salines se trouvent dans les régions subtropicales. Dans ces zones, une forte halocline se forme dans la colonne d'eau, car il y a une petite couche d'eau salée à la surface. En subsurface, la salinité diminue rapidement avec l'augmentation de la profondeur jusqu'à atteindre les valeurs typiques des eaux océaniques. Un profil similaire est trouvé dans les régions équatoriales, qui ont généralement plus d'eau salée à la surface du fait que le taux d'évaporation est plus élevé que le taux de précipitation. Cependant, dans les zones océaniques sous l'influence de la zone de convergence intertropicale, il y a souvent un maximum de salinité élevé à environ 100 m de profondeur près du sommet de la thermocline.
Depuis que Edmond Halley l'a proposé en 1715, il est admis que la salinité de l'eau de mer est l'effet d'une salinisation progressive, stabilisée depuis longtemps, due à une contribution des rivières, non compensée, de sels provenant du lavage des roches continental La salinité n'a pas augmenté depuis des milliards d'années, à cause de l'accumulation de sel dans les sédiments. Aujourd'hui, il est admis qu'une grande partie du sodium provient des mêmes émissions volcaniques qui ont initialement facilité la formation de l'hydrosphère.
Eau de mer artificielle
Une eau de mer artificielle désigne une eau de mer préparée avec un pré-mélange de sels ou du sel marin. Une eau de mer artificielle de bonne qualité se caractérise comme suit : elle est d'une composition simple, tout en contenant des concentrations raisonnables en éléments chimiques essentiels à la vie animale et végétale, elle peut être préparée et mélangée relativement facilement, les concentrations et proportions en ions majeurs reflètent approximativement celles de l'eau de mer, et les sels qui la composent ne précipitent pas facilement.
Voir la composition de l'eau de mer naturelle.
S'oppose à la NSW, eau de mer naturelle.
Eau de mer enrichie
Une eau de mer enrichie est une eau de mer naturelle dans laquelle des éléments nutritifs ont été ajoutés afin d'encourager la croissance de microalgues. Dans la plupart des cas, le milieu est stérilisé en autoclave ou par microfiltration afin d'éliminer tout micro-organisme qui pourrait la contaminer.
Conductivité électrique
L'eau de mer a une conductivité électrique élevée, à laquelle contribuent la polarité de l'eau et l'abondance des ions dissous.
Les sels dans l'eau se dissocient en ions. Un ion est un atome chargé positivement ou négativement et, par conséquent, échange des électrons avec le milieu. Ils peuvent absorber et libérer des électrons aux particules voisines. La conductivité varie principalement avec la température et la salinité (plus la salinité est élevée, plus la conductivité est élevée), et sa mesure permet, à température contrôlée, de connaître la salinité.
Densités des eaux de mer
La densité de l'eau de mer est l'une de ses propriétés les plus importantes. Sa variation provoque des courants. Il est déterminé en utilisant l'équation internationale de l'état de l'eau de mer à la pression atmosphérique, qui est formulée par l'Unesco (documents techniques de l'UNESCO en sciences de la mer, 1981) à partir des travaux effectués au cours de cème siècle. les variables thermodynamiques de l'eau de mer : densité, pression, salinité et température.
La densité de l'eau de mer typique (eau salée avec 3,5 % de sels dissous) est habituellement de 1,02819 kg/L à -2 °C, 1,02811 à 0 °C, 1,02778 à 4 °C, etc.
Potentiel Hydrogène pH
L'eau océanique est légèrement alcaline et la valeur de son pH est comprise entre 7,5 et 8,4 (8,0 à 8,2 en principal) et varie en fonction de la température; si elle augmente, le pH diminue et tend à l'acidité; il peut également varier en fonction de la salinité, de la pression ou de la profondeur et de l'activité vitale des organismes marins.
Gaz dans l'eau de mer
Les gaz dissous sont les mêmes qui composent l'air libre, mais dans des proportions différentes, conditionnées par divers facteurs. La température et la salinité influencent en réduisant la solubilité des gaz lorsque l'un de ces deux paramètres augmente. D'autres facteurs sont l'activité métabolique des êtres vivants et les équilibres chimiques complexes avec des solutés solides, tels que l'ion bicarbonate (HCO3-). La concentration totale et la composition des gaz dissous varient principalement avec la profondeur, ce qui affecte l'agitation, la photosynthèse (limitée à la zone photique superficielle) et l'abondance des organismes.
Dans les eaux océaniques de surface bien mélangées, la composition typique des gaz dissous comprend 64 % d'azote (N2), 34 % d'oxygène (O2) et 1,8 % de dioxyde de carbone (CO2), très au-dessus de ce dernier des 0,04 % qui est à l'air libre. L'oxygène (dioxygène O2) abonde surtout en surface, où la photosynthèse sur la respiration prédomine, et présente généralement son minimum à 400 m de profondeur, où les effets de diffusion à l'air libre et de photosynthèse n'atteignent plus, mais où la densité des organismes consommateurs est encore élevée, ils l'épuisent. La température, plus faible dans les fonds profonds, affecte la solubilité des carbonates.
Voir aussi les influences de l'effet de serre et du dioxyde carbone et des gaz à effet de serre.
Équilibre chimique et temps de séjour
L'eau de mer est en équilibre chimique dynamique, ce qui entraîne des quantités et des proportions de sels dissous pratiquement constantes dans une certaine partie de l'eau. Cela s'explique par l'équilibre à l'entrée et à la sortie des sels dans l'océan, qui est lié au flux entrant de sels et au temps pendant lequel les ions de ces sels restent dans la colonne d'eau. Cet équilibre intervient par l'ajout de sels dans la colonne d'eau (provenant des roches altérées et de l'activité volcanique) et l'élimination de ces sels par la formation de sédiments.
En raison de l'équilibre chimique des sels dissous dans l'océan, il est possible d'estimer le temps pendant lequel chaque ion reste dans la colonne d'eau. Cette durée, appelée temps de séjour, est généralement définie comme le temps de séjour moyen d'une particule (par exemple ion) dans un compartiment (par exemple, l'eau de mer). Un facteur important qui influence le temps de résidence d'un élément chimique dans l'eau de mer est sa réactivité chimique. Les ions des sels dissous dans l'eau de mer sont peu réactifs, ils ont donc tendance à rester dans la colonne d'eau pendant des millions d'années. Le brome est l'élément chimique qui a le temps de séjour le plus long dans l'eau de mer (120 millions d'années).
Bien que la quantité totale de sels dissous dans l'eau de mer varie entre les différentes régions géographiques et les profondeurs dans la colonne d'eau, ces sels maintiennent leurs proportions à peu près constante dans tous les océans. La constance relative des proportions d'ions dissous dans l'eau de mer est connue sous le nom de "Principe de Marcet" ou "Loi des Proportions Constantes".
Méthodes de purification
Les scientifiques ont mis au point des dizaines de méthodes pour dessaler l'eau de mer, bien qu'à ce jour aucune d'entre elles ne s'est révélée plus efficace que la méthode de distillation utilisée à Freeport, au Texas, pour le dessalement.
Les 4083 habitants de Symi, île de Grèce, reçoivent toute l'eau d'une unité de distillation solaire qui produit 15 000 litres par jour. À Wrightsville Beach, en Caroline du Nord (terrain expérimental du bureau de l'eau salée des États-Unis), une usine de congélation produit chaque jour 750 000 litres d'eau distillée. La recherche a produit d'autres méthodes plus simples : l'une, appelée osmose inverse, désalte l'eau en la faisant passer à travers une membrane synthétique; l'autre, appelée hydratation, consiste à mélanger du propane avec de l'eau salée. Le propane forme un composé solide avec l'eau, qui est séparée lorsque le mélange est chauffé.
Lorsque l'eau n'est pas très salée, une autre méthode peut être utilisée (osmose par exemple). À Webster, dans le Dakota du Sud, l'eau était trop saumâtre (presque le double de ce que le gouvernement considère comme acceptable), mais beaucoup moins que l'eau de mer. Une usine de dessalement a été installée par électrodialyse, un procédé très coûteux lorsqu'il y a beaucoup de sel. L'usine de Webster produit environ 950 000 litres d'eau douce par jour.
La distillation à grande échelle peut présenter des problèmes inattendus. Par exemple, le dessalement de suffisamment d'eau pour alimenter la ville de New York pendant un an produirait un gaspillage de quelque 60 millions de tonnes de sel : plus que ce qui est consommé aux États-Unis en deux ans.
Abaissement cryoscopique
L'abaissement cryoscopique (cryoscopie) est la réduction du point de congélation d'un solvant pur par la présence de solutés. Il est directement proportionnel à la molalité, ce qui le rend plus important pour les solutés ioniques, tels que ceux qui prédominent dans l'eau de mer, que pour les solutés non-ioniques. Le phénomène a des conséquences importantes dans le cas de l'eau de mer, car la réponse au refroidissement intense de l'eau de mer, comme cela existe en hiver dans les régions polaires, est la séparation d'une phase solide flottante d'eau pure.
C'est ainsi que la calotte glaciaire se forme autour de l'Antarctique ou de l'océan Arctique, comme un agrégat compact d'eau glacée pure, avec de la saumure remplissant les interstices et flottant sur une masse d'eau liquide à moins de 0 °C limite maximale de -1,9 °C pour une salinité de 3,5 %.
Aspects culturels
Même sur un bateau ou une île au milieu de l'océan, il peut y avoir un manque d'eau, c'est-à-dire de l'eau douce. C'est un paradoxe, car une personne entourée d'eau peut mourir de soif. Parce qu'il est salé, l'eau de mer n'est pas potable. De nombreux pays d'Afrique et du Moyen-Orient confrontés à des problèmes d'eau appliquent aujourd'hui un procédé coûteux, appelé dessalement, pour obtenir de l'eau potable à partir de l'eau de mer. A l'avenir, ce processus peut devenir très utilisé, compte tenu de la pollution intense actuelle des masses d'eau continentales.
Eau de mer en aquarium marin
L'eau de mer naturelle se différencie de l'eau de mer enrichie et de l'eau de mer artificielle. L'eau de mer utilisée en aquarium marin ou récifal est une eau reconstituée artificiellement, généralement à base d'une eau pure comme l'eau osmosée mélangée avec des sels synthétiques reconstituants en grande partie l'eau de surface océanique tropicale. Les meilleurs sels du commerce comptent environ 60 des 80 éléments chimiques, avec des proportions améliorées pour les éléments chimiques "consommés" par les coraux (surtout les coraux durs).
En rapport avec "eau de mer"

Un aquarium eau de mer est un type d'aquarium contenant de l'eau de mer pour reproduire un biotope océanique, tant en eau froide qu'en eau chaude tropicale.

La citation d'une eau de mer naturelle est surtout connue sous son abréviation anglaise : NSW.
Ichthyophthirius multifiliis, parasite d'eau douce et d'eau de mer
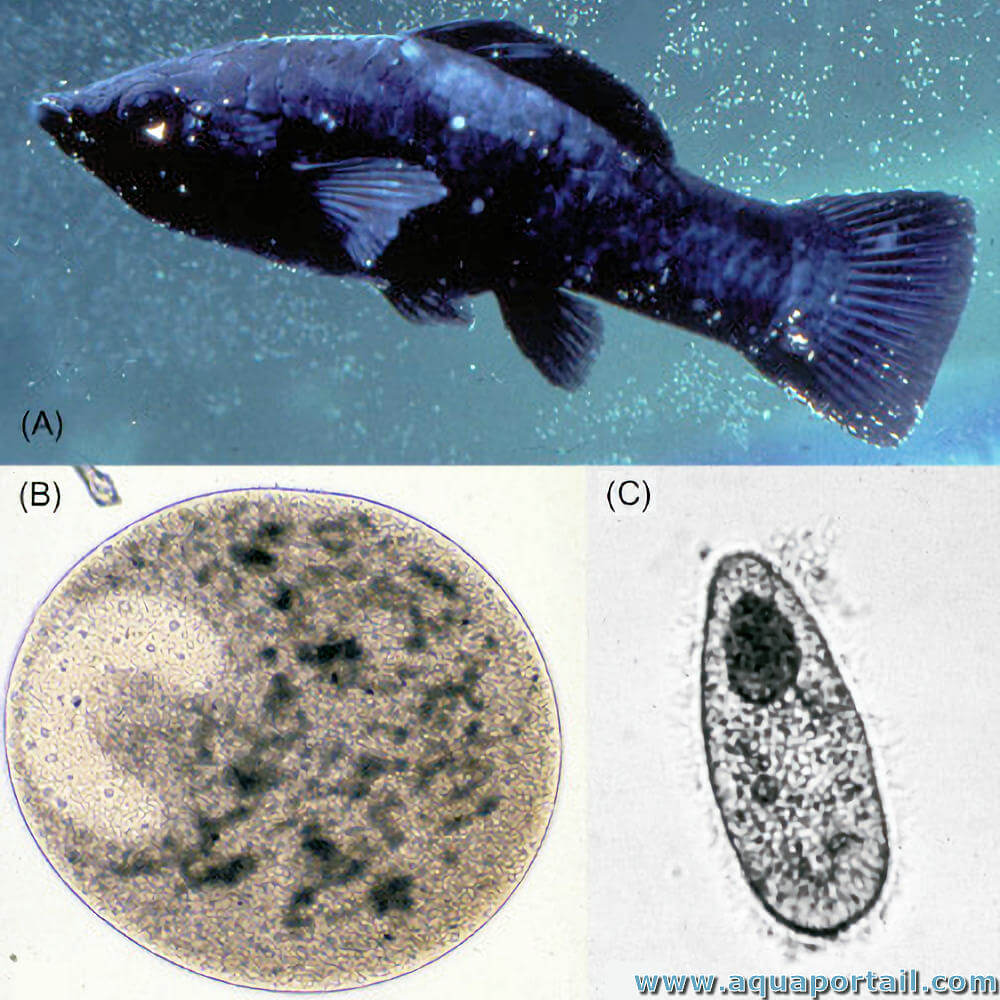
Ichthyophthirius multifiliis, la maladie des points blancs ou maladie des grains de semoule
Un anneau de Balbiani (ou corps de Balbiani) est un agrégat ovocytaire conservé qui facilite l'organisation de l'ovocyte en une cellule polarisée avec...
