L'eau H2O
L'eau est une substance naturelle liquide, incolore, inodore, sans saveur et limpide quand elle est pure. De formule H2O (hydrogène et oxygène), elle est essentielle à la vie des organismes et se retrouve partout : eau douce, eau de mer, etc. La glace est son état solide, la vapeur son état gazeux.
L'eau H2O est une substance liquide essentielle de la Terre. L'eau est un composé chimique dont la molécule est formée de deux atomes d'hydrogène et d'un atome d'oxygène (H2O). Le terme eau désigne généralement la substance dans son état liquide, bien qu'elle puisse se trouver sous sa forme solide appelée glace et sous sa forme gazeuse appelée vapeur.
De l'eau H2O :
L'eau H2O est un composé chimique simplement formé de 2 molécules d'hydrogène et 1 molécule d'oxygène.
Généralités
L'eau est une substance assez commune dans l'univers et le système solaire, où elle se trouve principalement sous la forme de vapeur ou de glace. Elle est essentielle pour la survie de toutes les formes de vie connues. Par exemple, sans eau, le processus de photosynthèse des végétaux ne pourrait pas exister.
En aquarium, voir aussi le changement d'eau et les tests d'eau, ainsi que les paramètres de l'eau.
En écologie, voir spécifiquement l'écologie de l'eau d'un écosystème aquatique.
L'eau couvre 71 % de la surface de la croûte terrestre. Elle est située principalement dans les océans, où 96,5 % de l'eau totale est concentrée en eau salée. Les glaciers et les calottes polaires représentent 1,74 %, tandis que les gisements souterrains (aquifères), le pergélisol et les glaciers continentaux représentent 1,72 %. Les 0,04 % restants sont répartis par ordre décroissant entre les lacs, l'humidité du sol, l'atmosphère, les réservoirs, les rivières et les êtres vivants. L'eau circule constamment dans un cycle d'évaporation ou de transpiration (évapotranspiration), de précipitation et de déplacement vers la mer. Les vents transportent dans les nuages sous forme de vapeur d'eau de la mer et en sens inverse autant d'eau que celle qui est déversée des rivières dans les mers, soit environ 45 000 km³ par an. Sur le continent, l'évaporation et la transpiration contribuent à 74 000 km³ par an, ce qui signifie que les précipitations totales sont de 119 000 km³ par an.
On estime qu'environ 70 % de l'eau douce est utilisée pour l'agriculture. L'eau dans l'industrie absorbe en moyenne 20 % de la consommation mondiale, utilisée dans la réfrigération, le transport et comme solvant dans divers procédés industriels. La consommation domestique absorbe les 10 % restants. L'accès à l'eau potable a augmenté au cours des dernières décennies dans pratiquement tous les pays. Cependant, les études de la FAO estiment qu'un pays en développement sur cinq aura des problèmes de pénurie d'eau avant 2030; dans ces pays, l'agriculture a besoin de moins d'eau en modernisant les systèmes d'irrigation.
Propriétés physiques et chimiques
L'eau est une substance formulée chimiquement sous forme de H2O, c'est-à-dire qu'une molécule d'eau est constituée de deux atomes d'hydrogène liés de manière covalente à un atome d'oxygène.
C'est Henry Cavendish qui a découvert en 1782 que l'eau est une substance composée et non un élément, comme on le pensait depuis l'Antiquité. Les résultats de cette découverte ont été développés par Antoine Laurent de Lavoisier, révélant que l'eau était formée par l'oxygène et l'hydrogène. En 1804, le chimiste français Joseph Louis Gay-Lussac et le naturaliste et géographe allemand Alexander von Humboldt ont démontré que l'eau était composée de deux volumes d'hydrogène pour chaque volume d'oxygène (H2O).
Actuellement, la recherche se poursuit sur la nature de ce composé et de ses propriétés, allant parfois au-delà des limites de la science conventionnelle. En ce sens, le chercheur John Emsley, vulgarisateur scientifique, a dit de l'eau qu'elle est l'une des substances chimiques les plus étudiées, mais elle est encore la moins comprise.
États de l'eau
L'eau est un liquide dans la gamme des températures et des pressions les plus appropriées pour les formes de vie connues : à la pression de 1 atm, l'eau est liquide entre les températures de 273,15 K (0 °C) et 373,15 K (100 °C). Les valeurs de la chaleur latente de fusion et de vaporisation sont respectivement de 0,334 kJ/g et de 2,23 kJ/g.
Lorsque la pression augmente, le point de fusion diminue légèrement, ce qui est d'environ -5 °C à 600 atm et de -22 °C à 2 100 atm. Cet effet est la cause de la formation de lacs sous-glaciaires en Antarctique et contribue au mouvement des glaciers. À des pressions au-dessus de 2 100 atm le point de fusion augmente rapidement encore et la glace a des configurations exotiques qui n'existent pas aux pressions inférieures.
Les différences de pression ont un effet plus dramatique sur le point d'ébullition, qui est d'environ 374 °C à 220 atm, tandis qu'au sommet du mont Everest, où la pression atmosphérique est d'environ 0,34 atm, l'eau bout à environ 70 °C. L'augmentation du point d'ébullition avec pression peut être observée dans les évents hydrothermaux en eau profonde, et a des applications pratiques, telles que les autocuiseurs et les machines à vapeur. La température critique, au-dessus de laquelle la vapeur ne peut pas être liquéfiée lorsque la pression augmente, est de 373,85 °C (647,14 K).
À des pressions inférieures à 0,006 atm, l'eau ne peut pas exister à l'état liquide et passe directement du solide au gaz par sublimation, phénomène exploité dans la lyophilisation des aliments et autres composés. À des pressions supérieures à 221 atm, les états liquide et gazeux ne sont plus distingués, un état appelé eau supercritique. Dans cet état, l'eau est utilisée comme biocatalyseur pour catalyser certaines réactions et traiter les déchets organiques.
La densité de l'eau liquide est très stable et varie peu avec les changements de température et de pression. À la pression d'une atmosphère, la densité minimale d'eau liquide est de 0,958 kg/l à 100 °C. Lorsque la température diminue, la densité augmente constamment jusqu'à atteindre 3,8 °C où elle atteint une densité maximale de 1 kg/l. À des températures plus basses, contrairement à d'autres substances, la densité diminue. À 0 °C, la valeur est de 0,9999 kg/l; lors de la congélation ou cryogénisation, la densité subit une diminution plus abrupte à 0,917 kg/l, accompagnée d'une augmentation de 9 % en volume, ce qui explique le fait que la glace flotte sur l'eau liquide (comme un iceberg).
Goût, odeur et apparence
Traditionnellement, l'eau pure a été décrite comme incolore, inodore et insipide, bien que l'eau destinée à la consommation contienne généralement des minéraux et des substances organiques en solution pouvant donner des goûts et des odeurs plus ou moins détectables selon la concentration des composés et la température de l'eau.
L'eau peut sembler trouble si elle contient des particules en suspension. La matière organique présente dans le sol, comme les acides humiques et fulviques, donne également de la couleur, ainsi que la présence de métaux, tels que le fer. En l'absence de contaminants, l'eau liquide, solide ou gazeuse absorbe à peine la lumière visible, bien que dans le spectrographe il est prouvé que l'eau liquide a une légère teinte bleu-vert. La glace a également tendance à bleu turquoise. La couleur des grandes surfaces d'eau est en partie due à sa couleur intrinsèque, et en partie à la réflexion du ciel. D'autre part, l'eau absorbe la lumière fortement dans le reste du spectre, en cherchant la protection du rayonnement ultraviolet.
Propriétés moléculaires
La molécule d'eau adopte une géométrie non linéaire, les deux atomes d'hydrogène formant un angle de 104,45 degrés l'un par rapport à l'autre. Cette configuration, associée à la plus grande électronégativité de l'atome d'oxygène, confère une polarité à la molécule, dont le moment dipolaire électrique est de 6,2x10-30 Cm.
La polarité de la molécule d'eau donne lieu à des forces de van der Waals et à la formation de jusqu'à quatre liaisons hydrogène avec les molécules environnantes. Ces liens moléculaires expliquent l'adhésivité de l'eau, son indice de tension superficielle élevé et sa capillarité, responsable de la formation des ondes capillaires, permet à certains animaux de se déplacer à la surface de l'eau et contribue au transport de la sève contre la gravité dans les plantes vasculaires, telles que les arbres. La présence dans l'eau de certaines substances tensioactives telles que les savons, les détergents et les solvants, réduit notamment la tension superficielle de l'eau et facilite l'élimination de la saleté collée aux objets.
Les ponts hydrogène entre les molécules d'eau sont également responsables des points de fusion et d'ébullition élevés par rapport à d'autres composés d'hydrogène et d'amphiphile, tels que le sulfure d'hydrogène. Ils expliquent également les valeurs élevées de la capacité thermique -4,2 J/g/K, valeur seulement dépassée par l'ammoniac -, la chaleur latente et la conductivité thermique - entre 0,561 et 0,679 W/m/ K-. Ces propriétés confèrent à l'eau un rôle important dans la régulation du climat terrestre, en stockant la chaleur et en la transportant entre l'atmosphère et les océans.
Une autre conséquence de la polarité de l'eau est que, à l'état liquide, c'est un solvant très puissant de nombreux types de substances différentes. Les substances qui se mélangent et se dissolvent bien dans l'eau - comme les sels, les sucres, les acides, les alcalis et certains gaz (comme l'oxygène ou le dioxyde de carbone, par carbonatation) - sont dites hydrophiles, tandis que celles qui ne se combinent pas bien L'eau - comme les lipides et les graisses - sont appelées substances hydrophobes. De même, l'eau est miscible avec de nombreux liquides, tels que l'éthanol, et en toute proportion, formant un liquide homogène. Il peut former des azéotropes avec d'autres solvants, tels que l'éthanol ou le toluène. D'autre part, les huiles sont immiscibles avec l'eau, et forment des couches de densité variable sur leur surface. Comme tout gaz, la vapeur d'eau est complètement miscible à l'air.
Propriétés électriques et magnétiques
L'eau a une constante diélectrique relativement élevée (78,5 à 298 K) et les molécules de substances chargées électriquement se dissocient facilement à l'intérieur. La présence d'ions dissociés augmente significativement la conductivité de l'eau qui, au contraire, se comporte comme un isolant électrique à l'état pur.
L 'eau peut se dissocier spontanément en ions hydronium H3O+ et hydroxydes OH-. La constante de dissociation Kw est très faible -10-14 à 25 °C, ce qui implique qu'une molécule d'eau se dissocie environ toutes les dix heures. Le pH de l'eau pure est de 7 (électroneutralité), car les ions hydronium et les hydroxydes sont à la même concentration. En raison des faibles niveaux de ces ions, le pH de l'eau varie fortement si des acides ou des bases s'y dissolvent.
Il est possible de séparer l'eau liquide dans ses deux composants hydrogène et oxygène en y passant un courant électrique, par électrolyse. L'énergie nécessaire pour séparer l'eau de ses deux composants par ce processus est supérieure à l'énergie libérée par la recombinaison de l'hydrogène et de l'oxygène.
L'eau liquide pure est un matériau diamagnétique et est repoussée par des champs magnétiques très puissants.
Propriétés mécaniques
L'eau liquide peut être considérée à des fins pratiques comme incompressible, un effet qui est utilisé dans les presses hydrauliques; dans des conditions normales, sa compressibilité varie de 4,4 à 5,1.10-10 Pa-1. Même à des profondeurs de 2 km, où la pression atteint environ 200 atm, l'eau subit une réduction de volume de seulement 1 %.
La viscosité de l'eau est d'environ 10-3 Pa.s ou 0,01 poises à 20 °C, et la vitesse du son dans l'eau liquide varie entre 1 400 et 1 540 m/s, selon la température. Le son est transmis dans l'eau presque sans atténuation, surtout aux basses fréquences; cette propriété permet la communication sous-marine sur de longues distances entre les cétacés et est la base de la technique du sonar pour détecter les objets sous-marins.
Réactions chimiques
L'eau est le produit final des réactions de combustion, soit de l'hydrogène soit un composé contenant de l'hydrogène. L'eau se forme également dans les réactions de neutralisation entre les acides et les bases.
L'eau réagit avec de nombreux oxydes métalliques et non métalliques pour former respectivement des hydroxydes et des oxacides. Il forme également des hydroxydes en réagissant directement avec des éléments plus électropositifs, tels que les métaux alcalins et alcalino- terreux, qui déplacent l'hydrogène de l'eau dans une réaction qui, dans le cas d'alcalins plus lourds, peut devenir explosive par contact avec l'hydrogène libéré avec l'oxygène de l'air.
En raison de certaines capacités, l'eau peut hydrolyser d'autres molécules. Des réactions d'hydrolyse peuvent survenir avec les composés organiques et inorganiques. Ils sont très importants dans le métabolisme des êtres vivants, qui synthétisent de nombreuses enzymes appelées hydrolases ayant pour fonction de catalyser l'hydrolyse de différentes molécules.
Réflectivité de l'eau
La réflexion (réflectivité) intervient lorsque la lumière se déplace d'un milieu avec un indice de réfraction à un autre milieu avec un indice de réfraction différent. La fraction de lumière incidente qui est réfléchie dans un plan d'eau est spéculée et calculée avec les équations de Fresnel. La réflexion de Fresnel est directionnelle et ne contribue donc pas significativement à l'albédo, qui est principalement une réflexion diffuse.
La réflectivité de l'eau :
La réflectivité de l'eau douce à 20 °C avec un indice de réfraction de 1,333 donne cette courbe.
Une vraie surface d'eau peut avoir des vagues d'ondes. Il est possible de corriger la réflectivité d'une surface plane donnée par les équations de Fresnel et de l'ajuster (calculs de réflectance) pour prendre en compte les ondulations que la surface peut avoir.
L'eau dans l'univers
L'eau est un élément assez commun dans notre système solaire, et dans l'univers, où elle se trouve principalement sous la forme de glace et de vapeur. C'est une grande partie du matériel qui compose les comètes et en 2016, de l'eau magmatique a été découverte de l'intérieur de la Lune en petits grains minéraux sur la surface lunaire. Certains satellites de Jupiter et Saturne, comme Europa et Enceladus, peuvent avoir de l'eau liquide sous leur épaisse couche de glace. Cela permettrait à ces lunes d'avoir une sorte de tectonique des plaques où l'eau liquide remplit le rôle de magma dans la terre, alors que la glace serait l'équivalent de la croûte terrestre.
La plus grande partie de l'eau qui existe dans l'univers est peut-être apparue comme un sous-produit de la formation d'étoiles qui ont ensuite produit de la vapeur d'eau lors de l'explosion. La naissance des étoiles provoque généralement un fort flux de gaz et de poussière cosmique. Lorsque ce matériau entre en collision avec le gaz provenant des zones externes, les ondes de choc produites compriment et chauffent le gaz. On pense que l'eau est produite dans ce gaz chaud et dense.
De l'eau a été détectée dans les nuages interstellaires au sein de notre galaxie, la Voie Lactée. Ces nuages interstellaires peuvent éventuellement se condenser en une nébuleuse solaire. En outre, on pense que l'eau peut être abondante dans d'autres galaxies, puisque ses composants (hydrogène et oxygène) sont parmi les plus communs dans l'univers. Dans la première décennie du 20ème siècle, l'eau a été trouvée dans les exoplanètes, telles que HD 189 733 et HD 209 458.
En juillet 2011, le magazine Astrophysical Journal Letters a publié la découverte par un groupe d'astronomes du Jet Propulsion Laboratory (JPL) de la NASA et du California Institute of Technology (CALTECH) d'un nuage de vapeur d'eau qui entoure le quasar APM 8279+5255, qui est le plus grand réservoir d'eau de l'Univers découvert à ce jour, environ 140 milliards de fois plus que sur Terre.
L'eau dans le système solaire
De la vapeur d'eau a été détectée dans l'atmosphère de plusieurs planètes, satellites et autres corps du système solaire, en plus du soleil lui-même. Voici quelques exemples :
- Mercure : Il a été détecté en grande proportion dans l'exosphère.
- Vénus : 0,002 % dans l'atmosphère.
- Terre : quantités réduites dans l'atmosphère, sujettes aux variations climatiques.
- Mars : quantités variables en fonction du lieu et de la saison de l'année.
- Jupiter : 0,0004 % dans l'atmosphère.
- Encelade (lune de Saturne) : 91 % de son atmosphère.
L'eau à l'état liquide abonde sur Terre, où elle couvre 71 % de la surface. En 2015, la NASA a confirmé la présence d'eau liquide à la surface de Mars.
Il y a des indications que la lune Encelade de Saturne a un océan liquide de 10 km de profondeur à environ 30–40 km au-dessous du pôle Sud du satellite; on croit aussi que Titan peut avoir une couche d'eau et d'ammoniac sous la surface, et la surface du satellite Europa de Jupiter a des caractéristiques qui suggèrent l'existence d'un océan de eau liquide à l'intérieur. Sur Ganymède, une autre lune de Jupiter, il pourrait également y avoir de l'eau liquide entre les couches de glace et de roche. En 2015, la sonde spatiale New horizons a trouvé des preuves d'eau à l'intérieur de Pluton.
En ce qui concerne la glace, elle existe sur Terre, en particulier dans les zones polaires et glaciaires; dans les calottes polaires de Mars, on trouve aussi de l'eau solide, bien qu'elles soient composées principalement de glace sèche. Il est probable que la glace fait partie de la structure interne des planètes telles que Uranus, Saturne et Neptune. La glace forme une couche épaisse à la surface de certains satellites, comme sur Europa et sur Titan, où elle peut atteindre 50 km d'épaisseur.
Il y a aussi de la glace dans la matière qui forme les anneaux de Saturne 65 dans les comètes et des objets d'origine météorique, provenant par exemple de la ceinture de Kuiper ou du nuage d'Oort. De la glace a été trouvée sur la Lune et sur des planètes naines comme Cérès et Pluton.
L'eau et la zone habitable
L'existence de l'eau à l'état liquide est nécessaire pour les êtres vivants terrestres et sa présence est considérée comme un facteur important dans l'origine et l'évolution de la vie sur la planète. La Terre est située dans une zone du système solaire qui rencontre des conditions très spécifiques, mais si elle était de 5 % - huit millions de kilomètres - plus ou moins loin du Soleil elle ne pourrait pas retenir l'eau à l'état liquide, seulement de la vapeur d'eau ou de la glace.
La masse de la Terre joue également un rôle important dans l'état de l'eau à la surface : la force de gravité empêche les gaz de l'atmosphère de se disperser. La vapeur d'eau et le dioxyde de carbone se combinent, provoquant ce qu'on appelle l'effet de serre, qui maintient la stabilité des températures, agissant comme une couche protectrice de la vie sur la planète. Si la Terre était plus petite, la gravité inférieure exercée sur l'atmosphère la rendrait moins épaisse, ce qui entraînerait des températures extrêmes et empêcherait l'accumulation d'eau sauf dans les calottes polaires, comme cela existe sur Mars. D'autre part, si la masse de la Terre était beaucoup plus grande, l'eau resterait dans un état solide même à des températures élevées, étant donné la haute pression causée par la gravité. Par conséquent, à la fois la taille d'une planète et la distance à l'étoile sont des facteurs dans l'extension de la zone habitable.
L'eau sur Terre
La Terre, étudiée en hydrologie, se caractérise par un pourcentage élevé de sa surface recouverte d'eau liquide, bien que le volume total occupé par l'eau n'atteigne pas 1,4 milliard, ce qui est faible par rapport à celui de la planète. Ce volume reste constant grâce au cycle de l'eau. On pense que l'eau faisait partie de la composition de la terre d'origine et apparaissait à la surface des processus de dégazage du magma à l'intérieur de la terre et de la condensation de la vapeur d'eau au fur et à mesure que la planète se refroidissait.
Le manteau terrestre contient une quantité indéterminée d'eau qui, selon les sources, est comprise entre 35 % et 85 % du total. Cette substance peut être trouvée dans presque n'importe quel endroit dans la biosphère et dans les trois états d'agrégation de la matière : solide, liquide et gazeux. L'eau présente dans tout état au-dessus ou au-dessous de la surface de la planète, y compris le sous-sol, forme l'hydrosphère, qui est soumise à une dynamique complexe de transport et de changement d'état qui définit un cycle de l'eau.
Les océans et les mers d'eau salée couvrent 71 % de la surface de la Terre. Seulement 3 % de l'eau terrestre est douce, et de ce volume, seulement 1 % est à l'état liquide. Les 2 % restants sont à l'état solide dans les couches, les champs et les plates - formes de glace ou de falaises aux latitudes près des pôles. En dehors des régions polaires, l'eau douce se trouve principalement dans les zones humides et, sous terre, dans les aquifères. Selon une étude publiée dans la revue Nature Geoscience, on estime que les eaux souterraines totales de la planète représentent un volume de 23 millions de kilomètres cubes.
L'eau joue un rôle très important dans les processus géologiques. Les courants d'eau souterrains affectent directement les couches géologiques, influençant la formation de failles. L'eau située dans le manteau terrestre affecte également la formation des volcans. À la surface, l'eau agit en tant qu'agent très actif sur les processus chimiques et physiques de l'érosion. L'eau à l'état liquide et, dans une moindre mesure, sous forme de glace, est également un facteur essentiel du transport des sédiments. Le dépôt de ces restes est un outil utilisé par la géologie pour étudier les phénomènes de formation qui ont eu lieu sur Terre.
Droit à l'eau
Les droits d'utilisation de l'eau désignent un droit de prendre, d'utiliser et de transférer de l'eau. Il inclut également la propriété de l'eau. Il se traduit généralement sous la forme d'un permis, mais peuvent avoir différentes origines, telles que la coutume (usage établi) ou la propriété de terres (riveraines, droits de riverainetés).
Les droits de riveraineté concernent les propriétaires dont les biens contiennent ou bordent un cours d'eau, ou tout autre plan d'eau (étang, lac...) et ce qu'ils possèdent, sur les rives, les berges, le lit ou les eaux de celui-ci.
En rapport avec "eau H2O"
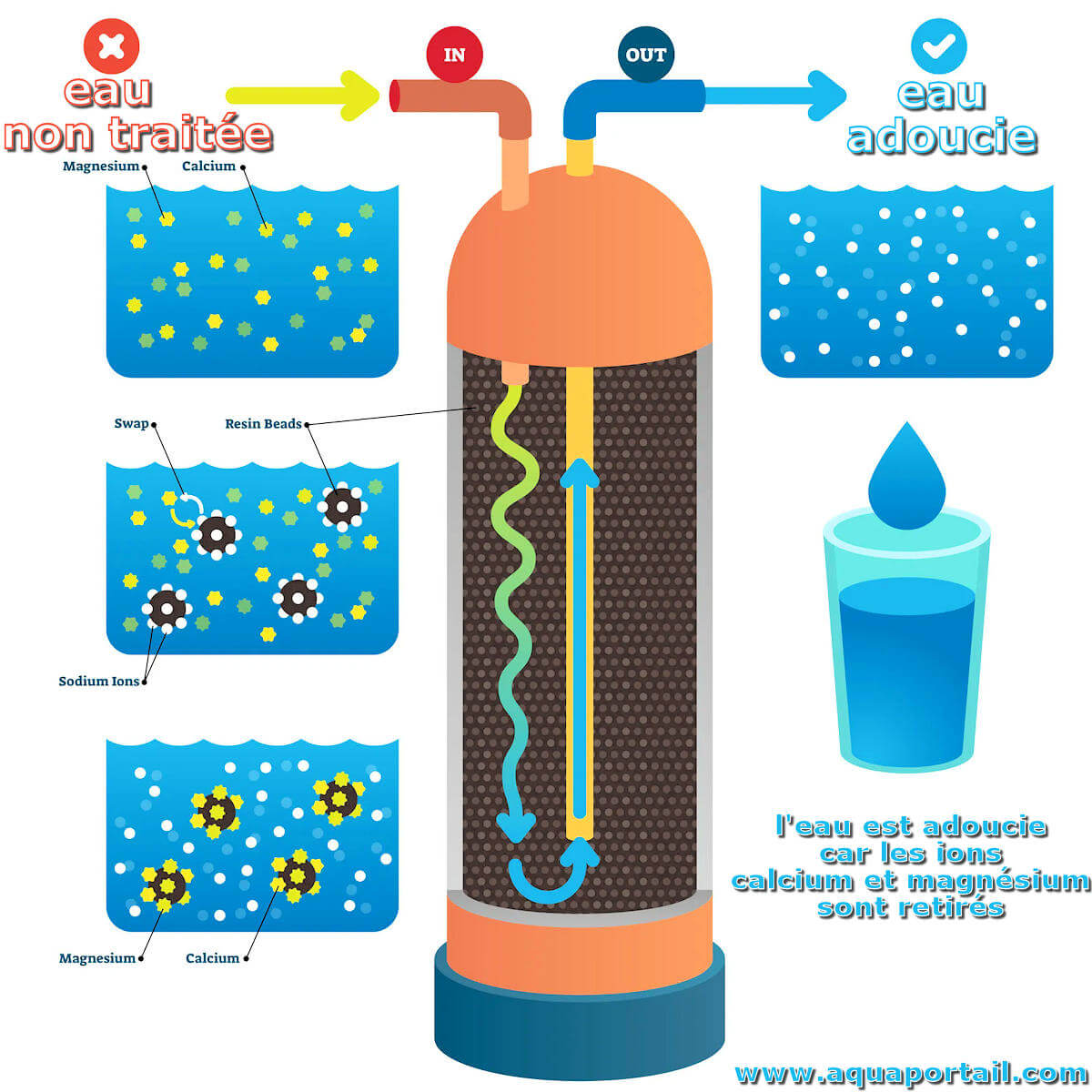
L'eau adoucie est une eau potable, typiquement une eau du robinet, ou une eau naturelle post-traitée par un adoucisseur d'eau pour abaisser sa dureté totale...

L'eau atmosphérique regroupe tous les types d'eau fournie par l'atmosphère : précipitations (eau de pluie), neige, brouillard, brume et toute humidité...

L'eau osmosée est une eau obtenue avec un osmoseur, donc différente de l'eau distillée ou de l'eau déminéralisée.

L'eau pure est de l'eau douce ne contenant que la molécule H₂O et aucun autre élément chimique, et sanitairement potable en étant exempte de virus...
