Tension superficielle
Définition
La tension superficielle est le phénomène de la surface d'un liquide qui se comporte comme une membrane élastique tendue. Les forces de cohésion entre les molécules liquides sont responsables de ce phénomène.
Schéma de la tension superficielle d'un liquide :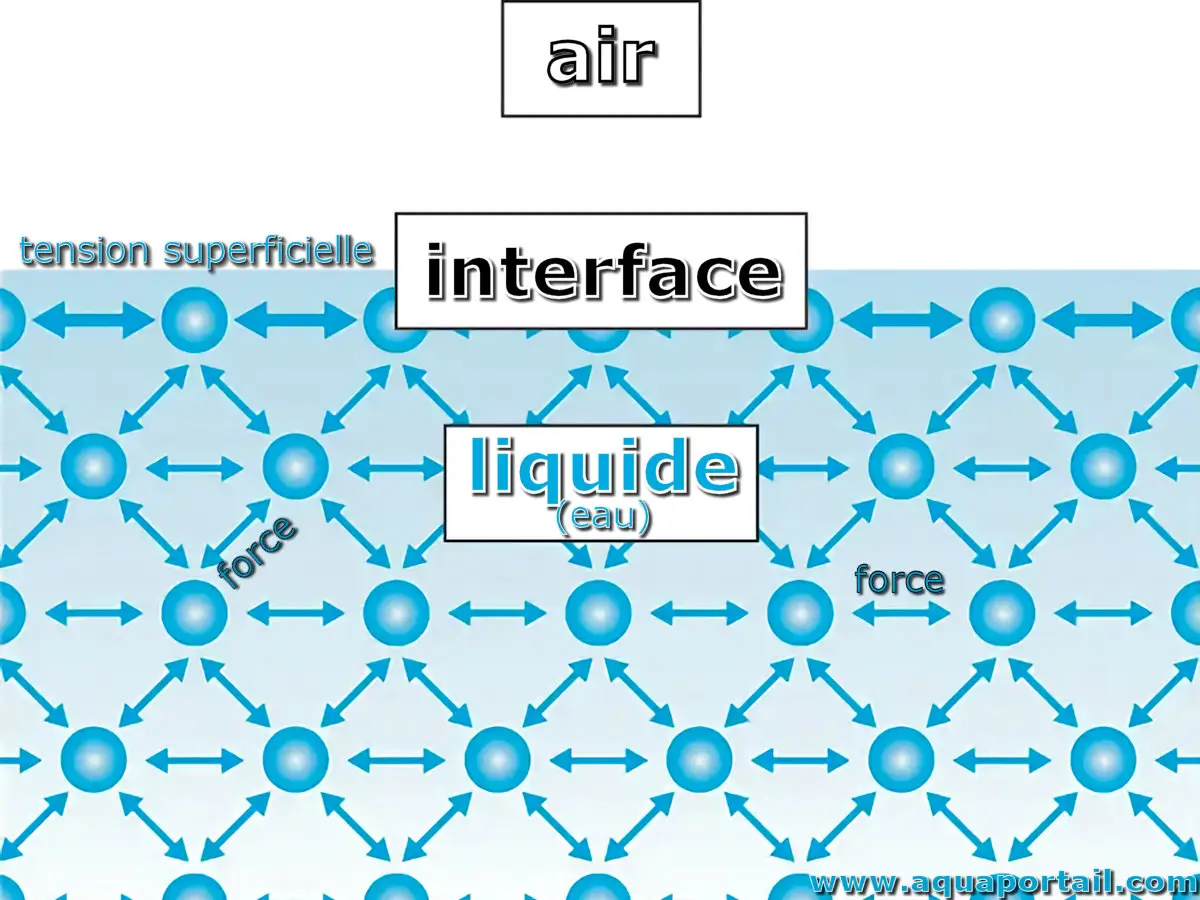
La tension superficielle d'un liquide s'applique à l'interface liquide/air. La tension superficielle provient des interactions cohésives entre les molécules d'un liquide.
Explications
Les tensions superficielles sont issues de forces attractives exercées sur les molécules superficielles d'un liquide par les molécules situées en dessous, qui tend à attirer les molécules de la surface dans la masse du liquide.
La tension superficielle d'un liquide résulte d'un déséquilibre des forces d'attraction intermoléculaires, c'est-à-dire des forces de cohésion entre les molécules : une molécule présente dans le liquide subit des forces de cohésion avec d'autres molécules dans toutes les directions. Une molécule à la surface d'un liquide ne subit que des forces de cohésion nettes vers l'intérieur.
La tension superficielle s'observe dans la forme quasi sphérique des petites gouttes de liquide (et des bulles de savon). Grâce à cette propriété, certains insectes peuvent se tenir debout à la surface de l'eau.
Un insecte Gerridae marche grâce la tension superficielle de l'eau :
Les insectes de la famille Gerridae, et notamment le patineur Gerris lacustris, semble marcher sur l'eau grâce au phénomène de tension superficielle de l'eau.
La condensation des gouttelettes d'eau (pluie) et du brouillard sur les surfaces est fonction de la tension superficielle de l'eau. Sans cette propriété, l'eau serait une couche visqueuse et les cellules n'auraient pas de forme. La tension superficielle diminue avec la température et la salinité.
Valeurs des tensions superficielles :
Tableau des tensions superficielles pour différents liquides à diverses températures. L'interface est avec l'air.
lire plus de détails pour la tension superficielle d'un liquide...
Synonymes, antonymes
Voir tous les synonymes pour "tension superficielle".1 synonyme (sens proche) de "tension superficielle" :
- tension de surface
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à TENSION SUPERFICIELLE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression TENSION SUPERFICIELLE est dans la page 1 des mots en T du lexique du dictionnaire.
Mots en T à proximité
ténia ténifuge téniocyste tennessinetensioactif tension superficielletentacule tentacule répulsif tentillum tentoriumténuiflore
En rapport avec "tension superficielle"

Les eaux superficielles qualifient toutes les eaux naturellement ouvertes sur l'atmosphère, y compris les fleuves, les rivières, les lacs, les réservoirs...

La force de van der Waals est une force à courte portée existant à la fois dans les phases gazeuse et liquide en raison de la fluctuation des nuages...
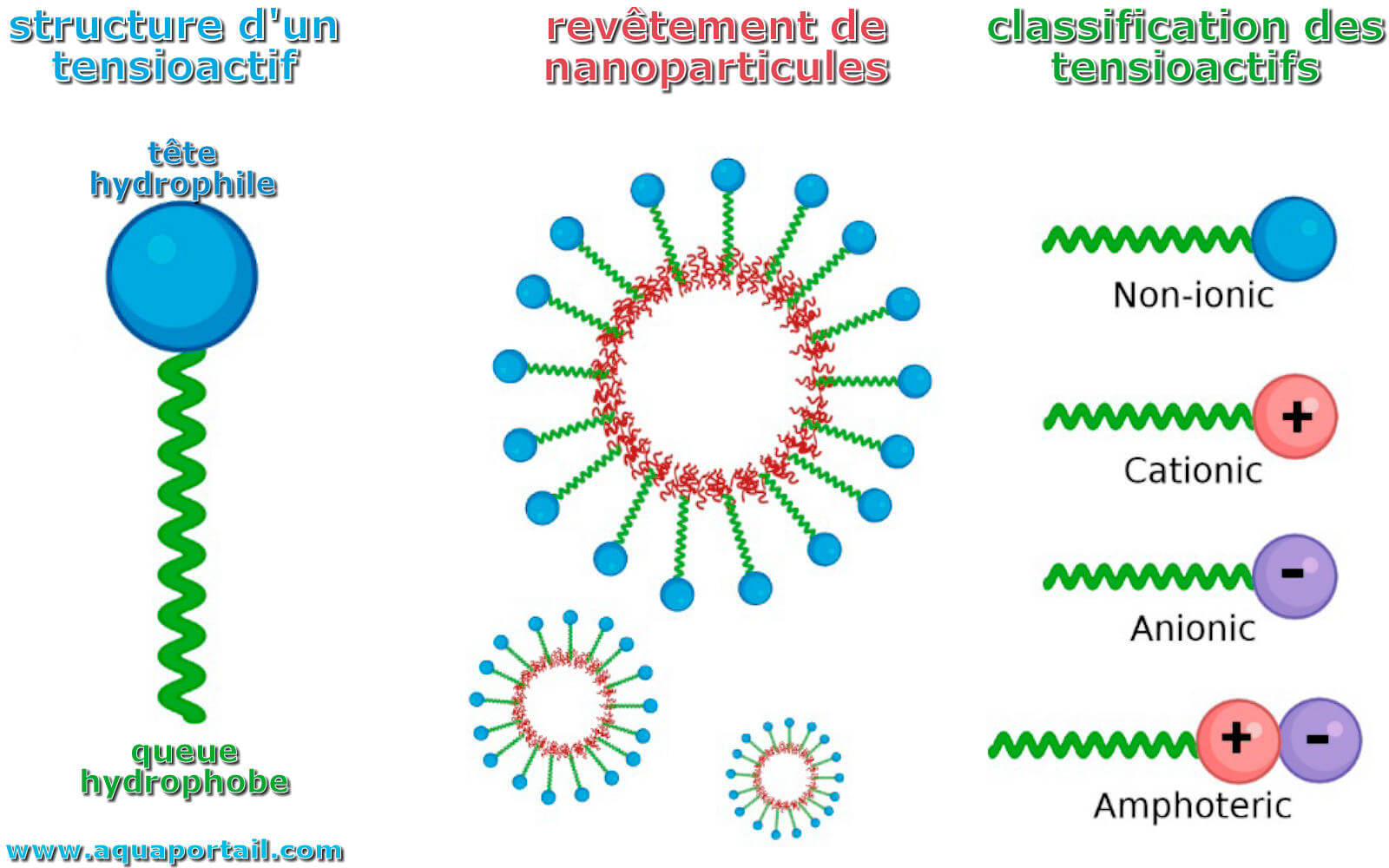
Un tensioactif est un agent de surface (surfactant) qui peut réduire la tension superficielle d'un liquide par solubilisation.
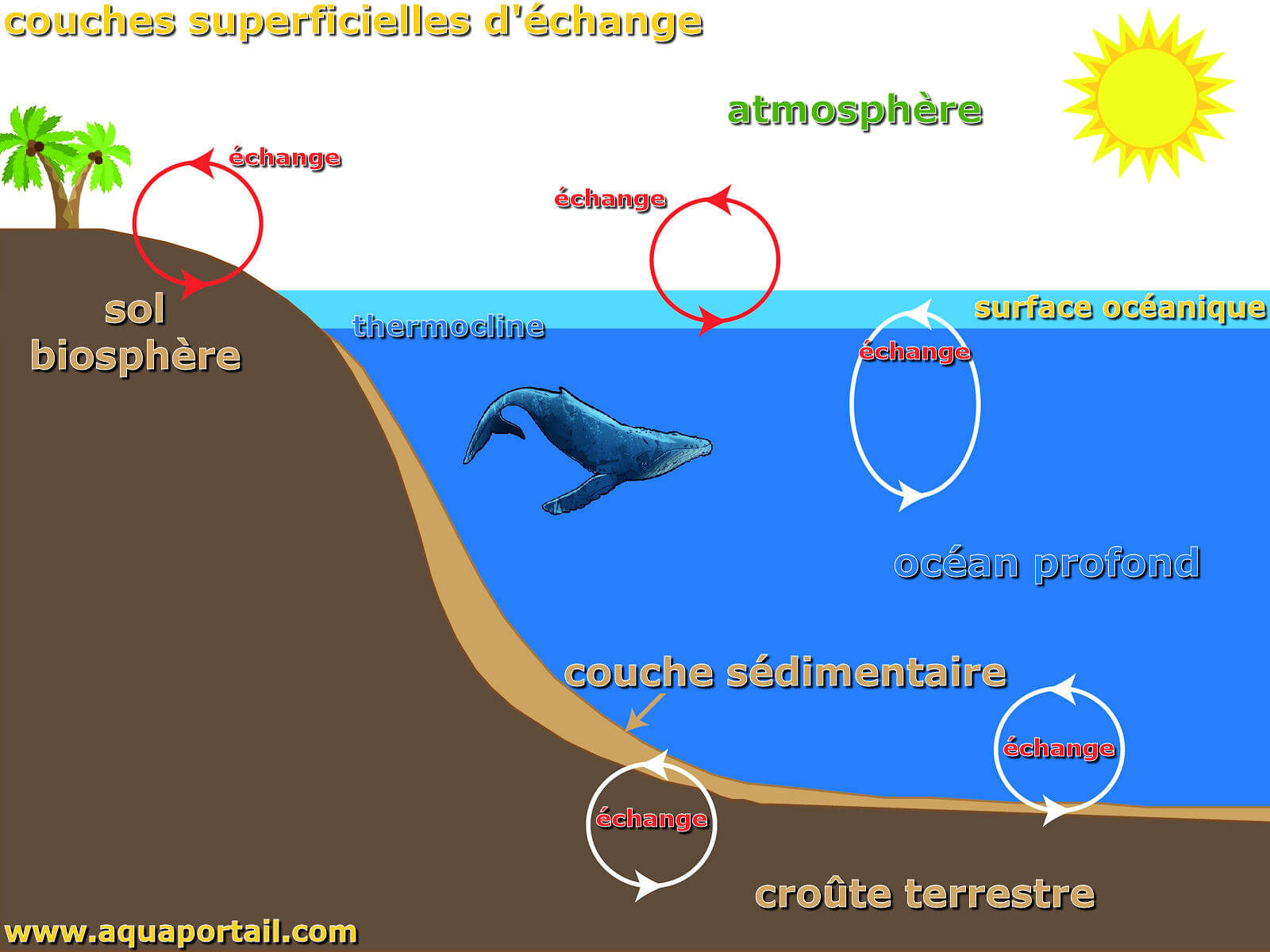
La couche superficielle est une mince épaisseur correspondant à l'interface de jonction de deux éléments de nature différente, généralement entre un liquide...
