Lipidation
Définition
La lipidation est une modification traductionnelle importante des protéines dans laquelle les fractions lipidiques sont attachées de manière covalente aux protéines. La lipidation augmente considérablement l'hydrophobicité des protéines. Cela entraîne des modifications des protéines dans leur conformation, leur stabilité, leur association membranaire, leur localisation, leurs trafic et affinité de liaison, jusqu'à leurs co-facteurs.
Processus de lipidation des protéines :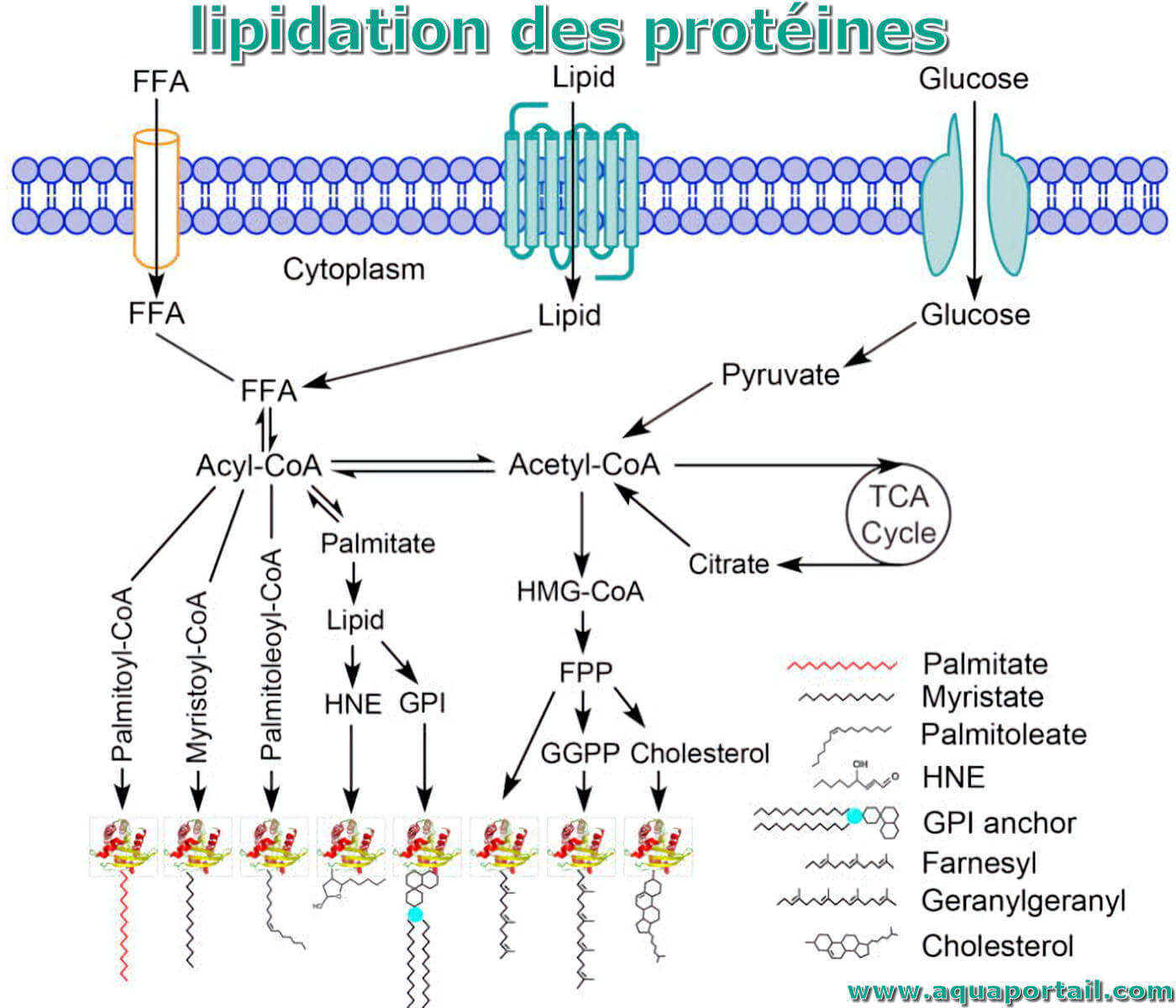
La lipidation des protéines lie le métabolisme des lipides à la régulation des fonctions protéiques. Légende : (FFA : acide gras libre; HNE : 4-hydroxynonénal; GPI : glycosylphosphatidylinositol; FPP : pyrophosphate de farnésyle; GGPP : pyrophosphate de géranylgéranyle; Cycle TCA : cycle de l'acide tricarboxylique ou cycle de Krebs).
Explications
Divers lipides et métabolites lipidiques servent de fractions de lipidation protéique. Les concentrations intracellulaires de ces lipides et de leurs dérivés sont étroitement régulées par le métabolisme cellulaire.
Par conséquent, la lipidation des protéines lie la sortie du métabolisme cellulaire à la régulation de la fonction protéique. Il est important de savoir que la dérégulation de la lipidation des protéines a été liée à diverses maladies, notamment des troubles neurologiques, des maladies métaboliques et des cancers.
Des progrès récents ont eu lieu dans la compréhension de la lipidation des protéines, en particulier la S-palmitoylation et l'acylation graisseuse de la lysine. Ces modifications sont connues pour la régulation des protéines, la signalisation cellulaire et les maladies. Des applications thérapeutiques peuvent en découler.
Les protéines peuvent être modifiées par au moins 6 types de lipides, y compris les acides gras saturés et insaturés (palmitate, myristate et palmitoléate, etc.), les isoprénoïdes (farnésyle et géranylgéanyle), les ancres GPI, les cholestérols, les phospholipides (non montrés ici) et les électrophiles dérivés des lipides (HNE, etc.). Le métabolisme cellulaire des lipides affecte la disponibilité de l'acyl-CoA gras et d'autres dérivés lipidiques, qui sont utilisés comme substrats pour la lipidation des protéines. L'acide gras 16-carbone, le palmitate, est un intermédiaire essentiel pour la biosynthèse d'autres lipides dans les cellules.
Lipidation des protéines
La lipidation des protéines est une modification co-traductionnelle ou post-traductionnelle unique qui joue un rôle essentiel dans la signalisation cellulaire et régule dynamiquement les fonctions des protéines en réponse aux signaux extrinsèques et intrinsèques.
La lipidation module la fonction des protéines ciblées en augmentant leur affinité de liaison aux membranes biologiques, en changeant rapidement leurs localisations subcellulaires, en affectant le repliement et la stabilité, et en modulant l'association avec d'autres protéines. Les protéines peuvent être modifiées de manière covalente par au moins six types de lipides, y compris les acides gras, les isoprénoïdes, les stérols, les phospholipides, les ancrages de glycosylphosphatidylinositol (GPI) et les électrophiles dérivés des lipides (LIDE).
Les acides gras, tels que le palmitate de 16 carbones, sont des éléments constitutifs de la biosynthèse d'autres molécules lipidiques complexes dans les cellules, et leurs concentrations intracellulaires sont étroitement régulées. Le palmitate est biosynthétisé par des réactions de condensation entre l'acétyl-CoA et le malonyl-CoA catalysées par le complexe de l'acide gras synthase (FASN). L'acétyl-CoA est généré à partir du pyruvate et du citrate, par l'intermédiaire de la pyruvate déshydrogénase et de l'ATP citrate lyase, respectivement.
Le malonyl-CoA est synthétisé par l'acétyl-CoA carboxylase (ACC). L'acétyl-CoA et le malonyl-CoA sont tous deux des sous-produits du métabolisme du glucose et du cycle de Krebs. L'ACC est directement régulé par un régulateur métabolique cellulaire et un capteur d'énergie, la protéine kinase activée par l'AMP (AMPK).
Par conséquent, la biosynthèse lipidique est directement impliquée dans l'homéostasie de l'énergie cellulaire. La dérégulation du métabolisme des lipides joue un rôle de premier plan dans les maladies humaines. Cependant, le mécanisme détaillé reliant la dérégulation du métabolisme des lipides à la signalisation cellulaire et à la maladie reste insaisissable. Il est possible que des altérations du métabolisme des lipides puissent affecter la disponibilité des donneurs de lipides, affectant ainsi les niveaux globaux de lipidation des protéines. La lipidation des protéines peut contribuer en partie aux conséquences pathologiques du métabolisme des lipides mal régulé, comme dans les cancers et les maladies métaboliques. Il est important de comprendre les mécanismes de régulation détaillés, les fonctions et la pertinence pathologique de la lipidation des protéines, ce qui conduira finalement à de nouvelles thérapies.
Diversité de la lipidation
Les acides gras saturés et insaturés peuvent se fixer aux résidus de cystéine, de sérine ou de lysine des protéines, dans un processus connu sous le nom d'acylation graisseuse. Le myristate de 14 carbones peut être attaché à la glycine N-terminale, catalysée par les N-myristyle transférases (NMT) en tant que modification co-traductionnelle stable et irréversible. Des études protéomiques chimiques récentes suggèrent que plus de 100 protéines sont myristoïlées dans les cellules humaines. En règle générale, la myristoylation améliore l'association protéine-membrane nécessaire à la localisation et à la fonction biologique de la protéine cible. La S-palmitoylation (ou S-acylation) est une autre forme majeure d'acylation grasse, dans laquelle le palmitate de 16 carbones (ou d'autres acides gras, par exemple, l'acide stéarique à 18 carbones) sont attachés aux résidus de cystéine.
En raison de la nature labile de la liaison thioester, la S-palmitoylation est réversible, et les protéines S-palmitoylées peuvent subir des cycles d'acylation et de désacylation en réponse à des signaux en amont. De plus, les groupes gras-acyle peuvent être attachés à des résidus de sérine (O-palmitoylation) ou au N-terminus (appelé N-palmitoylation). À ce jour, seules quelques protéines sont connues pour être O- ou N-palmitoylées. Par exemple, les protéines Wnt sont modifiées sur un résidu de sérine conservé par un acide gras monoinsaturé, l'acidecis-palmitoléique (C16 :1Δ9), médié par une O-acyltransférase liée à la membrane appelée Porc-épic, (Clevers et Nusse, 2012). L'histone H4 peut être palmitoylée à Ser45 par la lysophosphatidylcholine acyltransférase 1 (LPCAT1). Le groupe octanoyle 8-carbone peut modifier le résidu de sérine du peptide de signalisation ghréline par la ghréline O-acyltransférase (GOAT). Les protéines de hérisson (Hh) sont des exemples de protéines N-palmitoylées, où la terminaison N du peptide de signalisation est palmitoylé, catalysée par l'acyltransférase du hérisson (HHAT)(Buglino et Resh, 2008).
La modification des protéines par les isoprénoïdes est connue sous le nom de prénylation. La plupart des protéines prénylées contiennent un motif CAAX à leur terminus carboxyle, dans lequel le résidu de consensus Cys est modifié par les groupes farnésyl (15-carbone) ou géranylgéranyl (20-carbone) par farnésyltransférase (FTase) ou géranylgéranyltransférase I (GGTase I), respectivement. La famille de protéines Ras, y compris K-, H- et N-Ras, sont des protéines prénylées bien étudiées. La prénylation est généralement considérée comme une modification irréversible, qui modifie l'affinité membranaire des protéines.
La modification covalente des protéines par les cholestérols est rare. À ce jour, les seules protéines bien caractérisées modifiées par le cholestérol sont les protéines de hérisson avec lesquelles le cholestérol forme une liaison ester à la glycine C-terminale du peptide de signalisation clivé. Récemment, des sondes chimiques ont été développées pour identifier d'autres protéines modifiées par le cholestérol. Smoothened (SMO), le co-récepteur de la voie Hh, est le cholestérol modifié sur l'Asp95.
Rôle des phospholipides
Les phospholipides jouent un rôle essentiel dans la formation de la membrane et la transduction du signal. Cependant, la modification des protéines phospholipides est rare. Le seul exemple connu est la protéine atg8/LC3 liée à l'autophagie, qui est modifiée par la phosphatidyléthanolamine (PE). Cette modification est médiée par des processus de conjugaison en plusieurs étapes et est essentielle à la formation de la double membrane de l'autophagosome.
L'ancre GPI est un glycolipide complexe qui peut être attaché de manière covalente à la terminaison C des protéines en tant que modification post-traductionnelle. Les IPG sont synthétisés dans le réticulum endoplasmique (RE) en ajoutant séquentiellement des monosaccharides, des groupes acyles et des résidus de phosphoéthanolamine au phosphatidylinositol. La fixation du GPI à la protéine médiée par le complexe transamidase GPI. Environ 1 % des protéines eucaryotes sont modifiées par des ancres GPI. En plus de son rôle dans le ciblage des protéines sur la membrane, l'ancre GPI a de nombreuses autres fonctions biologiques, telles que la médiation de la réponse immunitaire et de l'inflammation, en fonction de la composition structurelle GPI.
Les électrophiles dérivés des lipides (LIDE) sont des métabolites lipidiques réactifs produits par la peroxydation lipidique ou d'autres voies métaboliques via des mécanismes non enzymatiques et enzymatiques. Les LDE connus comprennent la 4-hydroxy-2-nonenal (HNE), la 15-désoxy-Δ12, la 14-prostaglandine J2 (15d-PGJ2) et la 2-trans-hexadécénienne (2-HD), etc. Les LDO sont capables de former des adductions covalentes avec des résidus nucléophiles de protéines, telles que la cystéine, la lysine et l'histidine via l'addition de Michael. Une mauvaise régulation du métabolisme des lipides conduit souvent à l'accumulation de LDE, qui sont impliqués dans diverses conditions pathologiques, telles que l'inflammation, la génotoxicité et la dégénérescence tissulaire.
Par conséquent, la lipidation des protéines peut réguler de nombreuses fonctions biologiques clés des protéines grâce à divers types de lipides et de métabolites lipidiques. Cependant, il a été difficile d'étudier la fonction spécifique et la régulation de la lipidation des protéines dans des conditions physiologiques et pathologiques en raison du manque d'outils et de méthodes. Plusieurs revues récentes ont discuté des fonctions de la prénylation des protéines, de la myristoylation, des modifications du GPI. En raison de la limitation de l'espace, plutôt que de l'importance, nous discuterons ici brièvement des différentes méthodes d'étude de la lipidation des protéines, puis nous nous concentrerons principalement sur la fonction, la régulation et les cibles thérapeutiques potentielles de l'acylation grasse des protéines, en particulier la S-palmitoylation des protéines, pour laquelle de nouveaux progrès passionnants pour comprendre ses fonctions ont été réalisés ces dernières années.
Synonymes, antonymes
Voir tous les synonymes pour "lipidation".0 synonyme (sens proche) pour "lipidation".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à LIPIDATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot LIPIDATION est dans la page 2 des mots en L du lexique du dictionnaire.
Mots en L à proximité
lion lion de mer lionceau lionne lipase lipidationlipide lipide A lipidique lipocortine lipocyte
En rapport avec "lipidation"

Le catabolisme des lipides est un processus de dégradation dans le métabolisme des lipides qui comprend deux étapes majeures spatialement et temporairement...

Un galactolipide désigne tout lipide complexe comportant un galactose. Les galactolipides sont un groupe de substances chimiques composées de sucre, d'une...

Le glycérophospholipide (phosphoglycéride) est un glycéride dont deux fonctions alcool sont estérifiées par des acides gras et la troisième par un acide...
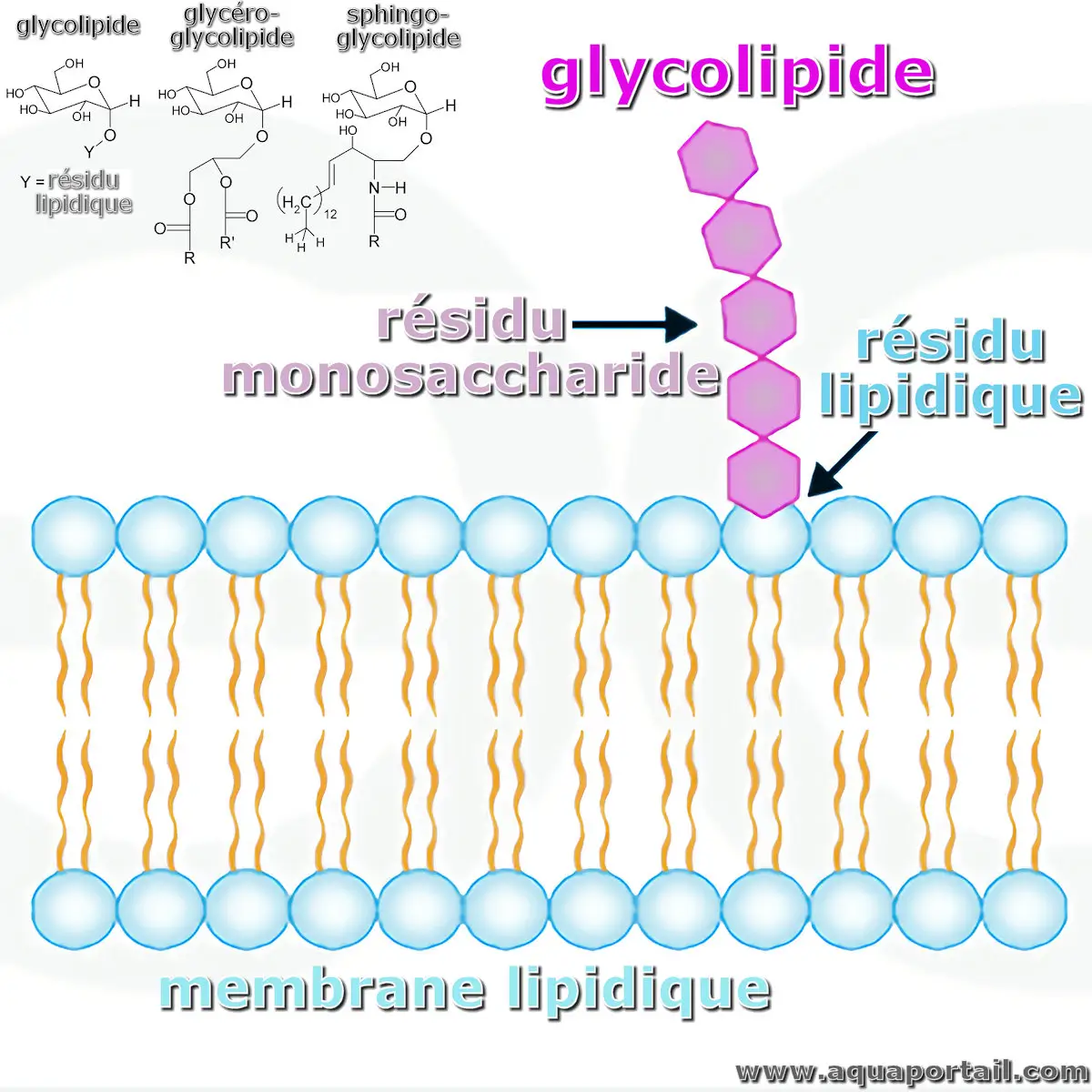
Un glycolipide est un type de lipide complexe comprenant des glucides, des acides gras, une sphingosine ou un groupe glycérol.
