Autophagie
Définition
L'autophagie, par opposition à l'hétérophagie, est une autodisgestion d'organites cellulaires par fusion avec les lysosomes pour former des autophagolysosomes (autophagosome et autolysosome). Ce processus permet le renouvellement naturel des organites. L'autophagie sert de médiateur de l'homéostasie cellulaire et de la survie cellulaire.
Dans un autre sens, l'autophagie qualifie la résorption d'organes qui ne sont pas indispensables à la survie de l'animal, dans le but de fournir un apport de nutriments et d'énergie en période de dénutrition.
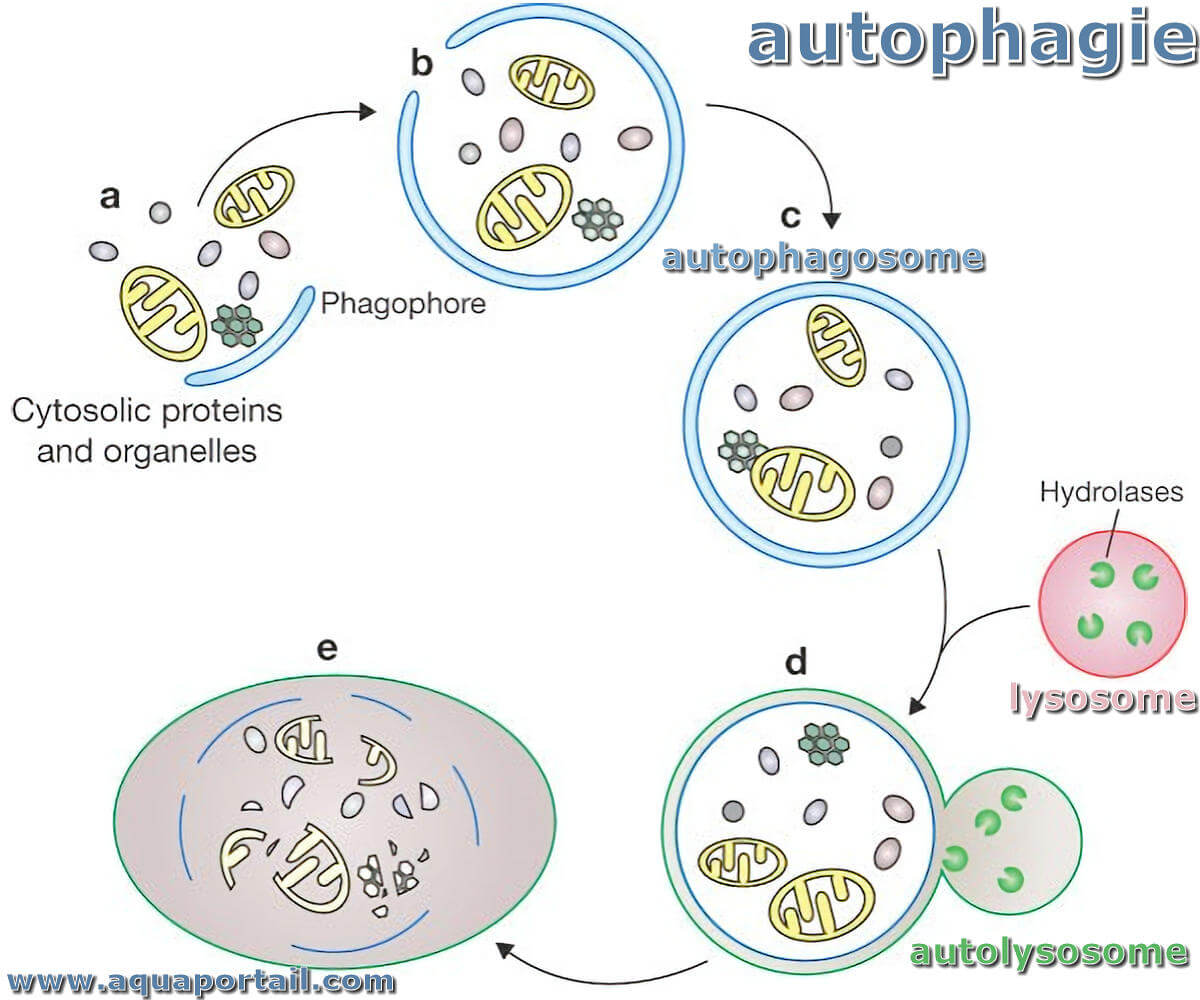
Processus d'autophagie (macroautophagie) :
Représentation schématique de l'autophagie.
Explications
Dans le cas d'une vacuole, il peut exister une vacuole autophagique (notamment chez certaines algues).
Voir aussi la mitophagie.
Introduction et explications
L'autophagie fonctionne comme un processus de maintien de l'homéostasie cellulaire hautement intégré. En raison de son rôle centralisé en tant que système d'entretien ménager et de surveillance du stress cellulaire, ses effets opérationnels dans tout type de cellule varient au cas par cas.
Un bel exemple de ce concept est vu en regardant la relation de l'autophagie avec le cancer. Selon la nature d'un type de cellule cancéreuse ou le stade de développement d'un cancer, l'autophagie peut agir soit comme un promoteur ou un suppresseur du cancer.
Christian de Duve, un biochimiste lauréat du prix Nobel a d'abord été crédité du nom d'autophagie. Le terme autophagie dérive du mot-racine grec auto (auto) manger (phagie) en raison de ses actions ménagères intracellulaires.
Comme l'apoptose, l'autophagie est un processus de mort cellulaire programmée génétiquement contrôlé/conservé de manière évolutive. L'autophagie est surtout connue pour ses actions de survie cellulaire; permettant la survie des cellules dans des conditions de privation de nutriments. Dans un sens plus large, l'autophagie joue le rôle essentiel d'aider les cellules à survivre à des périodes prolongées d'un large éventail de conditions de stress physiologique. Certains des facteurs de stress les plus connus comprennent la privation de nutriments, les facteurs de stress liés au métabolisme tels que la production de ROS, l'hypoxie et les protocoles de traitement anticancéreux.
D'autre modes de mort cellulaire sont la pyroptose, la parthanatose et la nécroptose (en plus de l'apoptose).
Assemblage de l'autophagosome
L'autophagie repose sur l'assemblage d'une structure d'enceinte de membrane intracellulaire à travers laquelle des composants intracellulaires endommagés ou vieillissants peuvent être rassemblés pour le traitement de l'autolysosome.
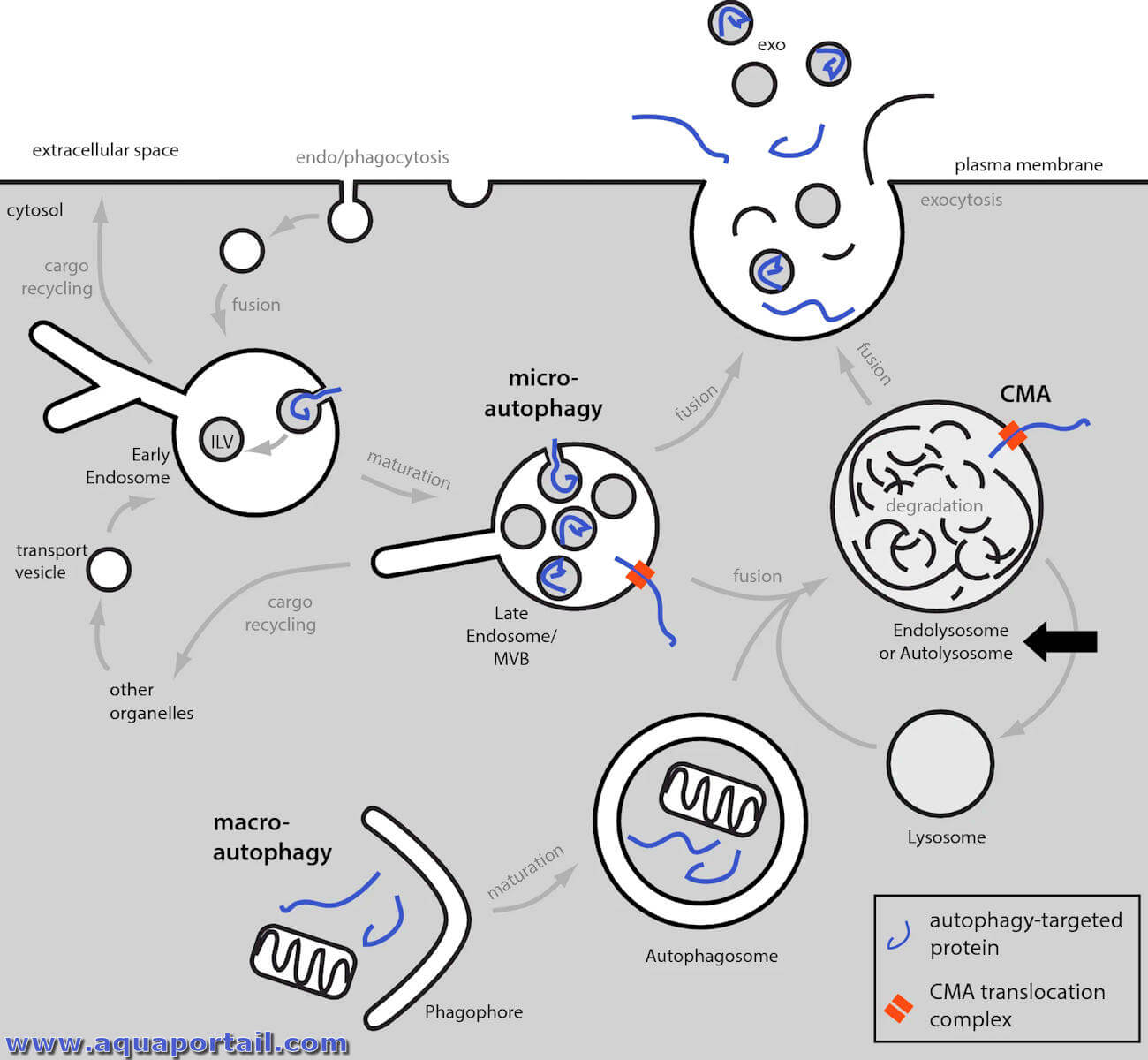
Actuellement, trois formes différentes d'autophagie ont été identifiées et différenciées par les moyens par lesquels le contenu de cytosol capturé est présenté au lysosome. Ces trois formes ont été classées comme suit :
- macroautophagie,
- microautophagie,
- et autophagie à médiation.
La macroautophagie, la forme d'autophagie la plus abondante et la mieux étudiée, est généralement appelée simplement autophagie dans la littérature publiée. L'assemblage de l'autophagosome implique un processus d'assemblage en plusieurs étapes.
Cela commence par la création d'une membrane d'isolement ou d'un autophagophore.Les autophagophores sont nucléés au niveau d'un domaine membranaire de gestion du réticulum endoplasmique (ER) enrichi pour le lipide phosphatidylinositol 3-phosphate (PI3P), connu sous le nom d'omégasome. L'encerclement complet de cette structure avec un contenu cytosolique capturé conduit à la formation d'un autophagosome.
Cette structure enfermée à deux couches lipidiques peut fusionner (fusionner) avec un lysosome chargé d'enzymes formant un autolysosome. L'incorporation d'hydrolases d'origine lysosomale facilite la décomposition de la cargaison autolysosomale, complétant le processus de recyclage des composants.
Ciblage sélectif et non sélectif des composants cytosoliques
Il existe deux types d'autophagie : l'autophagie basale continue et l'autophagie inductible. L'autophagie au niveau basal est un processus de ménage constitutif pour l'élimination des composants cellulaires ou organites périmés ou défectueux. L'autophagie inductible agit comme la réponse de la cellule à divers types de facteurs de stress. Certains de ces facteurs de stress comprennent les carences en nutriments ou en énergie cellulaire, le stress oxydatif, l'hypoxie ou, du point de vue du traitement du cancer, le stress cytotoxique émanant de la chimiothérapie.
Les types d'autophagie inductibles peuvent être subdivisés en ciblage autophagique sélectif et non sélectif. Dans le cas de l'autophagie non sélective, l'objectif principal est de récolter un spectre générique de cytoplasme intracellulaire et de contenu en composants organites dans le but de soutenir les activités métaboliques pour inclure la production d'énergie. En revanche,des formes sélectives d'autophagie ciblent des organites intracellulaires spécifiques ou une structure membranaire-protéine. L'action d'autophagie utilisant ce processus sélectif plus précis fournit à la cellule un moyen de limiter l'élimination des organites aux organites qui sont endommagés au-delà de la fonction normale.
Bien que l'action de ciblage implique une certaine forme de processus d'ubiquitination, le stimulus de signalisation réel semble varier avec l'organite impliqué. Le marquage à l'ubiquitine des protéines cibles leur permet d'être identifiées et liées par des récepteurs d'autophagie à l'aide de LC3/Atg8 pour leur incorporation dans les autophagosomes. Le flux autophagique est un terme général utilisé pour définir le taux d'activité de dégradation intracellulaire médiée par l'autophagosome en réponse à ou associée à une situation physiologique particulière.
Régulation de l'autophagie
Au cours de la dernière décennie, on a beaucoup appris sur les mécanismes complexes par lesquels l'autophagie est régulée. mTOR (cible mécaniste de la rapamycine), une sérine/thréonine kinase conservée de façon évolutive, agit comme un régulateur central des processus anaboliques et cataboliques cellulaires. Celles-ci incluent des signaux de surveillance émanant à la fois des emplacements intracellulaires et extracellulaires. Nommée pour sa sensibilité à l'agent anticancéreux, la rapamycine, cette kinase sensible aux nutriments, est essentielle pour contrôler le processus d'initiation de l'autophagie.
mTOR existe sous deux formes biologiquement actives différentes : mTORC1 et mTORC2. Chaque forme représente un complexe multiprotéique distinct ayant des activités de régulation différentes.
mTORC1 est impliqué dans le sens de la prolifération cellulaire alors que le mTORC2, moins bien compris, semble avoir des directives sur la survie cellulaire et l'organisation du cytosquelette. En utilisant l'exemple de réponse de déplétion en nutriments souvent utilisé, pendant des conditions d'épuisement en nutriments, l'activité de mTORC1 est inhibée. L'inhibition de mTORC1 conduit à une déphosphorylation de la kinase 1 de type unc-51 (ULK) et à une activation ultérieure.
L'activation de l'ULK1 sert de régulateur positif de la formation d'autophagosomes. mTORC1 est régulé par la protéine kinase activée par l'AMP (AMPK). L'inhibition de mTORC1 avec une activité AMPK accrue conduit à une augmentation du processus autophagique.
En période d'abondance de nutriments, mTORC1 se lie librement à et phosphoryle ULK1, interférant avec sa capacité à se lier à la protéine kinase activée par l'AMP (AMPK), conduisant à l'inhibition de l'autophagie.
Maladies défectueuses associées à l'autophagie
Le rôle central de l'autophagie dans la régulation et le maintien de l'homéostasie cellulaire laisse présager son implication dans le contrôle d'un large éventail de fonctions cellulaires critiques. La logique dicterait alors que tout défaut de performance dans les fonctions d'activité étendues de l'autophagie se manifesterait à travers un large éventail d'états de maladies humaines.
Ainsi, la croyance initiale selon laquelle la fonction principale de l'autophagie était d'agir comme un mécanisme de médiation par déficit en nutriments pour la survie cellulaire pendant les cycles de privation de nutriments était grossièrement incomplète. En raison de notre intérêt à limiter notre discussion aux mécanismes généraux propulsant les processus autophagiques, ainsi qu'au rôle que joue l'autophagie dans le traitement du cancer, nous avons limité nos pathologies des défauts d'autophagie aux maladies les plus importantes d'origine autophagie.
Certains d'entre eux comprennent les maladies neurodégénératives, les maladies cardiaques,pathologies auto-immunes / inflammatoires (maladies inflammatoires de l'intestin, maladie de Crohn, diabète, obésité, lupus) et cancer.
Conclusions
Les premières impressions du rôle de l'autophagie en tant que mécanisme de survie cellulaire pendant une carence en nutriments ont évolué au cours des quinze dernières années, attribuant par la suite à l'autophagie un rôle central dans un large éventail d'activités physiologiques. Cela comprend des rôles importants dans les processus de développement, y compris le développement des organes.
L'autophagie continue d'être reconnue pour son rôle important en tant que mécanisme de réponse au stress cellulaire centralisé. En fournissant aux cellules un moyen d'étendre les ressources intracellulaires disponibles en recyclant des composants cellulaires non essentiels ou obsolètes, l'acquisition d'un processus d'autophagie opérationnelle a joué un rôle critique dans l'évolution des formes de vie supérieures. Le recyclage des composants intracellulaires permet la production continue de sources d'énergie sans lesquelles la vie ne peut exister.
Malheureusement, une conséquence négative des processus autophagiques réside dans leurs actions pour favoriser la croissance du cancer humain. En plus de fournir aux cellules cancéreuses un moyen de survivre aux carences en nutriments, l'autophagie fournit également un moyen par lequel les cellules tumorales à croissance rapide, ayant besoin de ressources énergétiques supplémentaires, peuvent maintenir leur taux de croissance rapide. De plus, l'acquisition de phénotypes MDR dans les cellules cancéreuses peut également être attribuée à l'autophagie.
Ensemble, ces attributs associés à l'autophagie font de la lutte contre les cancers humains une entreprise beaucoup plus difficile.
Synonymes, antonymes
Voir tous les synonymes pour "autophagie".2 synonymes (sens proche) de "autophagie" :
- macroautophagie
- microautophagie
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à AUTOPHAGIE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot AUTOPHAGIE est dans la page 9 des mots en A du lexique du dictionnaire.
Mots en A à proximité
autologue autolyse automixie automne autonymie autophagieautophagosome autoplastie autoploïde autopode autopollinisation
En rapport avec "autophagie"

L'hétérophagie est une caractéristique importante de certains types de cellules (par exemple les macrophages), mais dans certaines cellules, telles...
Un autophagosome est une structure sphérique à double membrane, une vacuole. Après leur formation, les autophagosomes cèdent ces composants cytoplasmiques...
Un endolysosome qualifie un organite cytoplasmique résultant de la fusion entre un lysosome et une vésicule d'endocytose, un endosome.

Un lysosome est un organite vésiculaire entouré d'une membrane, contenant des hydrolases impliquées dans les digestions intracellulaires.
