Mitophagie
Définition
La mitophagie est un processus cellulaire qui élimine sélectivement les mitochondries vieillies et endommagées via la séquestration et l'engloutissement spécifiques des mitochondries pour une dégradation lysosomale ultérieure. Elle joue un rôle central dans le rétablissement de l'homéostasie cellulaire dans la physiologie normale et les conditions de stress.
Le processus de mitophagie :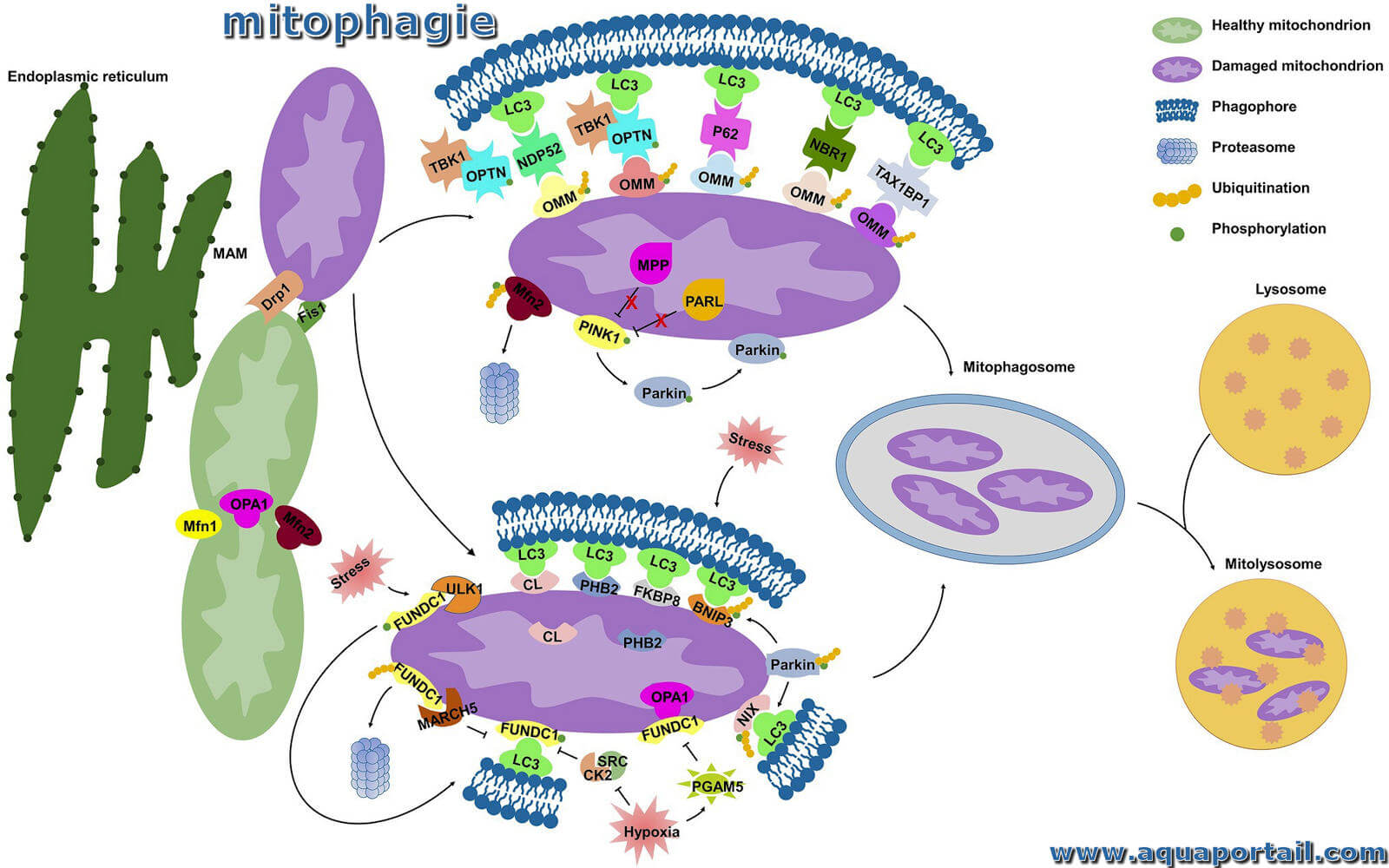
Mécanismes moléculaires de la mitophagie. Sous stress cellulaire, la protéine 1 liée à la dynamine (Drp1) est recrutée du cytoplasme vers les mitochondries au niveau de la membrane du réticulum endoplasmique (RE) associée à la mitochondrie (MAM), tandis que la fusion mitochondriale est régulée par la mitofusine 1 (Mfn1), la mitofusine 2 (Mfn2), et l'atrophie optique 1 (OPA1) est inhibée, qui dissocient les mitochondries du RE et interagissent avec la fragmentation mitochondriale, initiant le processus de mitophagie.
Explications
La mitophagie est une voie autophagique qui régule le nombre de mitochondries pour correspondre au nombre de demandes métaboliques. Ainsi, le processus maintient le contrôle de la qualité pour éliminer exclusivement les mitochondries endommagées.
La mitophagie est un processus conservé au cours de l'évolution pour éliminer sélectivement les mitochondries endommagées ou inutiles via la machinerie autophagique.
La mitophagie contribue à l'homéostasie cellulaire dans des contextes physiologiques et pathologiques. Il peut y avoir diaphonie entre la mitophagie et la maladie rénale, soulignant sa modulation en tant que stratégie thérapeutique potentiellement efficace pour traiter les maladies rénales telles que l'insuffisance rénale aiguë (IRA), l'insuffisance rénale diabétique (IRD) et la néphrite lupique.
Importance
Les mitochondries sont des organites essentiels qui régulent le métabolisme cellulaire, l'homéostasie et les réponses au stress. La mitophagie, un processus par lequel les mitochondries dysfonctionnelles ou superflues sont sélectivement éliminées par autophagie, est le mécanisme central du contrôle de la qualité et de la quantité des mitochondries.
Les progrès récents dans les études sur la mitophagie ont révélé que l'amorçage mitochondrial est médié par la voie de signalisation de la kinase 1 induite par la phosphatase et l'homologue de la tensine (PTEN) (PINK1)/Parkin et/ou par les récepteurs de la mitophagie.
La mitophagie défectueuse a été impliquée dans diverses maladies humaines, telles que le vieillissement, les maladies neurodégénératives, les maladies cardiovasculaires et le cancer. Le rein est un organe énergétiquement exigeant et riche en mitochondries. De plus, la fonction rénale dépend fortement de la mitophagie. De nouvelles preuves suggèrent que la mitophagie aberrante ou défectueuse est au coeur de la pathologie de nombreuses maladies rénales.
Mécanismes moléculaires de la mitophagie
La mitophagie, un terme proposé pour la première fois par Lemasters (2005), fait référence à un processus par lequel les mitochondries sont sélectivement dégradées par l'autophagie, qui est devenue un mécanisme important de contrôle de la qualité et de la quantité des mitochondries.
La mitophagie est un processus mécaniquement élaboré comprenant (a) l'initiation de la mitophagie, (b) l'amorçage des mitochondries pour la reconnaissance par la machinerie d'autophagie, (c) l'engloutissement des mitochondries marquées par la formation de l'autophagosome et (d) la séquestration lysosomale et la dégradation hydrolytique. Plusieurs voies de régulation de la mitophagie sont classées en mitophagie médiée par PINK1/Parkin et mitophagie médiée par les récepteurs et sont initiées en réponse à différents stimuli.
La machinerie régulant la dynamique mitochondriale est fortement intégrée à l'initiation de la mitophagie. Les mitochondries sont des organites hautement dynamiques engagées dans des cycles répétés de fusion et de fission, qui maintiennent l'intégrité mitochondriale en facilitant le contrôle de la qualité de l'ADNmt et des protéines. La dynamique mitochondriale est régulée par les membres d'une famille de grandes GTPases conservées.
Expression des protéines mitochondriales
La mitophagie peut être quantifiée par la perte d'expression des protéines mitochondriales à l'aide d'essais d'immunoblot ou d'immunocoloration. Cette technique est utilisée pour confirmer facilement l'élimination des mitochondries, mais les changements dans les niveaux de protéines peuvent être fortement influencés, par exemple, par les voies de dégradation du protéasome et les altérations de la biogenèse. La mitophagie peut être sous-estimée en utilisant cette méthode de quantification lorsqu'une biosynthèse mitochondriale substantielle intervient simultanément.
La mesure du contenu mitochondrial utilise généralement des marqueurs de plusieurs protéines mitochondriales ou la quantification de l'ADN mitochondrial. Les premières études sur la mitophagie utilisaient la dégradation de TOM20, une protéine OMM, comme marqueur de la masse mitochondriale. Cependant, il a également été démontré que Parkin médie la dégradation dépendante du protéasome des protéines OMM, en plus de la mitophagie, par conséquent, la perte de protéines OMM seules n'est pas une mesure suffisante.
En outre, il convient de considérer que les protéines de l'espace intermembranaire peuvent être libérées après la transition de perméabilité et que le taux de renouvellement des différentes protéines de la membrane interne peut être très variable, même au sein du même complexe respiratoire. En conséquence, les tests d'expression des protéines mitochondriales doivent utiliser plusieurs protéines de différents sous-compartiments mitochondriaux pour fournir des mesures précises de la mitophagie. De même, la perte d'ADN mitochondrial peut être mesurée par PCR quantitative ou par immunocoloration à l'aide d'anticorps ADN.
L'évaluation de la mitophagie grâce à l'utilisation de marqueurs mitochondriaux est une méthode simple et quantitative pour déterminer la dégradation complète des mitochondries. Cependant, ce test quantifie le changement net du contenu mitochondrial et est donc incapable de faire la distinction entre la mitophagie et la dégradation par d'autres mécanismes qui peuvent survenir simultanément.
Mécanismes moléculaires et régulation
La mitophagie utilise la même machinerie d'autophagie de base (largement codée par les gènes liés à l'autophagie, les gènes ATG) que d'autres formes d'autophagie sélective, qu'elle soit induite par différents signaux intrinsèques (programmés génétiquement par rapport aux dommages occasionnés par le métabolisme cellulaire) ou des facteurs extrinsèques (stimuli environnementaux).
Il existe un intérêt considérable à comprendre les voies qui régulent la mitophagie dans différents types de cellules et de tissus, et les stratégies utilisées pour assurer un ciblage sélectif de la machinerie autophagique vers les mitochondries.
Les mécanismes moléculaires exacts et les voies de signalisation derrière la régulation de la mitophagie commencent seulement à être révélés. Un modèle cargo-ligand-récepteur-échafaudage a été proposé pour expliquer comment les cellules peuvent sélectionner entre différentes cargaisons telles que la mitochondrie pour la dégradation. L'identité de chacun des composants ligand-récepteur-échafaudage semble différer selon l'organisme, le type de cellule et le stimulus de la mitophagie.
Chez la levure, la mitophagie peut être associée au remodelage cellulaire qui existe lors de la transition de la croissance cellulaire et du métabolisme vers une source de carbone préférée. Par exemple, lorsque les cellules de levure sont déplacées des substrats respiratoires tels que le lactate vers le glucose, les mitochondries en excès sont dégradées.
La protéine Atg32 de la membrane externe mitochondriale (MOM) fonctionne comme un récepteur pour la mitophagie et interagit avec Atg11 (protéine d'échafaudage) et Atg8 (protéine ancrée à la membrane de l'autophagosome). Atg32 semble être le seul récepteur de la mitophagie chez la levure, bien que des protéines telles que Atg33 puissent faciliter le processus. Les événements de phosphorylation jouent un rôle clé dans la régulation de la mitophagie. Une kinase non encore identifiée phosphoryle Ser114 et Ser119 sur Atg32; le premier médiatise l'interaction Atg11–Atg32.
Synonymes, antonymes
Voir tous les synonymes pour "mitophagie".4 synonymes (sens proche) de "mitophagie" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à MITOPHAGIE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot MITOPHAGIE est dans la page 4 des mots en M du lexique du dictionnaire.
Mots en M à proximité
mitochondrie mitofusine mitogène mitogenèse mitohormèse mitophagiemitose mitospore mixohalin mixolimnion mixotrophe
En rapport avec "mitophagie"
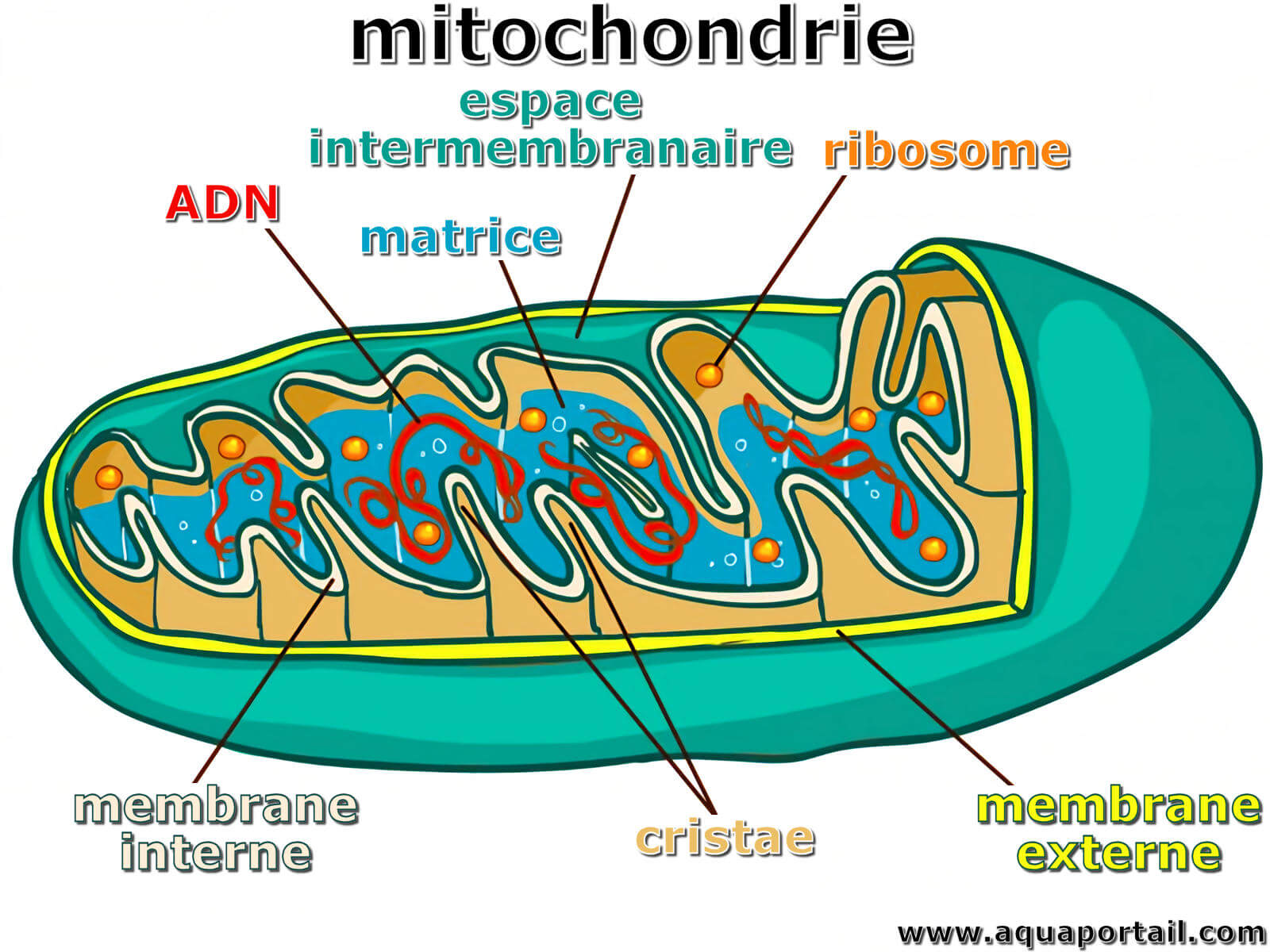
Une mitochondrie est un organite cytoplasmique mobile des cellules eucaryotes qui agit comme une centrale énergétique en produisant de l'ATP...

L'autophagie, par opposition à l'hétérophagie, est une autodisgestion d'organites cellulaires par fusion avec les lysosomes pour former des autophagolysosomes...

Un lysosome est un organite vésiculaire entouré d'une membrane, contenant des hydrolases impliquées dans les digestions intracellulaires.

Les mitofusines (MFN1 et MFN2) sont des protéines de la membrane mitochondriale externe impliquées dans la régulation de la dynamique mitochondriale.
