Nitrate
Définition
Un nitrate (NO3-) est un composé polyatomique constituant l'ultime étape de la dégradation des substances azotées par des bactéries qui décomposent la matière organique. Les nitrates sont une des formes d'azote assimilée par les végétaux.
Les nitrates et les nitrites sont des composés naturels qui se forment lors de la décomposition de la matière organique.
Une molécule de nitrates schématisée :
Le nitrate est de formule chimique NO3-. C'est aussi le sel de l'acide nitrique HNO3, encore appelé azote nitrique. La masse moléculaire d'un ion nitrate est de 62,0049 Da. Il est mesuré à l'aide d'un test nitrates ou test NO3.
Dans le cycle de l'azote
Dans le cycle de l'azote, les nitrates sont issus de la dégradation des nitrites NO2- par nitratation et de l'azote ammoniacal. La dénitrification dans le cycle azoté est aussi appelée la respiration nitrate.
Les nitrates sont relativement peu dangereux pour les poissons mais peuvent être toxiques pour les invertébrés. Toutefois, divers nitrates inorganiques sont largement utilisés dans les engrais, qui peuvent alors contaminer votre approvisionnement en eau.
Ce sont des bactéries du genre Nitrobacter (par exemple) qui reprennent l'acide nitreux et les nitrites pour les oxyder en acide nitrique qui forme, avec les bases qu'il rencontre, des nitrates de sodium, de potassium, de calcium. Cette seconde étape d'oxydation biochimique de l'acide nitreux en acide nitrique constitue la nitratation.
Les nitrates organiques et inorganiques
Les nitrates inorganiques sont issus de la dégradation de matière organique. Ils sont formés dans la nature par la décomposition des composés azotés tels que des protéines, l'urée, les amines... De cette façon, c'est un azote réduit de décomposition de l'ammoniac ou l'ammonium. En présence d'oxygène, il est oxydé par des micro-organismes de type nitrobacter pour former l'acide nitrique qui se lie une base quelconque (habituellement carbonate).
Une autre source de formation est induite par les oxydes d'azote générés par les décharges électriques des tempêtes (azote et oxygène). Avec l'eau de pluie, il forme l'acide nitrique qui lie les carbonates et autres minéraux.
Actuellement, des quantités importantes d'oxydes d'azote sont également formés dans le procédé de combustion à haute température. Ceux-ci sont transformées par la même voie de nitrate réductase.
Les nitrates organiques sont des esters d'acide nitrique avec des alcools. Le plus connu des nitrates organiques est probablement la nitroglycérine, formé à partir d'un mélange de glycérine, d'acide nitrique et d'acide sulfurique concentré.
Dans les engrais
Les nitrates sont une partie essentielle des engrais. Les plantes utilisent les composés organoazotés comme les acides aminés. De nombreuses plantes accumulent les nitrates dans leurs parties vertes et s'ils sont utilisés comme aliments cuits, il y a un danger que d'autres organismes les transforment en nitrites par réduction, qui produisent à leur tour des nitrosamines qui sont cancérigènes. Par conséquent, il est recommandé, par exemple, de ne pas surchauffer les épinards qui ont habituellement une forte teneur en nitrate.
Dans la nature, ils sont présents en importantes quantités de nitrate de sodium (NaNO3), des dépôts formés par évaporation du salpêtre. Les incrustations formées dans les bâtiments d'élevage sont souvent composés de nitrate de calcium Ca(NO3)2. Ils sont générés par la décomposition de l'urée CO (NH2)2 de l'urine des animaux qui est converti en acide nitrique microbiologiquement et enfin par réaction avec de la chaux dans les parois (murs).
Les différentes formes de nitrates
Le nitrate de potassium (KNO3) est une partie essentielle de la poudre noire. Son pouvoir oxydant est utilisé pour transformer le carbone et le soufre également présent dans le mélange en leurs oxydes. L'énergie libérée dans le processus provoque une chauffe de gaz qui se développe explosivement.
Les nitrates, comme déjà indiqué, sont également une composante essentielle de nombreuses formulations d'engrais. Le nitrate naturel, également connu sous le nitrate du Chili, longtemps exploité dans les mines de sel du nord du pays, jusqu'à ce que le développement en Norvège et d'autres pays du nitrate artificiel (obtenir l'azote directement à partir de l'air par voie électrochimique) est venu concurrencer ce nitrate naturel et affecter le commerce d'exportation. Un composé particulièrement utile dans ce contexte est le nitrate d'ammonium.
Malheureusement, en plus d'être un bon compost, il se décompose explosivement lorsque chauffé et il est responsable d'un grand nombre d'accidents. Mélangé avec de l'huile, il est utilisé comme un explosif dans le secteur minier. Dans des conditions plus contrôlées, la décomposition du nitrate d'ammonium est utilisée pour générer l'oxyde de diazote. Il est utilisé comme anesthésique et, par exemple, pour faire mousser la crème fouettée vendu en boîte.
Le nitrate d'argent est un précurseur important pour les halogénures des sels d'argent utilisés comme produit photosensible en photographie.
Comme des nitrates intermédiaires sont présents dans la nitrification-dénitrification, ils utilisés dans les usines de traitement des eaux d'égout des eaux usées. On utilise certains micro-organismes pouvant réduire le nitrate en conditions anaérobies directement en azote élémentaire (azote moléculaire). Les composés azotés qui produisent des problèmes d'eau sont éliminés lors d'une eutrophisation. Les problèmes de sulfure d'hydrogène (H2S) généré dans les eaux usées, des fosses septiques et des réseaux d'égout, peuvent également être résolus par l'addition de nitrates.
Les solutions de nitrates (nitrate de calcium, nitrate de sodium et nitrate de potassium) sont également utilisés dans les bains de passivation des surfaces métalliques, ainsi que pour le stockage d'énergie thermique dans des installations de concentration solaire. Ce dernier développement est la grande nouveauté des centrales thermiques solaires où l'énergie excédentaire est accumulée pour produire plus tard l'électricité quand disparaît la lumière du soleil. La plage de température pour stocker ces sels est comprise entre 131 et 560 °C. La recherche de nouvelles formes nitrates (nitrate de calcium de potassium, de lithium...) permet d'améliorer les propriétés de ces sels.
Le nitrate d'amyle (O2NO(CH2)4CH3) est utilisé en médecine pour ses effets sur le système cardio-vasculaire.
Nitrate dans l'eau
Les concentrations de nitrate, de potassium et de nitrate d'ammonium, tous deux largement utilisés dans les engrais pour pelouses et jardins, sont les nitrates inorganiques les plus courants dans l'eau. Étant donné que la plupart des matières azotées présentes dans les eaux naturelles ont tendance à se transformer en nitrate, toutes les sources d'azote combinées sont des sources potentielles de contamination. Les nitrates sont très solubles et ne se lient pas aux sols, ils peuvent donc facilement pénétrer dans les eaux souterraines. De plus, ces composés ne s'évaporent pas et restent souvent dans l'eau jusqu'à ce qu'ils soient consommés par les plantes ou les animaux.
NO3 (nitrate) en structures 3D et 2D :
Les nitrates et les nitrites sont tous deux des ions qui contiennent de l'azote et de l'oxygène; les nitrates comprennent trois atomes d'oxygène contre deux pour les nitrites. Ces composés peuvent également être convertis les uns en autres et sont souvent regroupés lorsqu'on discute de leur rôle en tant que contaminants de l'eau. Les nitrates NO3 présents dans l'eau potable sont incolores, inodores et insipides, et ils ne peuvent être détectés que si des échantillons d'eau sont analysés en laboratoire.
Les taux élevés de nitrates dans l'eau ont provoqué des maladies graves et parfois la mort. Ce composé est particulièrement dangereux pour les bébés, les enfants et les adultes présentant un certain type de déficit enzymatique. De plus, les personnes qui ont des niveaux d'acide gastrique plus faibles peuvent être plus sensibles aux nitrates présents dans l'eau potable. Les nitrates sont transformés en nitrites dans l'organisme, c'est pourquoi les deux peuvent être dangereux.
Le problème avec les nitrates et les nitrites est qu'ils affectent la façon dont le sang transporte l'oxygène. Les nitrites peuvent oxyder le fer présent dans votre sang, le rendant incapable de transporter l'oxygène. Un apport élevé en nitrates peut entraîner une méthémoglobinémie et certains cas de "syndrome du bébé bleu", une maladie aiguë dans laquelle la santé se détériore rapidement sur une période de plusieurs jours. Les symptômes comprennent un essoufflement et une peau bleue, des maux de tête, de la fatigue et des changements dans l'état mental et, dans les cas graves, le coma et la mort.
Élimination des nitrates
Les nitrates et les nitrites peuvent être difficiles à éliminer de l'eau. Contrairement à de nombreux produits chimiques, ces composés ne peuvent pas être traités avec des filtres à charbon actif granulaires standards. Au lieu de cela, un support échangeur d'ions à base de résine anionique spécial spécialement conçu pour l'élimination des nitrates doit être utilisé; les résines anioniques standard peuvent en fait aggraver le problème.
Une autre solution d'élimination du nitrate dans l'eau est l'emploi d'un osmoseur qui fonctionne par osmose inverse.
Si des tests en laboratoire indiquent que votre eau contient des niveaux élevés de nitrates, l'utilisation d'une cartouche d'élimination des nitrates peut aider à nettoyer l'eau provenant d'une source municipale.
La plupart des puits fournissent de l'eau potable et propre, mais ils peuvent parfois être contaminés. Il est de la responsabilité du propriétaire du puits d'entretenir et de traiter son puits. Si vous vivez dans une région où de nombreux engrais sont utilisés (que ce soit dans les fermes, les pelouses ou les jardins), votre eau peut contenir beaucoup de nitrates.
En raison de sa capacité à éliminer les nitrates de préférence en présence de sulfates et d'autres ions divalents, vous aurez peut-être besoin d'une cartouche d'élimination des nitrates si votre eau contient plusieurs contaminants.
Synonymes, antonymes
Voir tous les synonymes pour "nitrate".1 synonyme (sens proche) de "nitrate" :
- azote nitrique
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à NITRATE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot NITRATE est dans la page 2 des mots en N du lexique du dictionnaire.
Mots en N à proximité
nidification nidifuge nigéricinenitrapyrine nitratation nitratenitrate de potassium nitrate de sodium nitrate réductase nitrification nitrile
En rapport avec "nitrate"

Un dénitrateur est un réacteur qui permet la réduction du taux de nitrate dans un système aquatique.
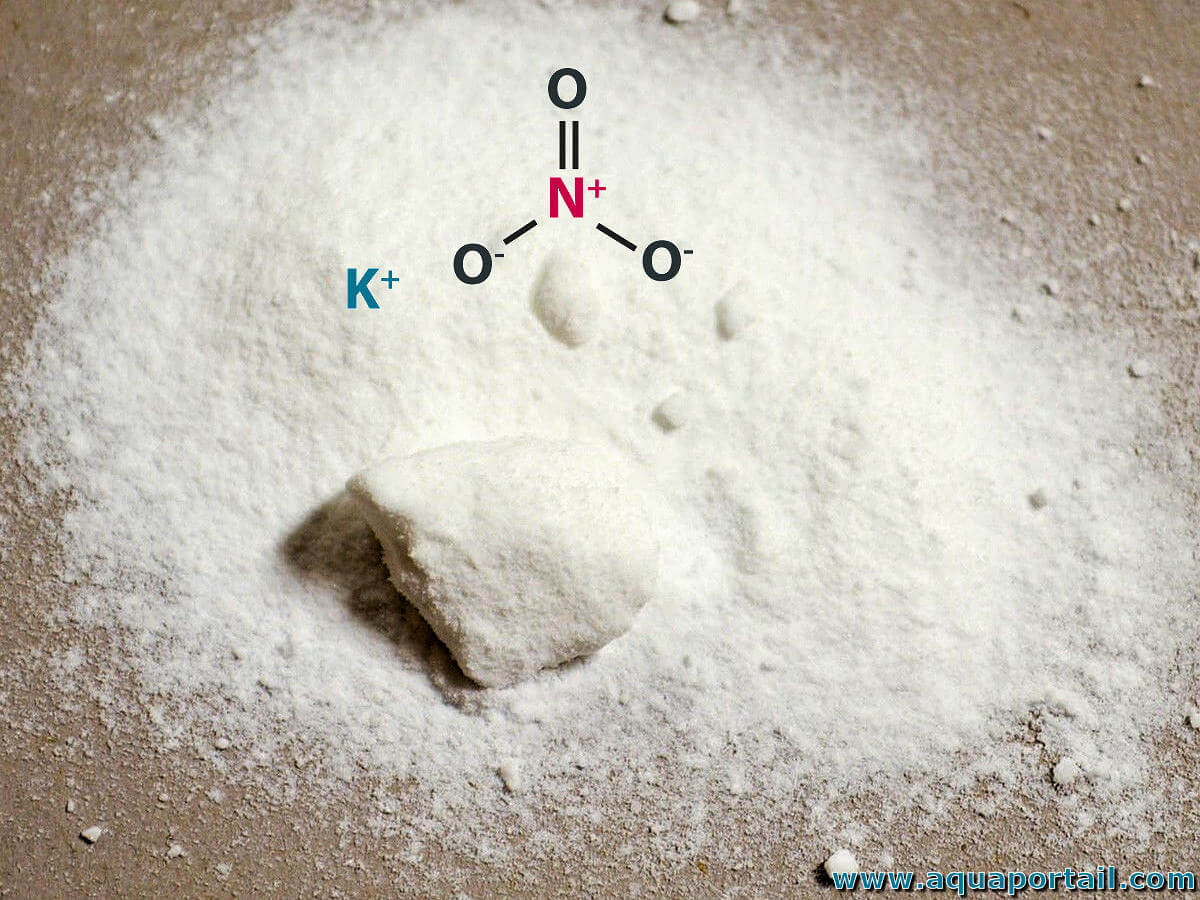
Couramment appelé salpêtre, le nitrate de potassium (KNO₃) est un sel cristallin, le sel de nitrate inorganique de potassium.

Le nitrate de sodium (NaNO₃) un composé poudreux blanc utilisé principalement dans la fabrication d'engrais.
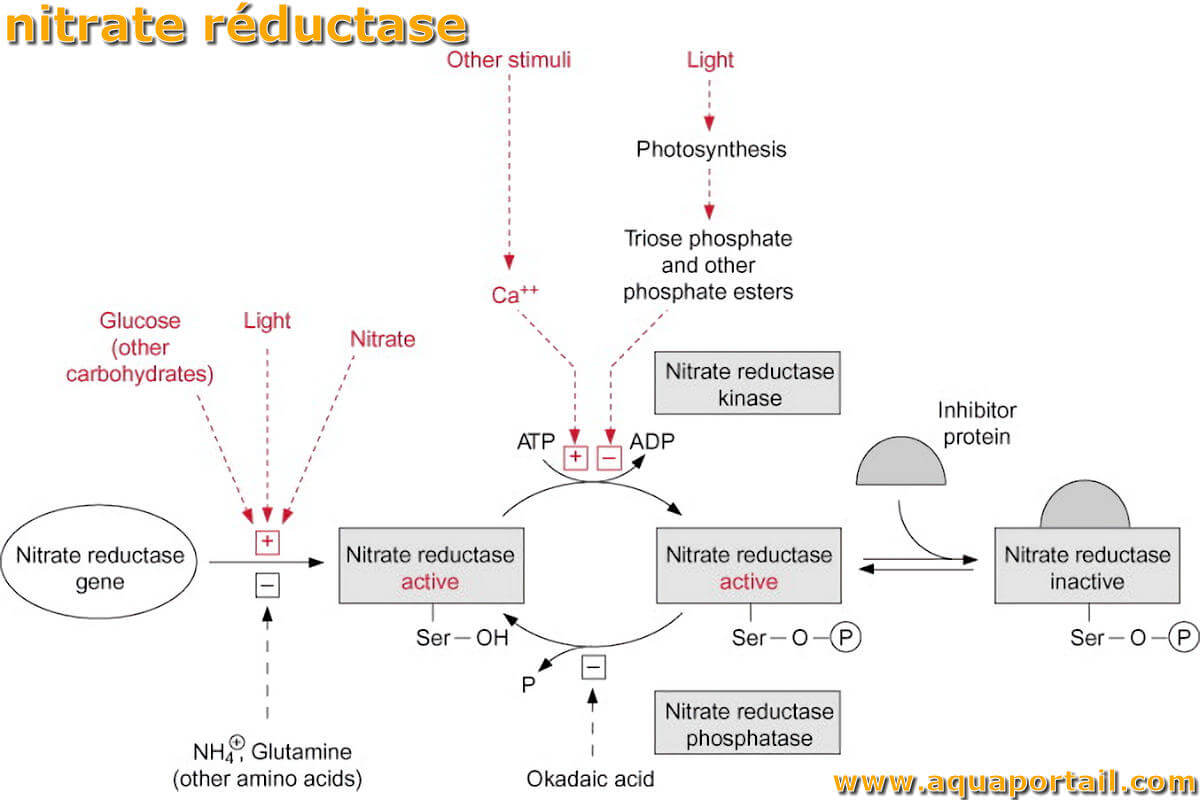
Le nitrate réductase (NR) nomme autrement une flavoprotéine soluble contenant du molybdène.
