Un acide
Un acide est traditionnellement considéré comme tout composé chimique qui, lorsqu'il est dissout dans de l'eau, produit une solution ayant une activité de cations d'hydronium supérieure à celle de l'eau pure, c'est-à-dire dont le pH est inférieur à 7.
Diverses espèces d'acides :
Les acides sont très nombreux; ici : acide chlorhydrique, acide sulfurique, acide acétique et l'acide ascorbique.
Généralités
Un acide est une substance chimique qui réagit avec une base, un composé qui contient de l'hydrogène et qui se dissocie en solution aqueuse. Il libère des ions hydrogènes, des atomes d'hydrogène ayant perdu leur électron et par conséquent chargés positivement : l'hydronium H+. Il a un pH inférieur à 7,0.
Ces composés ont une saveur acide, ils réagissent avec les métaux en libérant l'hydrogène et en formant des sels. L'opposé d'un acide est une base. Des exemples d'acides biens connus sont : l'acide chlorhydrique (HCl, suc gastrique), l'acide acétique (vinaigre), l'acide nitreux (dit nitrite), l'acide acétylsalicylique (aspirine), l'acide sulfurique (utilisé dans les batteries de voiture), l'acide ascorbique (vitamine C).
Les systèmes acide-base diffèrent des réactions redox car il y a un changement dans l'état d'oxydation. Les acides peuvent exister sous forme de solides, de liquides ou de gaz, en fonction de la température et peuvent également exister sous forme de substances pures ou en solution.
Selon la définition de la théorie de Brønsted-Lowry, un acide est toute substance capable de donner un proton ou un ion hydrogène. Un acide est une substance caractérisée par son aptitude à réagir dans l'eau avec des bases ou des alcalis pour former des sels. Un acide produit des ions hydrogènes lors de sa dissociation dans l'eau, ayant un pH inférieur à 7. Ce corps est capable de céder des protons (H+) et de former un sel avec une base.
La force d'un acide se réfère à son aptitude ou la tendance à perdre un proton. L'acidité d'une solution, comme l'acidité de l'eau, est définie par le potentiel Hydrogène (pH). La neutralisation est la réaction entre un acide et une base, produisant un sel et une base neutralisés; Par exemple, l'acide chlorhydrique et l'hydroxyde de sodium forment du chlorure de sodium et de l'eau pure.
Les acides organiques possèdent un ou plusieurs groupements carboxyle (-COOH). Les acides aminés possèdent au moins une fonction acide et une fonction amine. Les acides gras sont formés d'une chaîne hydrocarbonée; ils sont dits saturés ou insaturés selon la saturation en hydrogène des atomes de carbone de leur chaîne. Les acides nucléiques (ADN, ARN) sont composés d'oses (ribose ou désoxyribose), de bases azotées et de phosphates.
Un organisme est acidiphile ou acidophile lorsqu'il apprécie les milieux acides, et il est acidicole lorsqu'il vit dans un tel milieu.
Voir aussi la pluie acide, l'acidification des océans, le potentiel d'acidification...
Acides du quotidien
Voici cinq des acides les plus courants :
- L'acide acétique, ou HC2H3O2 pour les intimes, donne au vinaigre son goût prononcé. Le vinaigre de malt contient entre 5 et 20 % d'acide acétique.
- L'acide carbonique est une solution aqueuse de dioxyde de carbone dans l'eau, aussi appelée eau gazeuse.
- L'acide citrique est un acide naturel présent dans tous les agrumes, comme les citrons et les citrons verts.
- L'acide chlorhydrique est une solution de chlorure d'hydrogène présente dans l'acide gastrique, qui nous aide à décomposer et à digérer les aliments. Également appelé HCl, l'acide chlorhydrique est un acide fort et corrosif.
- L'acide sulfurique est une substance hautement corrosive que l'on trouve couramment dans les batteries de voiture et les produits d'entretien.
Propriétés
Tous les acides contiennent des ions hydrogène (H+). Ceux-ci déterminent la force ou la faiblesse d'un acide. Par exemple, lorsqu'ils sont ajoutés à l'eau, les acides forts libèrent tous leurs ions hydrogène, transformant l'eau en solution acide. Les acides faibles, en revanche, ne libèrent qu'une partie de leurs ions hydrogène, ce qui donne une solution moins concentrée.
Ainsi, plus la concentration en ions hydrogène dans l'eau ou les solutions aqueuses est élevée, plus l'acide est fort. Les acides forts ont généralement un pH compris entre 1 et 3, tandis que les acides faibles se situent entre 4 et 6 sur l'échelle de pH. L'échelle de pH, qui va de 0 à 14, mesure la quantité d'ions hydrogène présents dans une solution aqueuse.
Les acides peuvent être organiques ou inorganiques, forts ou faibles. Ils sont souvent présents à l'état naturel. Par exemple, l'acide chlorhydrique est présent dans l'estomac des mammifères, y compris l'homme. Les plantes produisent également couramment des acides, comme l'acide citrique contenu dans les agrumes comme les citrons et les oranges.
En laboratoire, les acides sont utilisés comme réactifs et solutions analytiques, notamment pour les titrages. Ils jouent également un rôle important dans de nombreux procédés industriels, tels que le raffinage du pétrole, la production d'engrais et la fabrication de produits pharmaceutiques.
L'acide sulfurique, par exemple, est une matière première de base et un réactif dans divers procédés. Il est donc utilisé dans de nombreux secteurs, notamment l'automobile, l'industrie pharmaceutique, la sidérurgie et l'industrie textile.
Informations sur les acides
Selon la définition des acides de Brønsted-Lowry, un acide est toute substance capable de donner un proton ou un ion hydrogène.
Un acide de Lewis est un composé qui forme une liaison covalente en absorbant des paires d'électrons.
Un acide d'Arrhenius est une substance qui augmente le nombre d'ions hydrogène dans une solution aqueuse.
Pour être considérée comme acide, quelle que soit la définition, une substance doit avoir un pH inférieur à 7.
L'opposé chimique d'un acide est une base. Les substances basiques contiennent des ions hydroxyde (OH-) chargés négativement et peuvent neutraliser les acides. Les bases insolubles dans l'eau sont appelées alcalins. Si un acide et une base sont ajoutés, ils réagissent pour former de l'eau (H₂O) et un sel. Un exemple que vous connaissez peut-être est celui du brossage des dents. L'acide produit par les bactéries présentes sur les dents réagit avec la base du dentifrice. Cette réaction est appelée neutralisation.
Les acides réagissent avec la plupart des métaux, dont le magnésium, pour former de l'hydrogène gazeux et un sel. Il existe de nombreux types de sels en chimie. Ils réagissent également avec un groupe de substances appelées carbonates pour produire du dioxyde de carbone gazeux, du sel et de l'eau.
Acides monoprotiques ou polyprotiques
Les acides monoprotiques sont les acides capables de donner un proton par molécule au cours du processus de dissociation (parfois appelé ionisation). Les acides polyprotiques peuvent donner plus d'un proton par molécule d'acide, à la différence des acides monoprotiques qui ne donnent qu'un proton par molécule. Des types spécifiques d'acides polyprotiques ont des noms plus spécifiques, tels que acide diprotique (deux protons potentiels à donner) et acide triprotique (trois protons potentiels à donner).
En rapport avec "acide"

L'acide 2,3-diphosphoglycérique, anciennement appelé diphosphoglycérate (DPG), est un métabolite intermédiaire du glucose synthétisé à partir de l'acide...
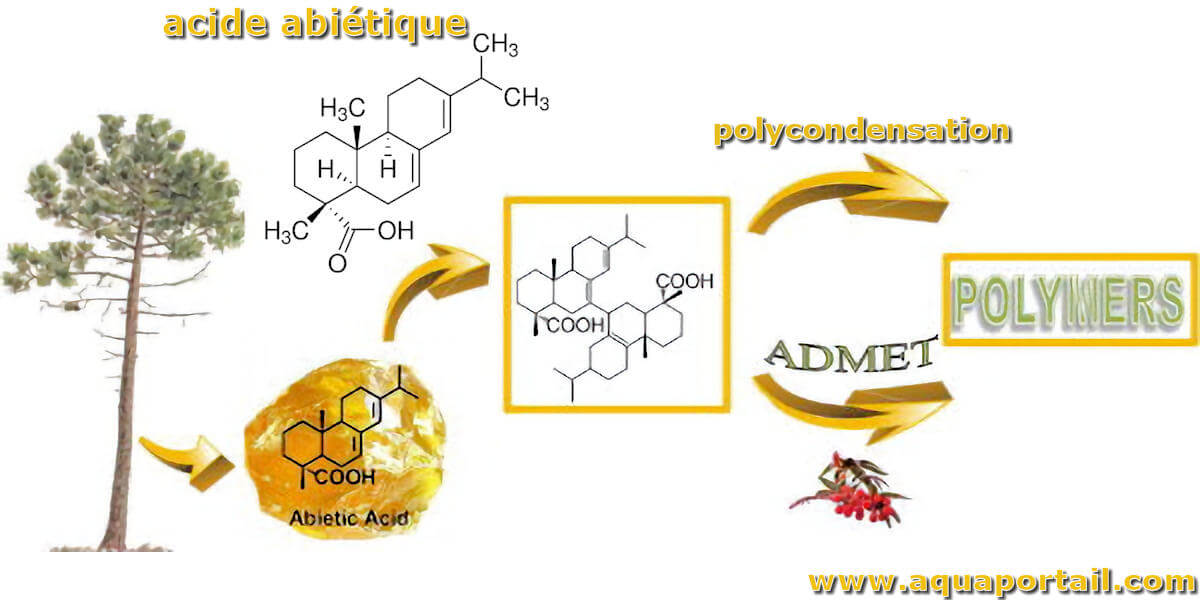
L'acide abiétique est une substance cristalline incolore obtenue à partir de l'oléorésine de quelques Gymnospermes, notamment des pins.
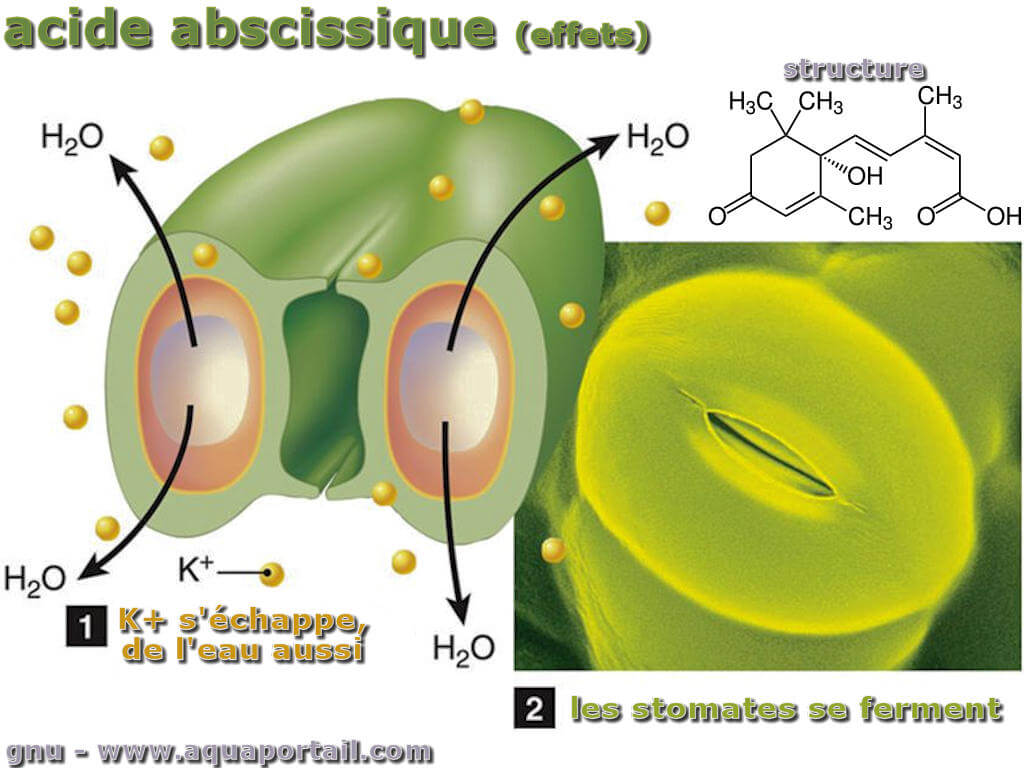
L'acide abscisique est une hormone présente dans les plantes qui joue un rôle essentiel dans la croissance et la régulation de différents processus végétaux.

L'acide acétique (CH₃COOH) est un acide organique qui donne au vinaigre son goût caractéristique.
