Pression osmotique
Définition
La pression osmotique est une force déterminée par une différence de concentration entre deux solutions situées de part et d'autre d'une membrane semi-perméable. L'osmose et les forces osmotiques favorisent la diffusion des substances à travers la membrane, en milieu interne, le solvant passant de la solution la moins concentrée vers la plus concentrée.
L'osmose implique une pression osmotique, et l'osmose inverse implique une pression hydrostatique.
La pression osmotique avec une osmose normale :
Pour la pression osmotique, le schéma montre la différence entre l'osmose simple et l'osmose inverse au travers d'une membrane semi-perméable avec les forces exercées, par pression osmotique ou par pression hydrostatique.
Généralités
La pression osmotique est la pression qui doit être appliquée à une solution pour empêcher l'écoulement entrant de l'eau à travers une membrane semi-perméable. La pression osmotique peut également être expliquée comme la pression nécessaire pour annuler l'osmose. La pression osmotique définit le minimum de pression qui doit être appliquée à une solution pour empêcher l'écoulement vers l'intérieur de l'eau à travers une membrane semi-perméable. Elle est également définie comme la mesure de la tendance d'une solution à prendre de l'eau par osmose. Les valeurs sont régies par le coefficient osmotique.
Simplement, la pression osmotique est la force qui s'exerce sur une membrane hémiperméable (perméable à l'eau seulement) séparant deux solutions de concentrations différentes. Elle fait passer l'eau de la solution la moins concentrée (hypotonique) vers la solution la plus concentrée (hypertonique) jusqu'à ce que l'équilibre soit atteint (isotonie).
La pression osmotique est également définie comme la pression minimum nécessaire pour annuler l'osmose. Jacobus Henricus van Hoff a d'abord proposé une formule pour calculer la pression osmotique, mais cette équation a été améliorée plus tard par Harmon Northrop morse.
Le phénomène de la pression osmotique provient de la tendance d'un solvant pur à se déplacer à travers une membrane semi-perméable et dans une solution contenant un soluté auquel la membrane est imperméable. Ce processus est d'une importance vitale en biologie des cellules, avec la membrane cellulaire qui est sélective vers la plupart des solutés présents dans les organismes vivants.
Afin de visualiser cet effet, imaginez un tube transparent en forme de U avec des quantités égales d'eau de chaque côté, séparés par une membrane à sa base qui est imperméable aux molécules de sucre (fabriqué à partir de tubes de dialyse). Le sucre a été ajouté à l'eau sur un côté. La hauteur de l'eau de chaque côté changera proportionnellement à la pression de la solution.
La pression osmotique provoque une augmentation de la hauteur de l'eau dans le compartiment contenant le sucre à augmenter, en raison du mouvement de l'eau pure dans le compartiment sans sucre dans le compartiment contenant l'eau sucrée. Ce processus s'arrête une fois que les pressions de l'eau et de l'eau sucrée vers les deux côtés de la membrane sont assimilés.
Pression osmotique corporelle
Les différentiels de pression régissent le mouvement des fluides à travers les membranes physiologiques. Les deux forces qui contribuent sont la pression hydrostatique/hydraulique et la pression osmotique. Le troisième facteur est la perméabilité des membranes capillaires.
Il y aura une fuite d'eau et de soluté dans l'espace interstitiel entraînant un oedème interstitiel chaque fois que la pression hydrostatique est beaucoup plus élevée que la pression osmotique à l'intérieur de l'espace intravasculaire. L'oedème intervient également lorsqu'il y a une fuite capillaire due à une intégrité de la membrane altérée comme dans les brûlures ou l'anaphylaxie.
La pression hydrostatique résulte de l'action de la gravité d'une colonne de fluide tandis que la pression hydraulique fait référence à l'action délivrée par une pompe. Ensemble, ces deux forces contribuent à la pression artérielle et au mouvement des fluides dans et hors de l'espace vasculaire.
La régulation devient particulièrement importante au niveau du capillaire, le point du système circulatoire où la perméabilité existe à la fois au soluté et à l'eau.
La pression osmotique sur des cellules sanguines :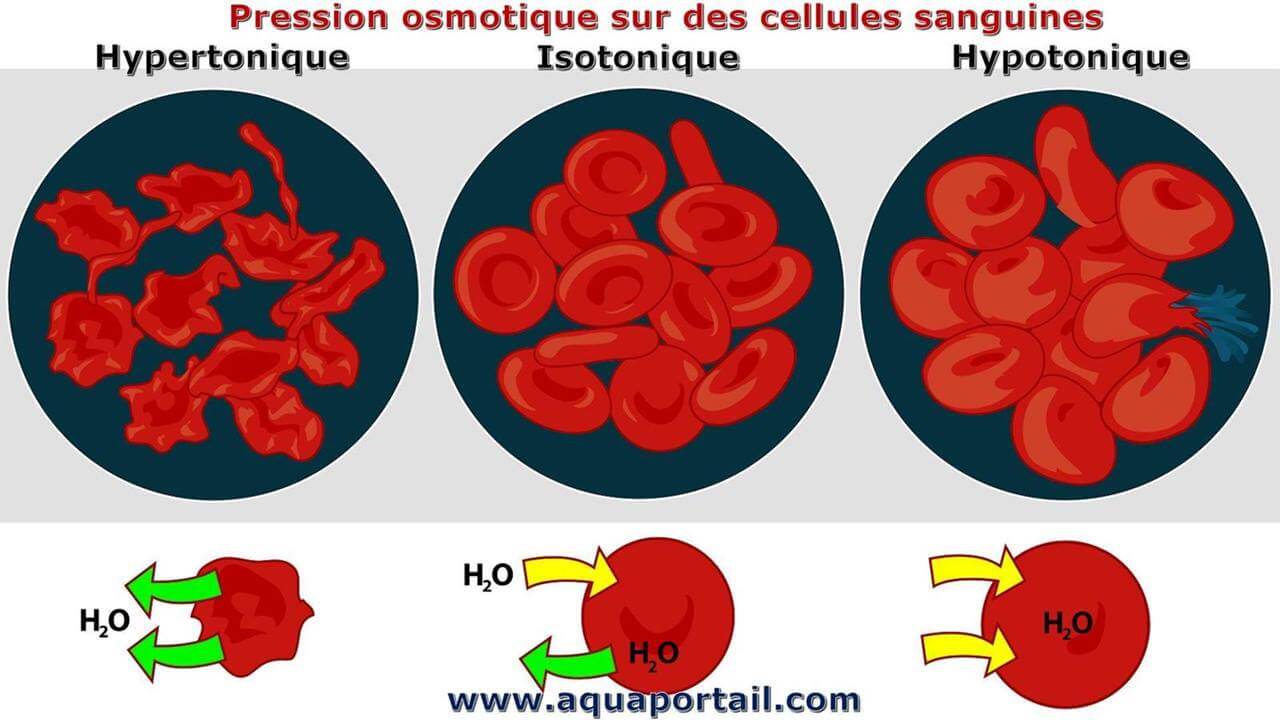
La pression osmotique sur les cellules sanguines est hypertonique, isotonique ou hypotonique pour le sang.
Par définition SVT, la pression osmotique est la pression hydrostatique produite par une solution dans un espace divisé par une membrane perméable de manière différentielle due à une différence dans les concentrations de solutés. Avec les cellules des organismes, elle fait appel à la pression oncotique.
La pression osmotique repose sur la perméabilité sélective des membranes. Prenez deux des principaux ions du liquide extracellulaire : Na+ et Cl-, qui peuvent se déplacer rapidement entre le plasma et les espaces du liquide interstitiel, ce qui en fait des agents osmotiques inefficaces.
Les protéines, en revanche, sont principalement limitées au compartiment plasmatique, ce qui en fait des agents osmotiques efficaces dans la capacité d'aspirer l'eau de l'espace interstitiel (où la concentration en protéines est faible) vers le compartiment plasmatique (où la concentration en protéines est élevée).
La pression osmotique effective dans cet exemple exercée par les protéines plasmatiques sur le mouvement de fluide entre les deux compartiments représente la pression osmotique colloïde ou la pression oncotique plasmatique.
La pression osmotique colloïdale (POC) du plasma et du liquide interstitiel joue un rôle important dans l'échange de liquide transvasculaire. Le mouvement des fluides et des solutés à travers les membranes biologiques facilite le transport des nutriments pour les organismes vivants et maintient les pressions fluides et osmotiques dans les systèmes biologiques.
Tonicité
La pression osmotique est un facteur important affectant les cellules. L'osmorégulation est un mécanisme d'homéostasie d'un organisme à atteindre l'équilibre de la pression osmotique :
- l'hypertonie est la présence d'une solution qui provoque les cellules à se rétrécir;
- l'hypotonie est la présence d'une solution qui provoque un gonflement des cellules;
- L'isotonie est la présence d'une solution qui ne produit pas de changement de volume de la cellule.
Lorsqu'un être biologique cellulaire est dans un environnement hypotonique, l'intérieur de la cellule accumule l'eau, l'eau s'écoule à travers la membrane cellulaire dans la cellule, ce qui provoque son expansion.
Dans les cellules végétales, la paroi cellulaire restreint l'expansion, ce qui entraîne une pression sur la paroi de la cellule à l'intérieur, dite pression de turgescence.
Pression osmotique potentielle
La pression osmotique potentielle est la pression osmotique maximum qui pourrait se développer dans une solution, si elle était séparée de l'eau osmosée par une membrane sélectivement perméable.
C'est le nombre de particules de soluté dans un volume unitaire de la solution qui détermine directement la pression osmotique potentielle. Si on attend pour l'équilibre, la pression osmotique atteint la pression osmotique potentielle. Voir aussi la pression oncotique.
Pression osmotique équilibrée :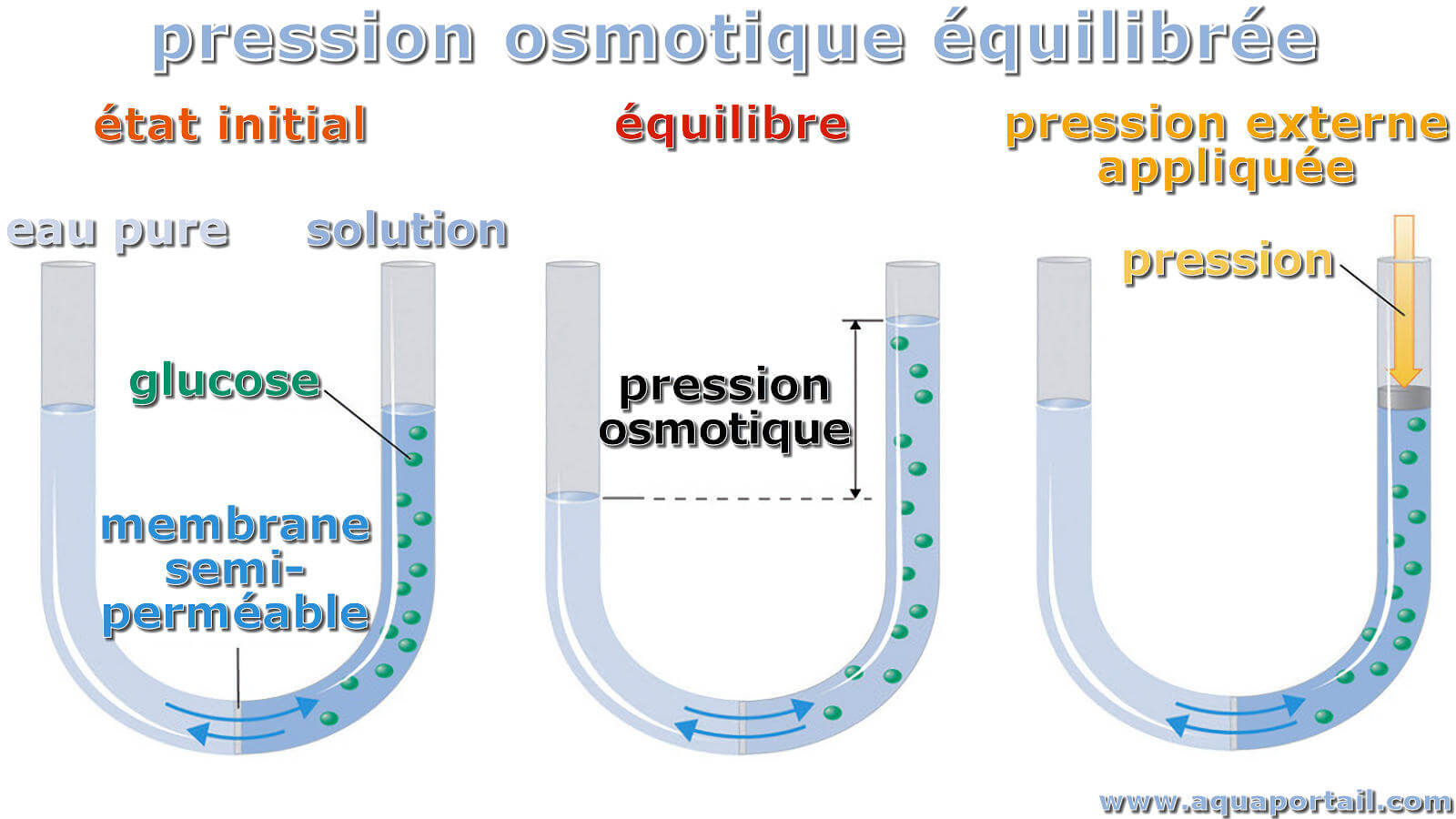
La pression osmotique est la pression qu'il faudrait appliquer à un solvant pur pour l'empêcher de passer dans une solution donnée par osmose, tandis que la pression hydrostatique est la pression exercée par un fluide à l'équilibre en un point donné du fluide, en raison de la la force de la gravité.
Calcul
Pour calculer une pression osmotique, la formule de calcul est basée sur : Posmotique = nRT/V, où Posmotique = kPa = atmosphères. La pression osmotique d'une solution diluée obéit à une relation de même forme que la loi des gaz parfaits.
La pression osmotique est généralement exprimée en termes de molarité de la solution et reçoit le symbole π, où π = MR'T. Dans ces relations, R = 8,3145 J/k mol est la constante de gaz normale et R'= 0,0821 L atm/K mol est la constante de gaz exprimée en litres et en atmosphères.
Notez que dans le calcul, la pression osmotique est attribuée à la solution, alors que la définition de la pression osmotique qui a été utilisée ici traite la pression osmotique positive comme la densité d'énergie relative du solvant pur par rapport à la solution.
Étant donné que la plupart des textes de biologie et de chimie actuels attribuent une pression osmotique élevée à la solution plutôt qu'au solvant pur par rapport à la solution, il faudrait redéfinir la pression osmotique pour être cohérent avec ces utilisations courantes.
Cellule végétale
En botanique, la pression osmotique et le potentiel hydrique créent une turgescence dans une cellule végétale.
Comment se fait-il que les cellules végétales puissent avoir de telles pressions osmotiques de turgescence ? La raison essentielle est que les cellules contiennent de grandes concentrations de solutés. Ces solutés attirent l'eau dans les cellules par un processus connu sous le nom osmose, qui implique l'eau qui coule à travers des membranes semi-perméables qui empêchent le passage des solutés, mais pas de l'eau.
L'afflux d'eau gonfle les cellules jusqu'à atteindre une pression hydrostatique à laquelle plus aucune eau ne s'écoule. Dans les cellules baignant dans l'eau douce, comme les algues dans un étang, cette pression hydrostatique d'équilibre est appelée pression osmotique π (Pi) du contenu cellulaire, et est couramment d'environ 500 kPa ou 0,5 MPa.
Cette pression osmotique peut être mesurée directement avec un osmomètre, ou elle peut être calculée à partir de la concentration de soluté dans la cellule (C) à partir de la relation (formule de van Hoff) : π = RTC; où R est la constante de gaz, T est la température absolue (en degrés Kelvin) et C est la concentration de soluté en osmoles/L.
À 25 ºC, RT est égal à 2,5 litres-MPa par mole, et π est en unités de MPa. Ainsi, une concentration de 200 mOsmoles/L a une pression osmotique de 0,5 MPa.
Cependant, les plantes terrestres sont différentes des algues dans un étang. Leurs feuilles sont dans l'air, et l'eau dans leurs parois cellulaires, contrairement à l'eau dans un étang, n'est pas libre. Il a une pression hydrostatique négative (discutée plus loin dans la section suivante).
Ainsi, pour une pression osmotique donnée π dans une cellule, la pression hydrostatique, P, sera plus faible que si la cellule était baignée dans de l'eau libre.
Cette différence est connue sous le nom de potentiel d'eau ψ (psi) de la cellule. Il est nul dans une cellule d'algues en eau douce, mais il est toujours négatif dans les plantes terrestres. Sa valeur est la différence entre P et π, c'est-à-dire : ψ = P - π.
Une notation alternative pour l'équation utilisée couramment par les physiologistes des plantes est : ψw = ψp + ψs. Dans ce cas, ψw est le potentiel d'eau total, ψs est le potentiel de soluté et ψp est le potentiel de pression. Ainsi ψs est égal, mais opposé dans le signe, à π.
La notion de potentiel hydrique peut être appliquée à n'importe quel échantillon d'eau, que ce soit à l'intérieur d'une cellule, dans la paroi cellulaire, dans les vaisseaux du xylème ou dans le sol.
L'eau s'écoulera d'un échantillon à fort potentiel hydrique à un échantillon à faible potentiel hydrique à condition que les échantillons soient à la même température et à condition qu'aucun soluté ne bouge avec l'eau. Le potentiel d'eau ainsi défini est toujours nul ou négatif, car il est par convention nul dans l'eau pure à la pression atmosphérique.
Osmorécepteurs
Il existe des cellules spécialisées pour détecter les modifications de la pression osmotique dans les fluides corporels (plasma sanguin, fluide intercellulaire...), appelées osmorécepteurs. Les osmorécepteurs peuvent être situés dans certaines structures, telles que l'hypothalamus, les artères, entre autres.
Grâce à ces cellules, le corps peut réguler la concentration de sels dans ses fluides, l'osmolalité. Chez l'homme, les noyaux supraoptiques ou paraventriculaires sont des osmorécepteurs.
Par les hormones antidiurétiques (également appelés vasopressine ou ADH), les osmorrécepteurs inhibent la diurèse afin de maintenir la pression artérielle osmotique correspondant à une osmolalité moyenne de 285 osmol/kg. Une variation de seulement 3 osmol/kg est suffisante pour activer ce mécanisme.
Organismes osmophiles
Les organismes extrémophiles pouvant se développer dans des environnements à forte concentration de sucres sont appelés osmophiles. Presque tous les microorganismes osmophiles sont des levures. Les osmophiles sont similaires aux organismes halophiles (milieu salin).
La forte concentration en sucre représente un facteur limitant dans la croissance de nombreux microorganismes, mais les osmophiles parviennent à se protéger contre la pression osmotique élevée par la synthèse d'osmoprotecteurs, tels que les alcools et les acides aminés.. Ces organismes sont importants, car ils provoquent la détérioration des produits tels que les jus de fruits, du sirop ou du miel, en plus des applications industrielles telles que la fermentation de la bière. Quelques exemples de ce type de microorganismes osmophiles sont : Saccharomyces rouxii, Saccharomyces bailii et Saccharomyces cerevisiae, la levure de bière.
Applications
La pression osmotique est la base du filtrage avec l'osmose inverse, un procédé couramment utilisé pour purifier l'eau. L'eau à purifier est placée dans une chambre et mise sous une quantité de pression supérieure à la pression osmotique exercée par l'eau et les solutés dissous dedans.
Une partie de la chambre est dotée d'une membrane perméable qui permet de manière différentielle aux molécules d'eau de traverser, mais pas les particules du soluté. La pression osmotique de l'eau de mer est d'environ 27 atm. L'osmose inverse dessale l'eau douce de l'eau salée de l'océan.
La pression osmotique est nécessaire pour de nombreuses fonctions des plantes. Il en résulte la pression de turgescence sur la paroi des cellules qui permet aux plantes herbacées de se tenir debout, droites, et la façon dont les plantes régulent l'ouverture de leurs stomates.
Dans les cellules animales, qui n'ont pas de paroi cellulaire, la pression osmotique excessive peut conduire à une cytolyse.
Dans les autres applications, voir :
- paroi cellulaire,
- la cytolyse,
- l'effet Gibbs-Donnan,
- l'osmose,
- la cellule Pfeffer,
- la plasmolyse,
- la pression de turgescence.
Pour le calcul du poids moléculaire en utilisant les propriétés colligatives, la pression osmotique est la propriété la plus préférée.
Synonymes, antonymes
Voir tous les synonymes pour "pression osmotique".2 synonymes (sens proche) de "pression osmotique" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PRESSION OSMOTIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression PRESSION OSMOTIQUE est dans la page 8 des mots en P du lexique du dictionnaire.
Mots en P à proximité
pression de turgescence pression hydraulique pression hydrostatique pression interne pression oncotique pression osmotiquepression partielle pression racinaire pression radiculaire pression sanguine pression standard
En rapport avec "pression osmotique"

La pression hydrostatique est une poussée qu'exerce l'eau sur la surface d'un corps immergé.
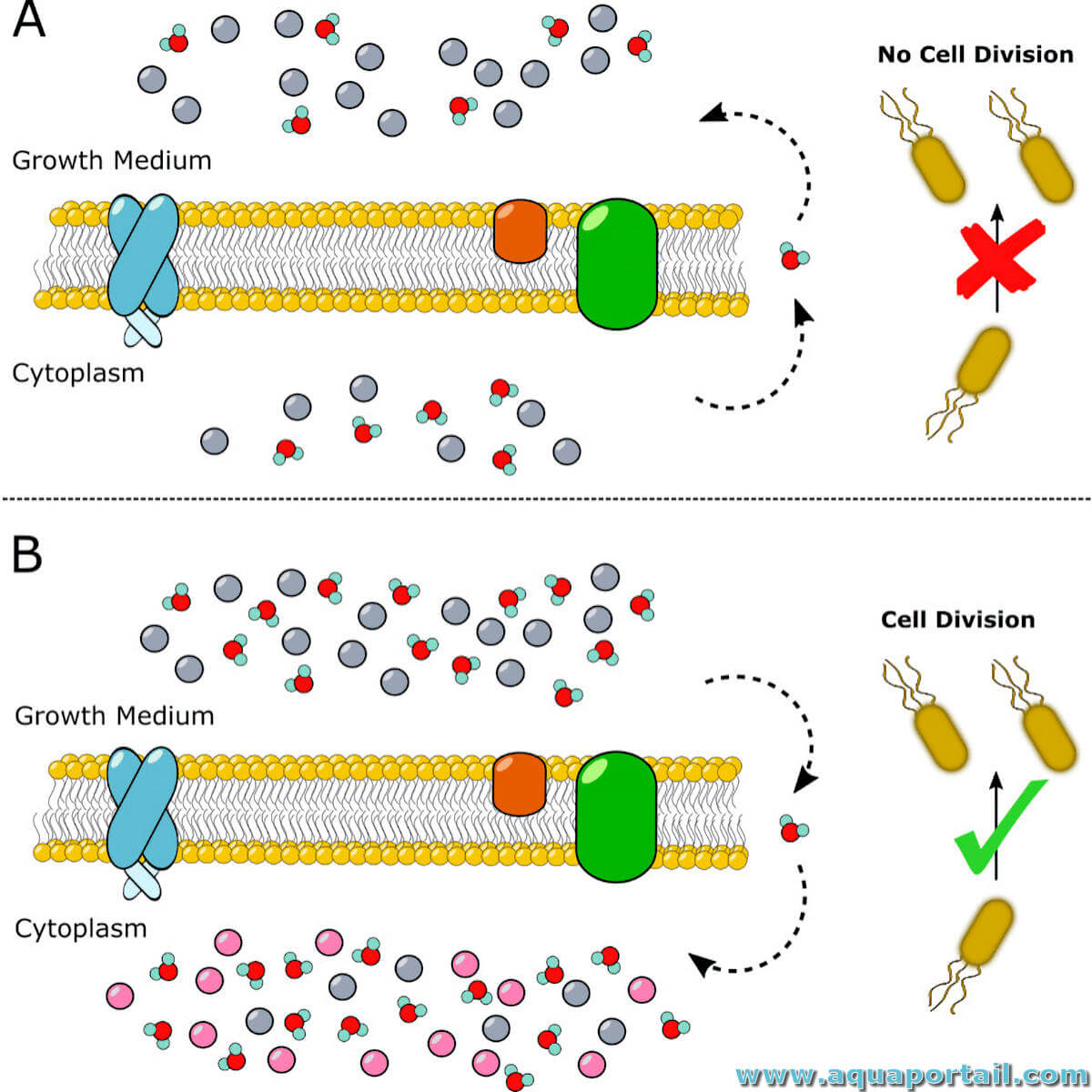
Le choc osmotique consiste en une dérégulation des pressions des deux côtés d'une membrane qui ne peut mécaniquement pas résister à ce changement brutal...
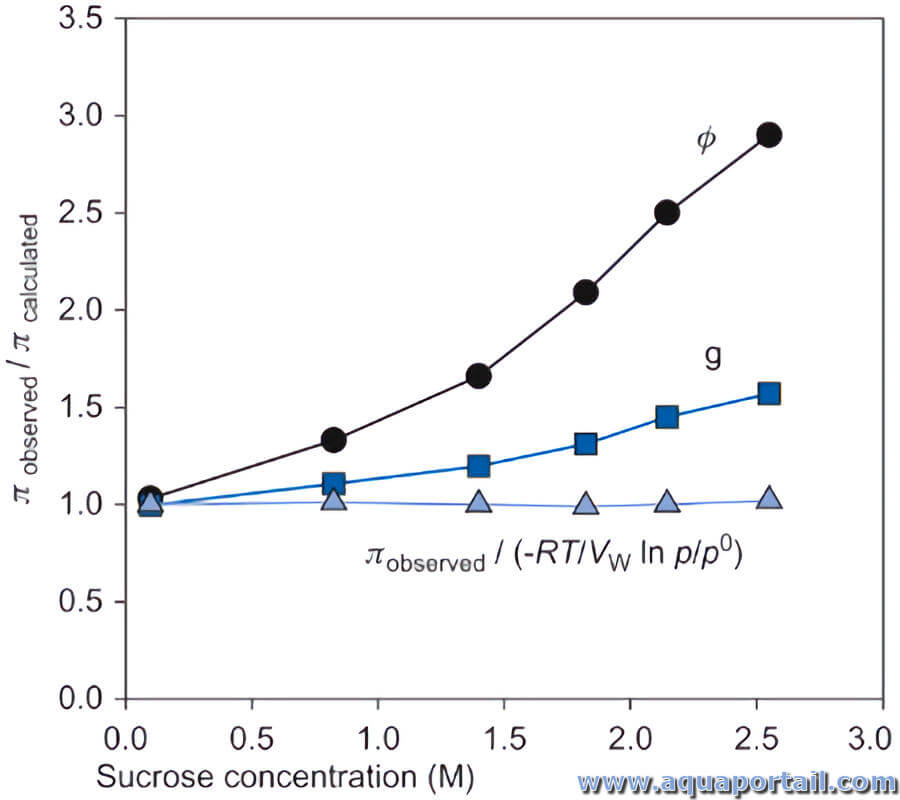
Un coefficient osmotique φ est une grandeur qui caractérise l'écart d'un solvant du comportement idéal, indicateur de la pression osmotique, par rapport...
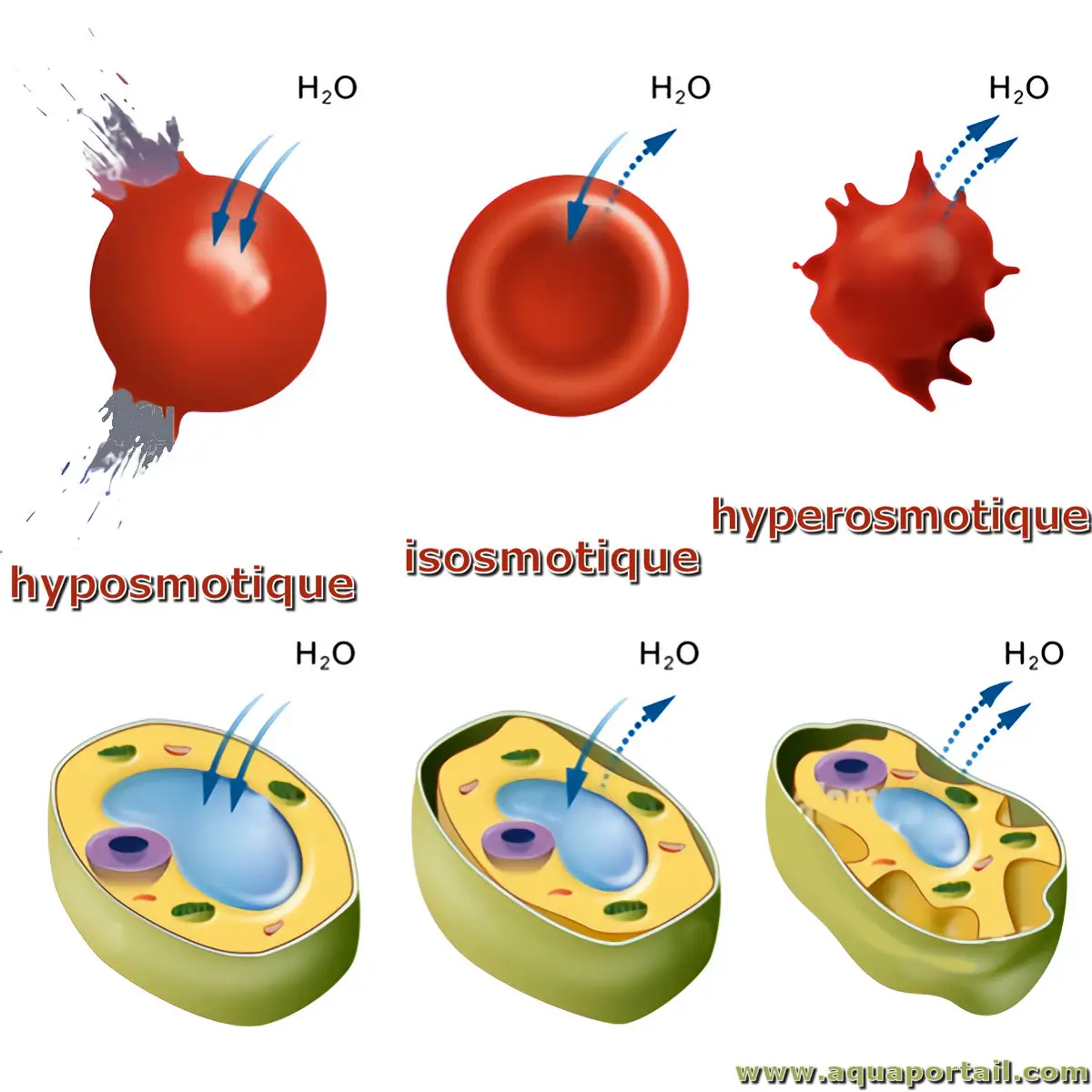
Hyperosmotique se dit d'un milieu de plus forte osmolarité que le milieu intracellulaire et s'oppose à hyposmotique, et complète isosmotique.
