Annexine
Définition
L'annexine est le nom commun d'un groupe de protéines cellulaires. Les annexines sont une famille de protéines qui se lient aux phospholipides membranaires et sont dépendantes du calcium. La plus connue est l'annexine V (A5). La désignation lipocortine est également utilisée pour désigner l'annexine.
Molécule d'annexine :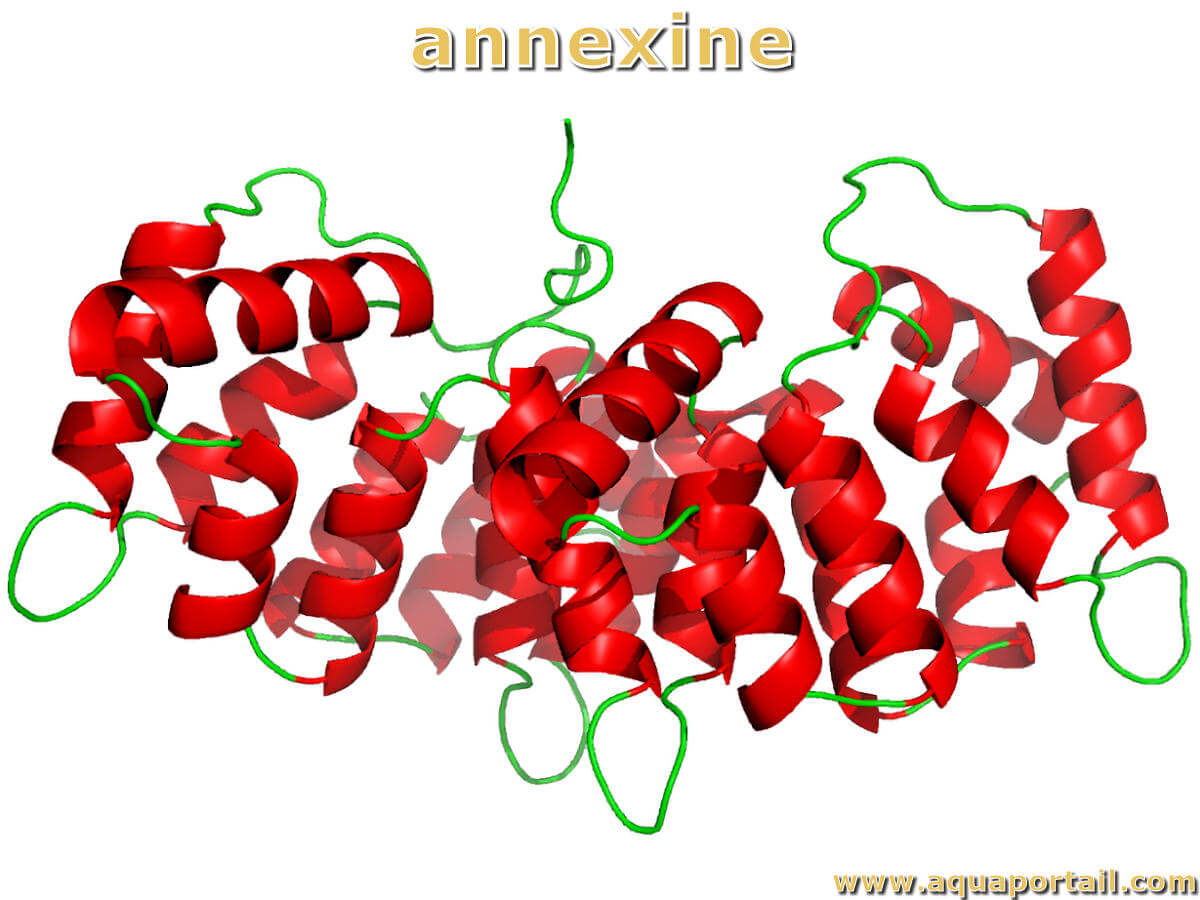
Structure cristalline de l'annexine humaine III (A3). Les annexines ont été décrites dans les années 1980, mais leur association avec les membranes intracellulaires a été signalée pour la première fois en 1977.
Explications
Chez l'homme, les annexines sont localisées à l'intérieur de la cellule. Cependant, certaines annexines (A1, A2 et A5) peuvent également être trouvées en dehors de l'environnement cellulaire, par exemple dans le sang.
Les lipocortines suppriment la phospholipase A2. C'est par ce mécanisme que les glucocorticoïdes (par exemple, le cortisol) inhibent l'inflammation.
Les annexines sont le nom d'une famille de protéines chez les eucaryotes dont le point commun est la propriété qu'elles se lient aux lipides de la membrane cellulaire de manière calcium-dépendante et qu'elles s'assemblent pour former des trimères ou des hexamères. Les hexamères forment alors habituellement canal ionique - des protéines de transport. Plus de 100 annexines de 45 espèces ont maintenant été séquencées, dont 12 chez l'homme. Les autres noms sont lipocortine, synexine (annexine A7) ou endonexine (découverte en 1952).
Le nom annexine est dérivé du grec annex signifiant "rassembler/tenir ensemble" et a été choisi pour décrire la propriété principale de toutes ou au moins presque toutes les annexines, c'est-à-dire la liaison et éventuellement le maintien ensemble de certaines structures biologiques, en particulier les membranes.
Le nom a également une saveur quelque peu historique car il prend en compte le fait qu'un certain nombre de groupes qui, indépendamment les uns des autres, ont découvert des annexines étaient à la recherche de telles protéines d'échafaudage ou de pontage. Cependant, initialement, c'est-à-dire à la date de leurs découvertes à la fin des années 1970 et au début des années 1980, les annexines ont reçu des noms divers et sans rapport faisant référence à leurs propriétés biochimiques. Ceux-ci comprenaient la synexine (pour la protéine d'agrégation de granules)s chromobindines (protéines se liant aux granules de chromaffine), les calcimédines (protéines médiant les signaux Ca2+), les lipocortines (inhibiteurs de la lipase inductible par les stéroïdes) et les calpactines (protéines liant Ca2+, phospholipide et actine).
Des travaux biochimiques intensifs, le séquençage des protéines et de l'ADNc, ainsi que le clonage de gènes ont permis de réaliser que toutes ces protéines identifiaient des propriétés biochimiques clés communes ainsi que des caractéristiques de structure et de séquence des gènes. Par conséquent, le concept d'une nouvelle famille multigénique issue de la duplication de gènes a été développé et le nom commun d'annexine a été introduit pour résoudre l'enchevêtrement terminologique.
Par définition, une protéine annexine doit remplir deux critères majeurs. Premièrement, elle doit être capable de se lier d'une manière dépendante du Ca2+ aux phospholipides chargés négativement. Deuxièmement, elle doit contenir comme élément structurel conservé ce que l'on appelle la répétition d'annexine, un segment d'environ 70 résidus d'acides aminés. Les structures moléculaires obtenues pour un certain nombre d'annexines au cours de la dernière décennie ont contribué à étendre les similitudes au niveau tridimensionnel.
De plus, elles ont défini un repli structurel inconnu jusqu'à présent, le domaine d'annexine conservé, qui est constitué de quatre répétitions d'annexine emballées dans un disque fortement hélicoïdal α, et qui est maintenant considéré comme un module de liaison membranaire général. Autrefois clairement définie et avancée par les travaux de séquençage du génome, la famille des annexines n'a cessé de croître dans les années 1990 et, au tournant du siècle, compte désormais plus de 160 protéines annexines uniques présentes dans plus de 65 espèces différentes allant des champignons et des protistes aux plantes et vertébrés supérieurs. Les propriétés biochimiques et structurelles des annexines montrent des interactions de l'annexine avec les lipides et autres ligands biologiques.
Structure
Chaque annexine est composée de deux domaines principaux : la "tête" divergente NH2-terminale et le noyau protéique COOH-terminal conservé. Ce dernier héberge le Ca2+ et les sites de liaison membranaire et est responsable de la médiation des propriétés canoniques de liaison membranaire.
Un noyau d'annexine comprend quatre (dans l'annexine A6 huit) segments d'homologie interne et interannexine qui sont facilement identifiés dans un alignement de séquence linéaire. Il forme un disque fortement hélicoïdal et très compact avec une légère courbure et deux côtés principaux. Le côté le plus convexe contient de nouveaux types de sites de liaison au Ca2+, les sites dits de type II et de type III, et fait face à la membrane lorsqu'une annexine est associée périphériquement à des phospholipides. Le côté le plus concave s'éloigne de la membrane et semble donc accessible pour des interactions avec le domaine NH2-terminal et/ou éventuellement des partenaires de liaison cytoplasmique.
La première structure connue pour un noyau d'annexine était celle résolue par Huber pour l'annexine A5 en 1990. Entre-temps, plus de 10 structures cristallines de noyaux d'annexine ont été décrites montrant une remarquable conservation du pli tridimensionnel global.
Propriétés et fonctions
La famille des annexines chez les vertébrés comprend 12 protéines de liaison au calcium codées par des gènes distincts. Bien que les fonctions des annexines ne soient pas encore complètement élucidées, il est de plus en plus évident que certains membres de cette famille sont impliqués dans la régulation homéostatique de la concentration en ions calcium intracellulaire.
Les annexines ont une plus faible affinité pour le Ca2+ que les protéines de la main E-F, mais cette affinité est augmentée en présence de phospholipides chargés négativement. Cette propriété biochimique déterminante constitue la base d'un paradigme généralisé pour la fonction annexine dans lequel l'élévation de la concentration intracellulaire de Ca2+ pendant la stimulation cellulaire s'accompagne d'une translocation des annexines du cytosol vers la face interne de la membrane plasmique. La régulation spatio-temporelle dépendante du Ca2+ de la localisation subcellulaire est donc susceptible d'être un aspect clé de la fonction de l'annexine, permettant aux annexines d'influencer les activités d'autres protéines membranaires liées de manière périphérique ou intégrales en réponse à des augmentations transitoires de la concentration cytosolique de Ca2+.
La question précise de ce que font les annexines une fois liées à la membrane n'a pas été clairement répondue, mais il est probable que les annexines soient impliquées dans des événements associés à la membrane tels que le regroupement des phospholipides dans les radeaux lipidiques, le contrôle de la fluidité membranaire et les changements structurels de la membrane. cytosquelette au cours de l'endocytose ou de la phagocytose.
Un autre rôle possible des annexines liées à la membrane est la génération et la régulation des flux intracellulaires de Ca2+.
Annexine I (A1)
L'annexine I (A1), ou lipocortine 1, est une protéine codée par le gène ANXA1, situé sur le chromosome 9 humain. L'annexine A1 est une protéine régulée par les glucocorticoïdes possédant à la fois une activité pro- et anti-inflammatoire qui peut être médiée en partie par l'activation de la réponse inflammatoire et antibactérienne (FPR).
Exprimée dans une variété de types cellulaires, l'annexine I est particulièrement abondante dans les neutrophiles, où elle est exprimée à la surface cellulaire externe et sert à inhiber la migration transendothéliale. Bien que l'holoprotéine annexine I et ses peptides N-terminaux (Ac1–26 et Ac9–25) soient des agonistes de la FPR, à de faibles concentrations, ils provoquent des transitoires Ca2+ via la FPR sans activer complètement la voie de la MAP kinase. Ceci est associé à la désensibilisation des neutrophiles et à l'inhibition de la migration transendothéliale induite par d'autres agents chimiotactiques tels que la chimiokine IL-8.
En revanche, à des concentrations élevées, les peptides d'annexine I activent complètement les neutrophiles in vitro et deviennent de puissants stimulants pro-inflammatoires. L'activité anti-migratoire de l'annexine I exogène et endogène a été démontrée dans des modèles d'inflammation aiguë et chronique.
Annexine V (A5)
L'annexine A5 est une protéine qui peut se lier à des membranes biologiques chargées négativement. Le calcium est nécessaire pour se lier à la membrane chargée négativement. L'annexine A5 se lie le mieux aux membranes contenant le phospholipide phosphatidylsérine.
Les membranes biologiques sont constituées d'une double couche de phospholipides. La membrane qui protège la cellule de l'environnement s'appelle la membrane plasmique. Les phospholipides sont chargés négativement du côté tourné vers le cytosol. Les phospholipides face au milieu extérieur sont neutres.
Les cellules en apoptose (mort cellulaire programmée) transportent des phospholipides chargés négativement de la couche interne à la couche externe de la membrane plasmique. En conséquence, la cellule a une surface cellulaire avec des phospholipides chargés négativement à l'extérieur. Cette surface est reconnue par les phagocytes, qui nettoient ensuite la cellule morte.
Annexine A5 (V) et apoptose :
Rôle et action de l'annexine V dans l'apoptose des cellules avec le mécanisme de liaison de l'annexine V avec la phosphatidylsérine de la membrane cellulaire.
L'annexine A5 est utilisée dans les laboratoires pour détecter les cellules mortes. La protéine est munie d'un marqueur fluorescent, après quoi elle est ajoutée aux cellules. La protéine se lie ensuite aux cellules mortes à travers la surface cellulaire négative. Les cellules qui ont lié l'annexine A5 peuvent ensuite être détectées au moyen d'un microscope à fluorescence. L'annexine A5 peut également être marquée radioactivement, ce qui permet de retracer les endroits où la mort cellulaire existe chez les animaux de laboratoire et les humains. Cette technique a le potentiel d'être utilisée à l'avenir pour mieux déterminer l'effet du traitement du cancer, entre autres applications. Il a déjà été utilisé pour cela dans des études cliniques. De plus, il a déjà été utilisé pour déterminer la taille d'une crise cardiaque.
En cytométrie de flux, l'annexine V est couramment utilisée pour détecter les cellules apoptotiques pour sa capacité à se lier à la phosphatidylsérine, un marqueur de l'apoptose lorsqu'elle se trouve dans la couche externe de la membrane plasmique. La fonction de la protéine n'est pas complètement élucidée; cependant, il a été proposé que l'annexine A5 joue un rôle dans l'inhibition de la coagulation sanguine en entrant en compétition pour les sites de liaison de la phosphatidylsérine avec la prothrombine et également pour inhiber l'activité de la phospholipase A1. Ces propriétés ont été trouvées dans des expériences in vitro.
Des anticorps dirigés contre l'annexine A5 sont trouvés chez des patients atteints d'une maladie appelée syndrome des antiphospholipides (APS), une maladie thrombophilique associée à des auto-anticorps contre les composés phospholipidiques.
L'annexine A5 forme un bouclier autour des molécules de phospholipides chargées négativement. La formation d'un bouclier de fixation 5 A5 bloque l'entrée des phospholipides dans les réactions de coagulation. Dans le syndrome des anticorps phospholipidiques, la formation de bouclier est interrompue par des anticorps. Sans le bouclier, il y a plus de molécules de phospholipides dans les membranes cellulaires, accélérant les réactions de coagulation et provoquant la coagulation sanguine caractéristique du syndrome des anticorps phospholipidiques.
L'annexine A5 a montré une expression accrue dans le carcinome papillaire de la thyroïde.
Synonymes, antonymes
Voir tous les synonymes pour "annexine".1 synonyme (sens proche) de "annexine" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ANNEXINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ANNEXINE est dans la page 6 des mots en A du lexique du dictionnaire.
Mots en A à proximité
anneau polaire annélation anneléannélide annexe embryonnaire annexineannuaire des marées anole anomalocaride anomère anomocytique
En rapport avec "annexine"
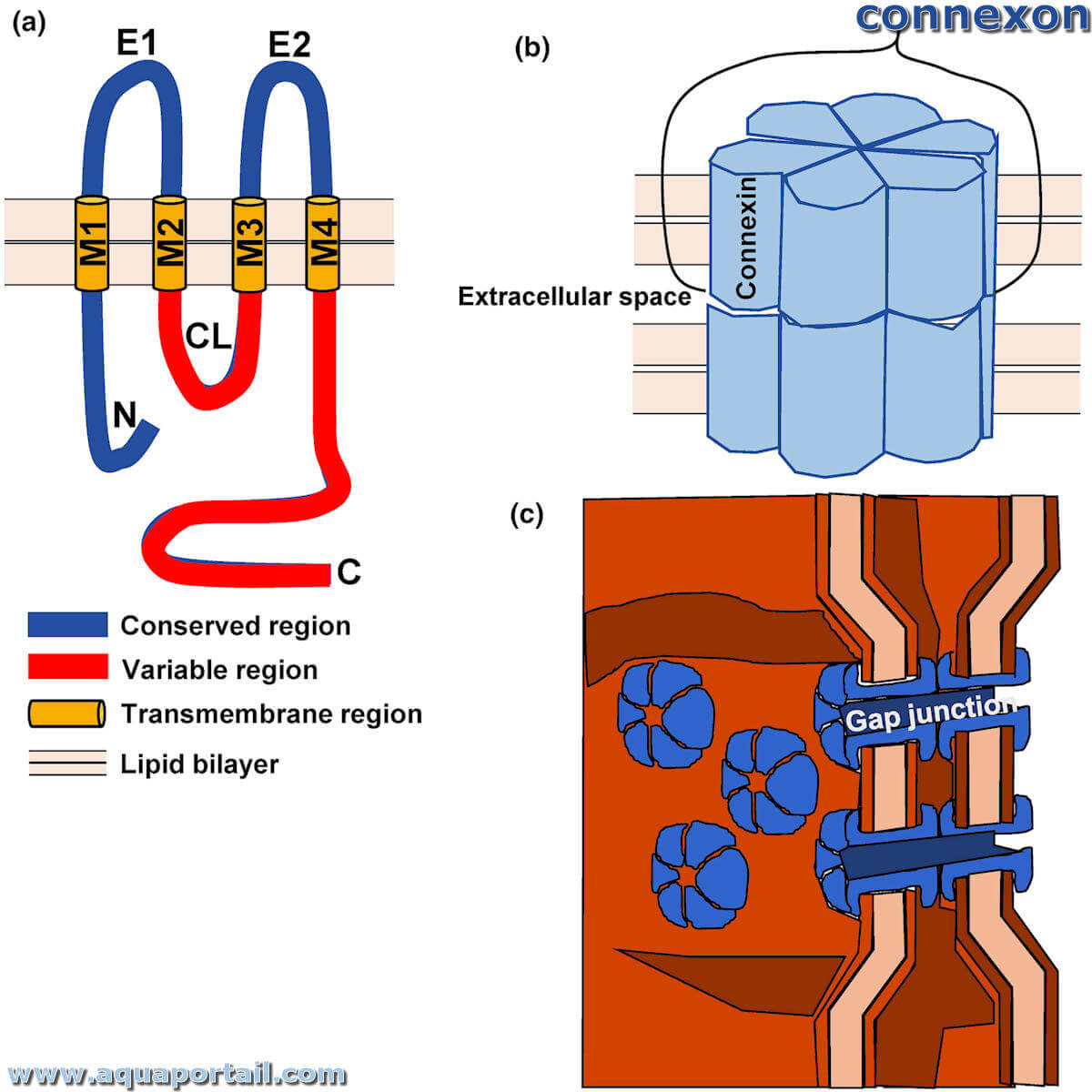
La connexine est une sous-unité protéique formée de 4 hélices α-transmembranaires dans un connexon.
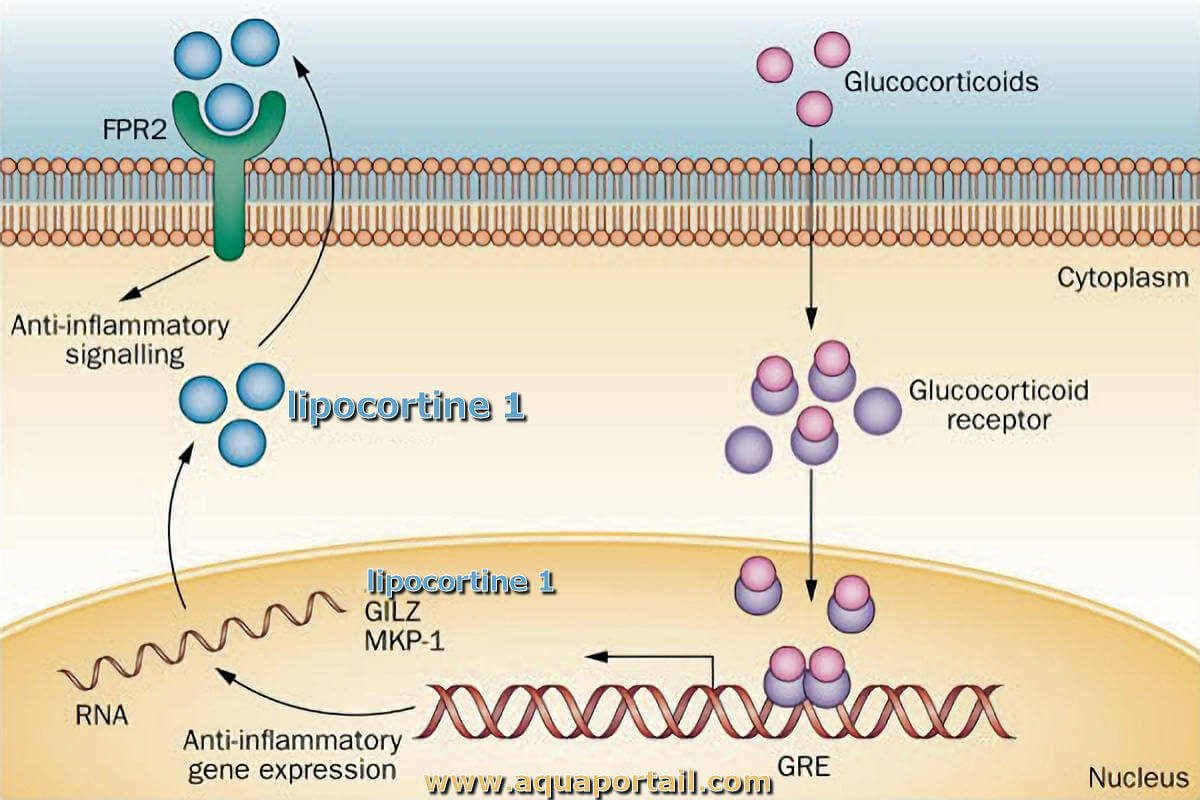
La lipocortine est une protéine sécrétée par les leucocytes, inhibant la synthèse des eicosanoïdes ce qui diminue la réaction inflammatoire.
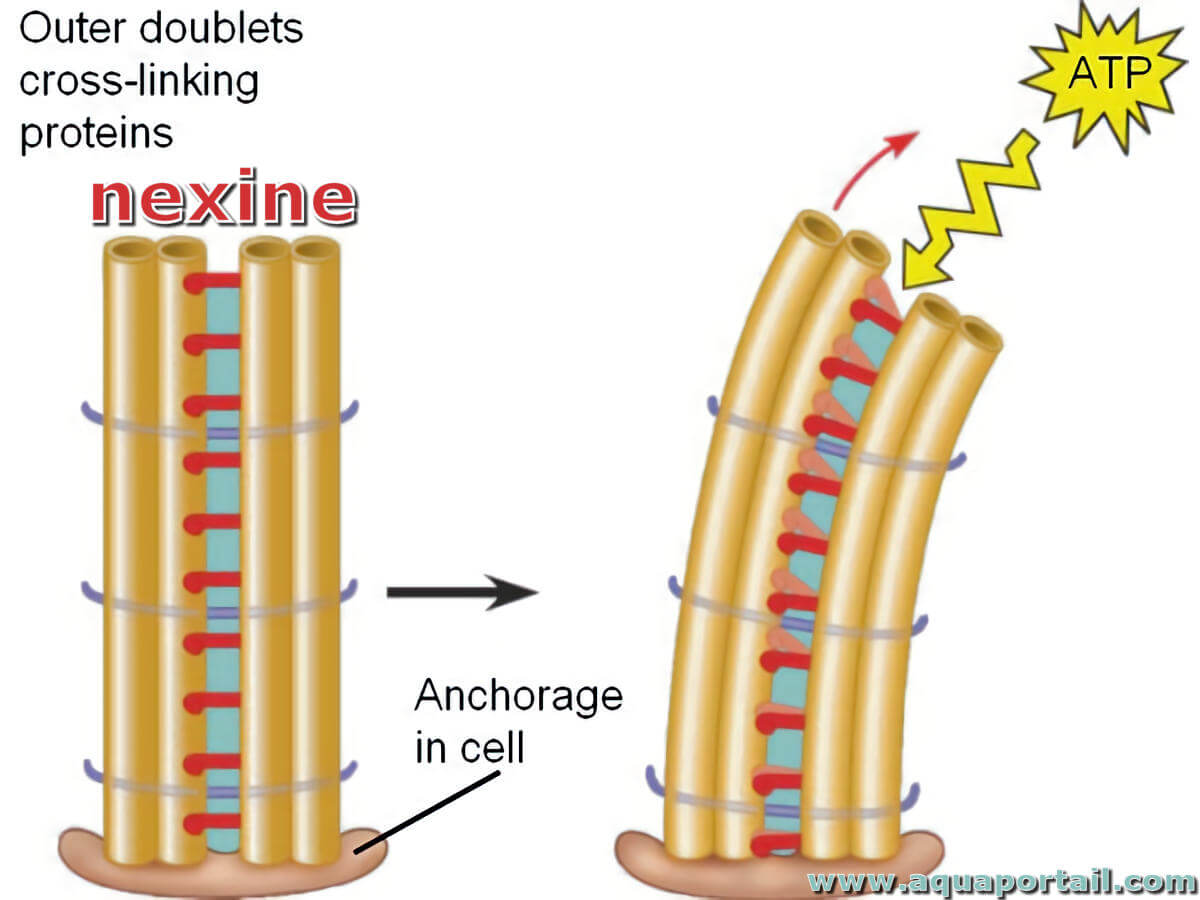
La nexine est une protéine de l'axonème des cils ou des flagelles qui crée une liaison entre deux doublets de microtubules contigus.

Une annexe embryonnaire qualifie chacun des organes extra-embryonnaires qui participent au développement de l'embryon des amniotes en lui assurant nutrition...
