Kinase
Définition
Une kinase est une enzyme qui catalyse une phosphorylation. Les kinases forment un type d'enzyme qui modifie d'autres molécules (substrats), par phosphorylation. La phosphorylation consiste à transférer un groupe phosphate de l'ATP vers un substrat ou une cible spécifique.
Une molécule de kinase :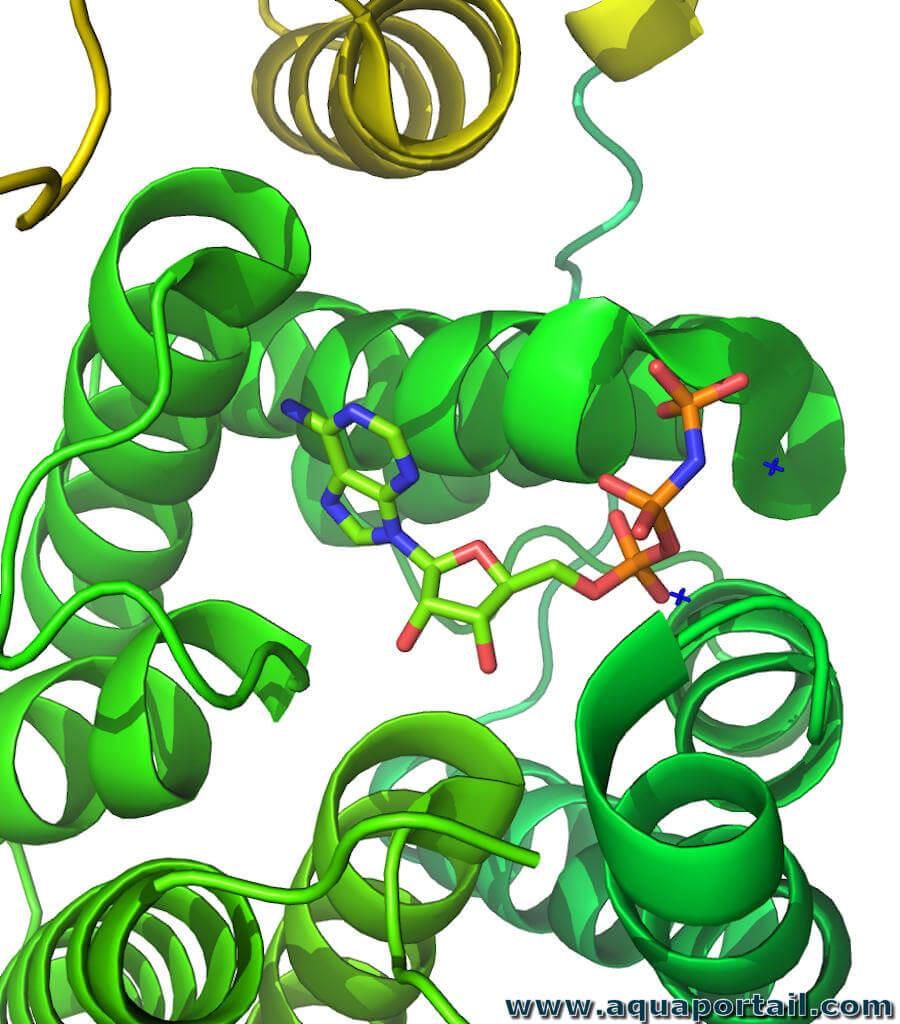
Mise en exergue d'une kinase avec le site actif de la dihydroxyacétone kinase dans le complexe avec AMP-PNP. Les kinases sont critiques dans le métabolisme, la signalisation cellulaire, la régulation des protéines, le transport cellulaire, les processus sécrétoires et de nombreuses autres voies cellulaires, ce qui les rend très importants pour la physiologie humaine. Il y a du carbone et au moins une protéine.
Explications
Toutes les kinases ont besoin d'un ion métallique divalent tel que Mg2+ ou Mn2+ pour transférer le groupe phosphate. Quelques exemples sont : la kinase dépendante de l'AMP, cyclique, (AMP cyclique) et la kinase dépendante de l'ARN double brin. Selon la nomenclature officielle sont ATP (x) phosphotransférases, où (x) = molécule à laquelle le groupe phosphate est transféré.
Les deux processus, la phosphorylation et la déphosphorylation, interviennent quatre fois pendant la glycolyse.
Voir aussi la myokinase (adénylate kinase), une entérokinase, une glucokinase, une hexokinase, une phosphofructokinase, une plasmine et une peptidase.
Protéine-kinase
Les protéines kinases sont un sous-type de kinases, qui agissent sur une protéine en l'activant ou la désactivant. Les kinases occupent donc une place centrale dans les mécanismes de signalisation cellulaire, la cascade de réponse avant un signal chimique qui atteint la cellule : elles servent de pont entre un second messager (généralement AMPc) et les réponses cellulaires au stimulus (activation ou désactivation de facteurs de transcription, par exemple). On estime que jusqu'à 30 % du protéome cellulaire entier est capable de varier son activité par l'action d'une kinase. Le génome humain contient environ 500 gènes qui codent pour la protéine kinase, constituant environ 2 % de tous les gènes.
Une protéine kinase catalyse la réaction d'addition de ce groupe phosphate et cette réaction est unidirectionnelle, l'ATP étant décomposé pour produire l'énergie nécessaire à la réaction. Une protéine-phosphatase fait exactement la réaction inverse des kinases, elle supprime un groupe phosphate, c'est-à-dire qu'elle fait la déphosphorylation. Les cellules contiennent diverses protéines kinases et protéines-phosphatases, chacune étant responsable d'agir sur un groupe particulier ou une protéine particulière. Les protéines kinases appartiennent à une grande famille d'enzymes qui partagent une séquence de 290 acides aminés. Certaines séquences d'acides aminés spécifiques permettent aux kinases de reconnaître des agrégats spécifiques dans les protéines à phosphoryler.
En raison de l'action combinée des protéines kinases et des protéines-phosphatases, nous avons des cycles de phosphorylation, qui est l'une des formes les plus importantes de régulation dans la cellule eucaryote. Ces cycles permettent aux protéines qui sont phosphorylées de passer rapidement d'un état à un autre, en modifiant leur état en réponse à un stimulus externe.
Il est important de noter que l'ajout/l'élimination de phosphate peut affecter la protéine de deux façons. Premièrement, étant donné que le phosphate porte deux charges négatives, l'addition d'un groupe phosphate peut provoquer un changement conformationnel important, principalement par l'attraction de groupes latéraux d'acides aminés chargés positivement.
Deuxièmement, le groupe phosphate peut faire partie d'une structure que les sites de liaison d'autres protéines peuvent reconnaître. Ainsi, l'addition/élimination de phosphate altère la liaison de nouveaux ligands sur la surface de la protéine, étant un mécanisme important de la signalisation cellulaire et fondamentale dans le processus d'assemblage et de désassemblage des complexes protéiques.
Chez la plupart des animaux, l'enzyme qui catalyse la phosphorylation du glucose est l'hexokinase et, dans le foie, la glucokinase.
Kinases dépendantes des cyclines
Les kinases dépendantes des cyclines (CDK) sont un groupe de plusieurs kinases différentes impliquées dans la régulation du cycle cellulaire. Ils phosphorylent d'autres protéines sur leurs résidus sérine ou thréonine, mais les CDK doivent d'abord se lier à une protéine cycline pour être actifs. Différentes combinaisons de CDK et de cyclines spécifiques marquent différentes parties du cycle cellulaire. De plus, l'état de phosphorylation des CDK est également critique pour leur activité, car ils sont soumis à une régulation par d'autres kinases (telles que la kinase activatrice de CDK) et des phosphatases (telles que CDC25). Une fois que les CDK sont actives, elles phosphorylent d'autres protéines pour changer leur activité, ce qui conduit à des événements nécessaires pour la prochaine étape du cycle cellulaire. Alors qu'ils sont les plus connus pour leur fonction dans le contrôle du cycle cellulaire, les CDK jouent également un rôle dans la transcription, le métabolisme et d'autres événements cellulaires.
En raison de leur rôle clé dans la division cellulaire de contrôle, les mutations dans les CDK sont souvent trouvés dans les cellules cancéreuses. Ces mutations conduisent à une croissance incontrôlée des cellules, où elles traversent rapidement le cycle cellulaire entier à plusieurs reprises. Les mutations CDK peuvent être trouvées dans les lymphomes, le cancer du sein, les tumeurs pancréatiques et le cancer du poumon. Par conséquent, des inhibiteurs de la CDK ont été développés en tant que traitements pour certains types de cancer.
Protéines kinases activées par des mitogènes
Les protéines kinases activées par des mitogènes (MAPK) sont une famille de sérine / thréonine kinases qui répondent à une variété de signaux de croissance extracellulaires. Par exemple, l'hormone de croissance, le facteur de croissance épidermique, le facteur de croissance dérivé des plaquettes et l'insuline sont tous considérés comme des stimuli mitogéniques capables d'engager la voie MAPK. L'activation de cette voie au niveau du récepteur initie une cascade de signalisation pour continuer à réguler la transcription et la traduction. Alors que RAF et MAPK sont toutes deux des sérine / thréonine kinases, MAPKK est une tyrosine/thréonine kinase.
Le potentiel cancérogène de la voie MAPK la rend cliniquement significative. Il est impliqué dans les processus cellulaires qui peuvent conduire à une croissance incontrôlée et à la formation ultérieure de tumeurs. Les mutations dans cette voie modifient ses effets régulateurs sur la différenciation, la prolifération, la survie et l'apoptose des cellules, qui sont toutes impliquées dans diverses formes de cancer.
Kinases lipides
Les lipides kinases phosphorylent les lipides dans la cellule, aussi bien sur la membrane plasmique que sur les membranes des organites. L'addition de groupes phosphate peut changer la réactivité et la localisation du lipide et peut être utilisée dans la transmission du signal.
Hydrates de carbone
Pour de nombreux mammifères, les hydrates de carbone fournissent une grande partie des besoins caloriques quotidiens. Pour récolter l'énergie des oligosaccharides, ils doivent d'abord être décomposés en monosaccharides afin qu'ils puissent entrer dans le métabolisme. Les kinases jouent un rôle important dans presque toutes les voies métaboliques. La liaison anhydride dans le 1,3 bisphosphoglycérate est instable et a une énergie élevée. La 1,3-bisphosphoglycérate kinase nécessite l'ADP pour effectuer sa réaction donnant le 3-phosphoglycérate et l'ATP. Dans l'étape finale de la glycolyse, la pyruvate kinase transfère un groupe phosphoryle du phosphoénolpyruvate à l'ADP, générant de l'ATP et du pyruvate.
L'hexokinase est l'enzyme la plus courante qui utilise le glucose lorsqu'elle entre pour la première fois dans la cellule. Il convertit le D-glucose en glucose-6-phosphate en transférant le phosphate gamma d'un ATP à la position C6. C'est une étape importante dans la glycolyse car elle piège le glucose à l'intérieur de la cellule en raison de la charge négative. Dans sa forme déphosphorylée, le glucose peut se déplacer très facilement d'avant en arrière à travers la membrane. Des mutations dans le gène de l'hexokinase peuvent conduire à une déficience en hexokinase pouvant entraîner une anémie hémolytique non sphérocytaire.
La phosphofructokinase (PFK), catalyse la conversion du fructose-6-phosphate en fructose-1,6-bisphosphate et est un point important dans la régulation de la glycolyse. Des niveaux élevés d'ATP, de H+ et de citrate inhibent PFK. Si les niveaux de citrate sont élevés, cela signifie que la glycolyse fonctionne à un rythme optimal. Des niveaux élevés d'AMP stimulent PFK. La maladie de Tarui, une maladie du stockage du glycogène qui conduit à l'intolérance à l'exercice, est due à une mutation du gène PFK qui réduit son activité.
Autres kinases
Les kinases agissent sur de nombreuses autres molécules en plus des protéines, des lipides et des hydrates de carbone. Nombreux sont ceux qui agissent sur les nucléotides (ADN et ARN), y compris ceux impliqués dans l'interconversation des nucléotides, tels que les nucléoside-phosphate kinases et les nucléoside-diphosphate kinases. D'autres petites molécules qui sont des substrats de kinases incluent la créatine (créatine kinase, phosphocréatine, système phosphagène), le phosphoglycérate, la riboflavine, la dihydroxyacétone, le shikimate, l'urokinase et beaucoup d'autres.
La riboflavine kinase catalyse la phosphorylation de la riboflavine pour créer le mononucléotide flavine (FMN). Il a un mécanisme de liaison ordonné où la riboflavine doit se lier à la kinase avant qu'il se lie à la molécule d'ATP. Les cations divalents aident à coordonner le nucléotide.
La thymidine kinase est l'une des nombreuses nucléosides kinases responsables de la phosphorylation des nucléosides. Il phosphoryle la thymidine pour créer du thymidine monophosphate (dTMP). Cette kinase utilise une molécule d'ATP pour fournir le phosphate à la thymidine, comme indiqué ci-dessous. Ce transfert d'un phosphate d'un nucléotide à un autre par la thymidine kinase, ainsi que d'autres nucléosides et nucléotides kinases, a pour fonction d'aider à contrôler le niveau de chacun des différents nucléotides.
Synonymes, antonymes
Voir tous les synonymes pour "kinase".7 synonymes (sens proche) de "kinase" :
- enzyme
- fructokinase
- glucokinase
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à KINASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot KINASE est dans la page 1 des mots en K du lexique du dictionnaire.
Mots en K à proximité
keris kieselguhr killi kilodalton kilogramme kinasekinésie kinésine kinésis kinétochore kinine
En rapport avec "kinase"
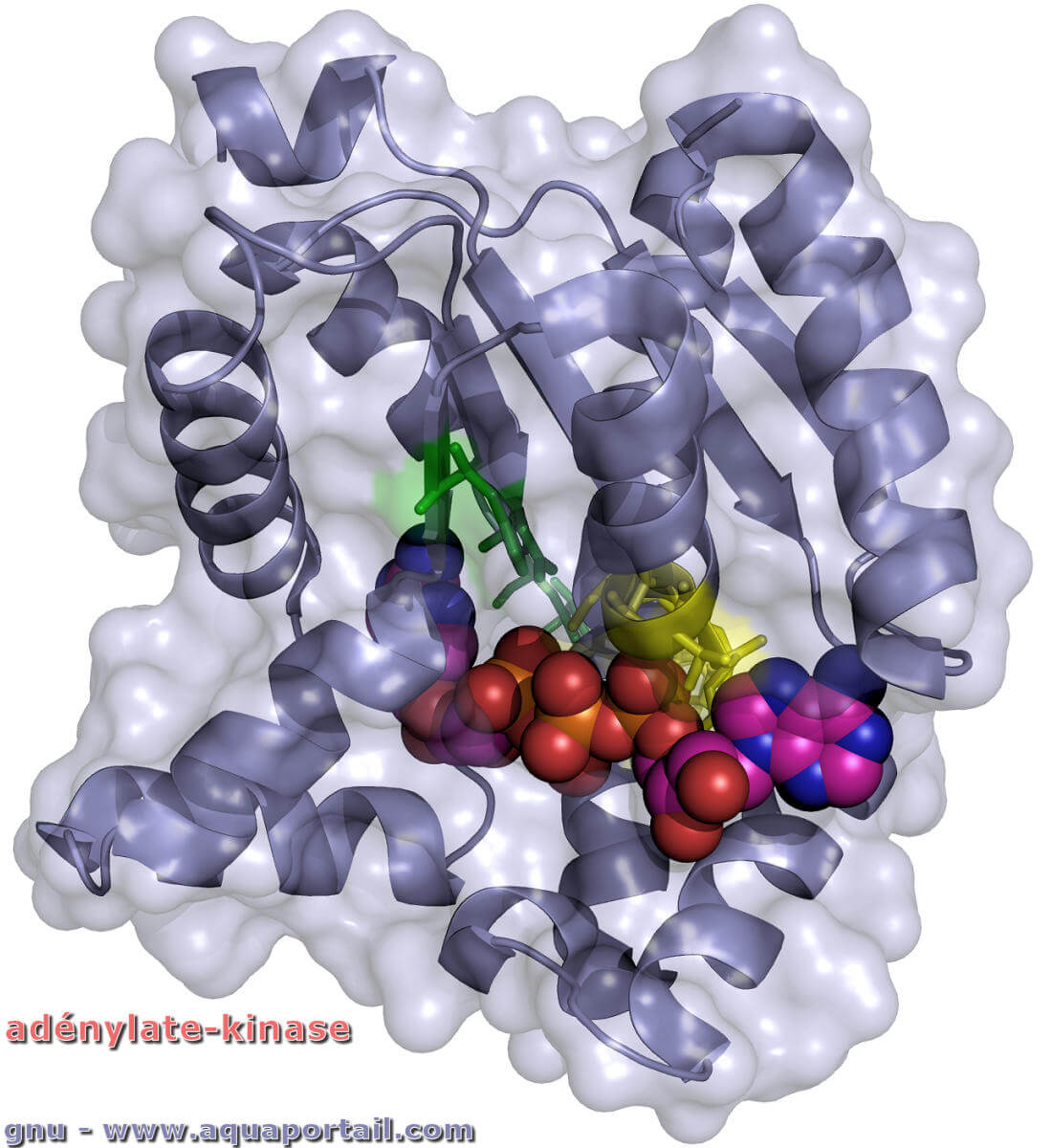
L'adénylate kinase, adényl-kinase ou myokinase, est une enzyme abondante dans les muscles, où elle y catalyse la réaction de transphosphorylation...
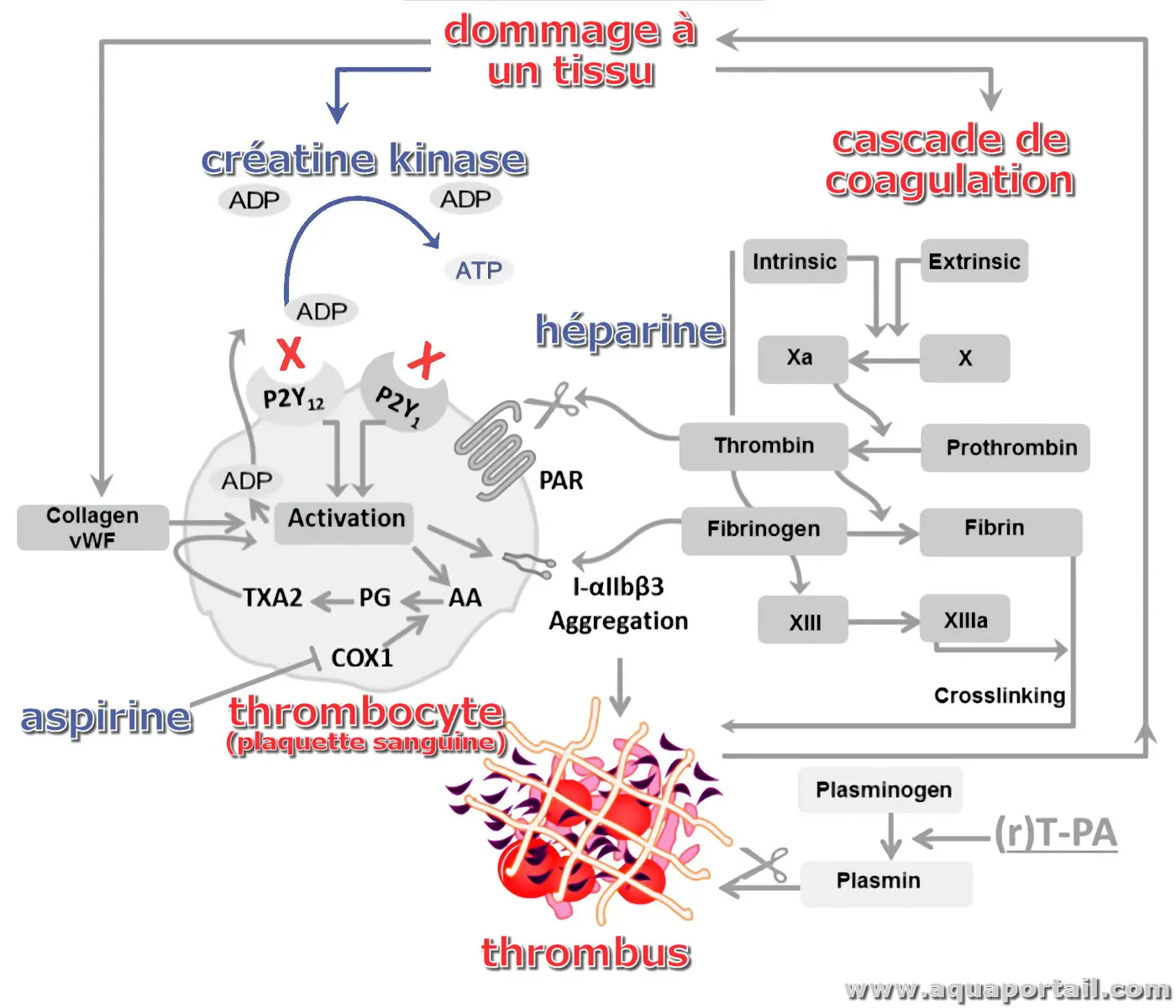
La créatine kinase (CK) est une enzyme spécifique du muscle, et par conséquent, le degré de sa présence dans le sérum peut être utilisé comme marqueur...
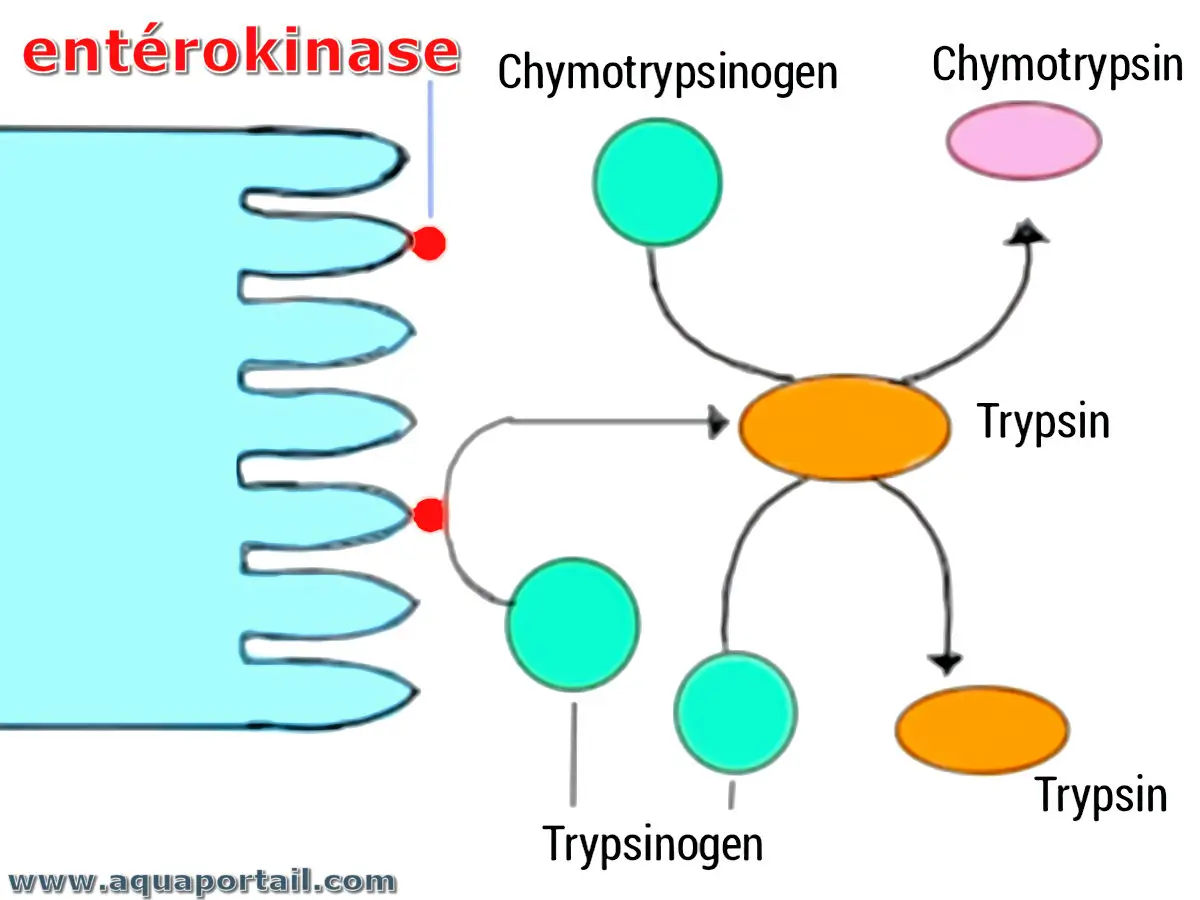
Une entérokinase, ou entéropeptidase, participe à la digestion des protéines. Elle est une enzyme dans l'intestin grêle avec un rôle de conversion...
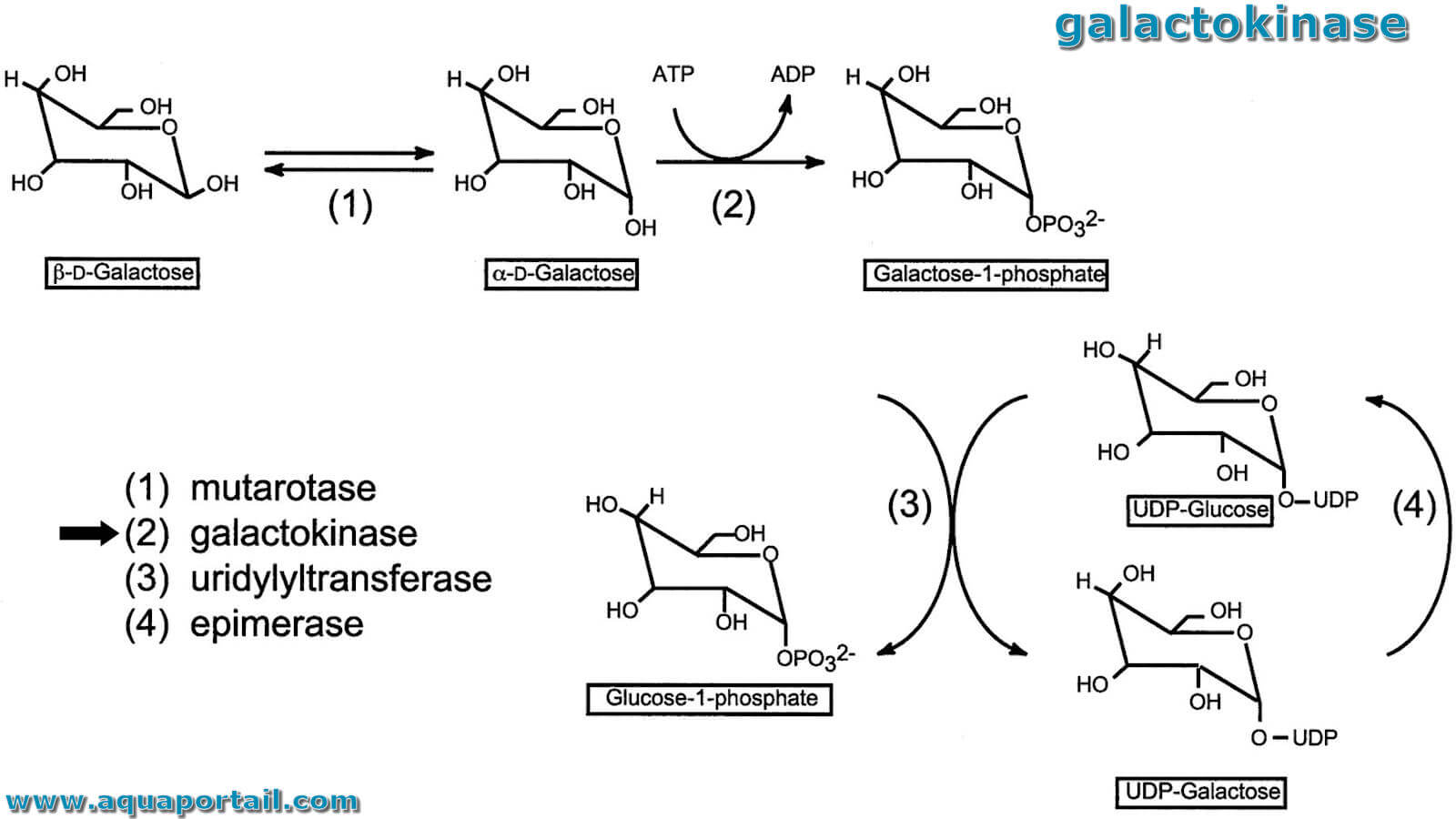
Une galactokinase est une enzyme hépatique (phosphotransférase) qui catalyse la phosphorylation du galactose en galactose-1-phosphate aux dépens d'une...
